Введение
Cовременная диагностика хронической болезни почек (ХБП), cогласно отечественным и зарубежным рекомендациям, основана на оценке скорости клубочковой фильтрации (СКФ), изменений мочевого осадка, данных нефробиопсии и визуализирующих методов исследования [1]. Среди визуализирующих методов особое место по широте применения и доступности занимает ультразвуковое исследование (УЗИ) почек, позволяющее неинвазивно оценивать размеры, форму, расположение, наличие структурных изменений. Однако морфологические изменения, связанные с нарушением функции почек, в т.ч. размер почек, толщина паренхимы и эхогенность коры, не специфичны для оценки дисфункции почек. Кроме того, известно, что морфологические изменения, выявляемые посредством УЗИ, появляются гораздо позже лабораторных изменений, в т.ч. повышения уровня креатинина сыворотки. Вместе с тем использование допплерографии (ДГ) совместно с проведением УЗИ существенно расширяет возможности данного метода, позволяя не только визуализировать почечные сосуды, но и давать количественную и качественную характеристику интраренального кровотока [2, 3]. Среди массы показателей, применяемых в допплерографии, особое место занимает индекс резистентности (RI) – параметр, наиболее изученный применительно к интраренальному кровотоку [1]. В последние годы отмечается высокий интерес к данному показателю в плане его применения для ранней диагностики нефропатий различного генеза, таких как оценка состояния почечного трансплантата, раннее выявление гипертонической нефропатии, оценка обратимости острого почечного повреждения и прогрессирования ХБП [4–7]. Исследования последних лет доказывают, что RI не только отражает внутрипочечные патологические процессы, но и является продуктом сложного взаимодействия почечных и системных свойств сосудистой стенки, а также некоторых гемодинамических факторов [8, 9]. Подтверждена его роль в качестве важного предиктора прогрессирующей почечной дисфункции и неблагоприятных сердечно-сосудистых событий, а также взаимосвязь с различными гистологическими и биохимическими маркерами почечного повреждения [6, 7]. В связи с этим перспективным является изучение данного параметра у больных хронической обструктивной болезнью легких (ХОБЛ), т.к. в настоящее время ХОБЛ расценивается как системное заболевание, способствующее развитию эндотелиальной дисфункции [10]. Оценка информативности RI в диагностике дисфункции почек у больных ХОБЛ до настоящего времени не проводилась. Между тем за последние десятилетия появились данные о высокой частоте ХБП среди больных ХОБЛ, достигающей 30–50% [11–13].
Поэтому целью нашего исследования стало изучение особенностей внутрипочечного кровотока у больных ХОБЛ методом допплерографии и оценка диагностической значимости отдельных его параметров во взаимосвязи с основными клинико-лабораторными маркерами дисфункции почек.
Материал и методы
В исследование включены 198 пациентов ГБУЗ ККБ № 2 Краснодара (пульмонологических отделений многопрофильного стационара и поликлиники СКАЛ) с диагнозом ХОБЛ (69,6% мужчин, средний возраст – 65,9±10,8 года, средний стаж болезни – 17,2±2,2 года; 30,3% женщин, средний возраст – 62,1±6,9 года, средний стаж болезни – 8,7±2,1 года) и 28 здоровых добровольцев, сопоставимых по возрасту и полу. Диагноз ХОБЛ установлен в соответствии с рекомендациями GOLD (2013) с учетом количества обострений в году, тяжести одышки по модифицированной шкале MRC (mMRC), качества жизни по шкале респираторного вопросника госпиталя Св. Георгия (SGRQ) для больных ХОБЛ, показателей 6-минутного шагового теста (6-МШТ), оценочного САТ-теста, оценки вентиляционной функции легких [14]. Оценку вентиляционной функции проводили на спирографе EasyOne Pro фирмы Ultrasound Spirometry Lab (Швейцария). Пациенты разделены на 4 группы: группы А и В – с редкими (0–1 в год), группы С и D – с частыми (≥2 в год) обострениями; группы А и D – с маловыраженными, группы В и C с выраженными симптомами. Ультразвуковое исследование (УЗИ) почек выполнялось на аппарате «Toshiba Xario» конвексным датчиком 3,5 МГц. В начале исследования проводилась визуализация почек в В-режиме с оценкой положения, размеров, формы, толщины паренхимы, наличия структурных изменений, дыхательной подвижности почек. При ЦДК оценивались качественные характеристики кровотока в паренхиме почек, при этом за норму принимали интраренальный кровоток, прослеживаемый до почечной капсулы, без признаков обеднения, с последующей корректировкой шкалы и чувствительности. Количественная оценка почечного кровотока проводилась при импульсноволновой допплерометрии (PW) устья почечной артерии (ПА), а также сегментарной (СА), междолевой (МА) и дуговой артерий (ДА), с определением максимальной систолической скорости (Vps), минимальной диастолической скорости (Ved), усредненной по времени максимальной скорости кровотока (TAMx). Учитывая высокую зависимость значений количественных показателей от величины угла между продольной осью сосуда и ультразвуковым лучом, а также техническую сложность коррекции данного угла на уровне дистальных сосудов почек, проводился расчет индекса резистентности Пурсилота (RI) как отношение разности максимальной систолической скорости и пиковой диастолической скорости кровотока к величине минимальной диастолической скорости: RI=Vps–Ved/Ved [2, 3].

С целью определения функции почек всем пациентам проводился расчет скорости клубочковой фильтрации (СКФ) по формуле СKD-EPI на основании сывороточного креатинина, а также исследование уровня альбуминурии (АУ) и креатининурии в разовой утренней порции мочи с последующим расчетом соотношения альбумин–креатинин (Ал/Кр) [1]. С целью изучения состояния канальцевого аппарата почек проводили исследование экскреции β2-микроглобулина (β2-МГ) [15]. В качестве альтернативного маркера почечной дисфункции исследовался уровень сывороточного цистатина С иммунотурбидиметрическим методом («Сystatin C-FS», DiaSys, Германия) [16]. Альбуминурия и экскреция β-2МГ определялись турбидиметрическим методом с латексным усилением. Креатинин мочи: кинетический тест, основанный на реакции Яффе. Все исследования выполнены на автоматическом анализаторе для клинической химии AU640 с использованием реагентов производства Beckman Coulter (США) и BioSystems (Испания) в централизованной лаборатории ООО «Фрезениус Медикал Кеа Кубань».
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом КубГМУ (протокол заседания № 32 от 21.10.2014). До включения в исследование от всех пациентов было получено письменное информированное согласие.
Статистическая обработка проведена методами вариационной статистики с использованием пакета статистической программы Statistica 10,0 for Windows. Статистическую значимость межгрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA). Корреляционный анализ проводился путем расчета коэффициента корреляции Пирсона (r), при этом связи считали достоверными при p<0,05. Для оценки статистической значимости различий двух или нескольких относительных показателей использован критерий χ2. Разница считалась достоверной при достигнутом уровне значимости р<0,05. Данные представлены в виде М±SD. Для оценки прогностической значимости показателей почечного кровотока был применен ROC (Receiver Operating Characteristic) – анализ с построением одноименных кривых.
Результаты
Основная клинико-лабораторная характеристика больных представлена в табл. 1.
По данным УЗИ, у 53% (105) пациентов выявлены патологические изменения со стороны почек: наличие синусных и паренхиматозных кист – у 40,4% (80) пациентов, конкременты – у 10,6% (21), нефроптоз – у 3,0% (6), аномалии развития почек (полное/неполное удвоение, дистопия) – у 2,5% (5) пациентов, сочетание 2 и более патологических изменений наблюдалось у 27,3% (54) пациентов. Достоверных различий по толщине паренхимы, длине, ширине почек в зависимости от частоты обострений и выраженности симптомов ХОБЛ, показателей бронхиальной обструкции не выявлено. Влияния степени тяжести ХОБЛ на частоту структурных изменений в виде кист, конкрементов и аномалий развития почек также не выявлено (χ2=1,99, p>0,05). Частота нефроптоза, напротив, оказалась достоверно выше в группах с частыми обострениями (0% в группах А и В vs 3,0% и 9,5% в группах С и D соответственно, χ2=5,16, p<0,05). При межгрупповом сравнении по t-критерию Стьюдента достоверных различий между скоростными характеристиками (Vps и Ved), а также усредненной по времени максимальной скорости почечного кровотока (ТАМх) выявлено не было (p>0,05). Наименьшие средние уровни RI выявлены в группе контроля и группах с редкими обострениями (А и В), однако различия были статистически не достоверными (p>0,05).
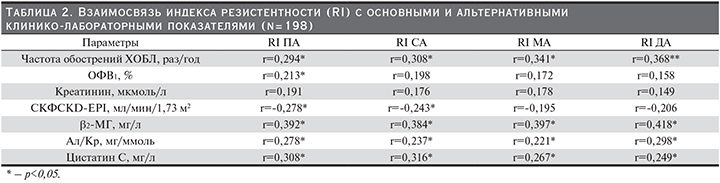
Проведен анализ корреляционной взаимосвязи между RI почечного кровотока на всех исследованных нами уровнях с основными и альтернативными лабораторными маркерами почечной дисфункции, а также частотой обострений ХОБЛ и тяжестью обструктивных нарушений (табл. 2).
Выявлена слабая положительная корреляция между RI устья ПА и частотой обострений, средней силы корреляции данных показателей получены при исследовании дистального кровотока (p<0,05). Между тяжестью обструктивных нарушений и резистентностью почечного кровотока выявлена достоверная корреляция лишь на уровне устья ПА. Обратные корреляции получены при анализе взаимосвязи индекса сосудистого сопротивления с рСКФCKD-EPI, наиболее сильная из которых обнаружена на уровне устья ПА. Уровень цистатина С показал наиболее сильную взаимосвязь с резистентностью почечных сосудов на проксимальном уровне. Для β2-МГ и АУ (Ал/Кр), напротив, получены наиболее сильные корреляции на уровне ДА.
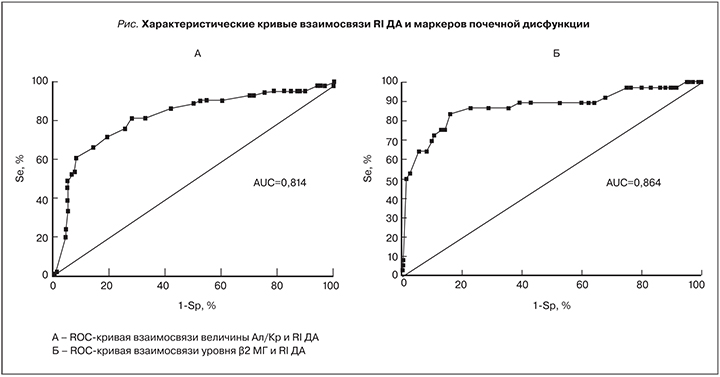
При проведении ROC-анализа для оценки прогностической значимости RI почечных артерий учитывался уровень АУ>3,0 мг/моль как ранний маркер поражения клубочков. Выявлено, что RI ПА имеет площадь под ROC-кривой (AUC), равную 0,749, что характеризует ее качество как хорошее, причем чувствительность достигала 62,6%, а специфичность 76,5%. AUC для RI СА составила 0,762, при этом чувствительность составила 74,7%, специфичность – 81,3%. Практически сопоставимые с предыдущими данные получены для RI МД, где AUC=0,774, чувствительность – 77,4%, специфичность – 83,7%. Следовательно, наибольшей прогностической значимостью, согласно проведенному анализу, обладает IR ДА, где значение AUC составило 0,814, что характеризуется как очень хорошее качество, при этом точка перегиба кривой составила 0,663 с чувствительностью 81,1% и специфичностью 71,6% (см. рисунок). При проведении ROC-анализа для оценки прогностической значимости RI почечных артерий в диагностике канальцевой дисфункции (при уровне β2-МГ>0,25 мг/л) также выявлено наибольшее диагностическое значение RI ДА. Площадь под ROC-кривой при анализе этих показателей составила 0,864 с точкой перегиба 0,703, чувствительностью 83,3% и специфичностью 83,6% (см. рисунок).
Обсуждение
Отсутствие статистической разницы между размерами почек в исследуемых нами группах больных ХОБЛ обусловлено тем, что этот показатель в большей степени зависит от антропометрических данных [2, 3]. Частота выявления кист почек в нашем исследовании достигла 40,4%, что в 2 раза выше общепопуляционных показателей для данной возрастной группы. Так, в исследовании N. Terada и соавт., включившем 17 914 пациентов различных возрастных групп, выявлено, что у пациентов старше 60 лет распространенность кист почек составила 18,5% (13% у мужчин и 5,5% у женщин).
К основным факторам риска развития кист почек, по мнению данных ученых, относятся возраст, мужской пол и нарушение функции почек [17]. Таким образом, более высокую частоту кист почек среди больных ХОБЛ можно объяснить преобладанием лиц мужского пола, возрастной категорией больных, кроме того, не исключено влияние основного заболевания на работу почек, что также находит свое подтверждение в некоторых исследованиях [11, 13]. Кроме того, в группах с высокой частотой обострений достоверно чаще встречались пациенты с нефроптозом что, по-видимому, обусловлено снижением массы тела, связанным с развитием белковоэнергетической недостаточности – характерным системным проявлением ХОБЛ [12, 14].
Результаты нашего исследования показали наличие взаимосвязи между альбуминурией и резистентностью интраренальных сосудов. Эти данные сопоставимы с результатами недавно проведенного 4-летнего наблюдения, доказавшего роль повышения RI>0,7 наряду с такими известными факторами, как протеинурия, снижение СКФ и артериальная гипертензия, в качестве предикторов прогрессирования дисфункции почек [18]. В недавно опубликованном исследовании Y. Doi и соавт. в группе из 288 пациентов наиболее высокие значения RI были обнаружены у лиц с доклиническим поражением органов-мишеней в виде наличия утолщения комплекса интима-медиа, гипертрофии левого желудочка (ГЛЖ), АУ [19].
В исследовании J. Hashimoto и соавт. также показана значимая корреляция между индексами резистентности почечных сосудов и величиной Ал/Кр-соотношения [20].
Ассоциация RI и цистатина С, полученная в нашем исследовании, находит свое подтверждение в исследовании Т. Okura и соавт., показавшем, что уровень RI является единственным независимым фактором, предсказывающим изменения уровня цистатина С и вместе с тем – дисфункции почек [9]. Нами получены обратные корреляции между рСКФCKD–EPI и резистентностью внутрипочечных сосудов, демонстрирующие взаимосвязь RI с функцией почек. Аналогичные данные были получены T. Namikoshi и соавт., где RI почечных сосудов помимо Ал/Кр достоверно коррелирует с рСКФ [21]. В исследовании N. Bigé путем множественной линейной регрессии, включая возраст, величину рСКФ, пульсового давления и размеры почек, было показано, что возраст и уровень СКФ были независимо связаны с RI, при этом RI>0,65 – с тяжестью интерстициального фиброза и прогрессирования дисфункции почек [22].
В качестве маркера канальцевой дисфункции нами была выбрана мочевая экскреция β2-МГ и получены данные о его достоверно более высоких уровнях у пациентов с частыми обострениями, что свидетельствует о развитии при ХОБЛ не только клубочковой протеинурии, проявляющейся альбуминурией, но и канальцевой потери белка [15]. Нами получена достоверная взаимосвязь β2-МГ с резистентностью внутрипочечного кровотока, наиболее выраженная на дистальном уровне, что, по-видимому, происходит по причине нарушения ауторегуляции почечного кровотока вследствие увеличения сосудистого сопротивления и внутрисосудистого давления [23]. Полученные нами более высокие средние уровни RI у больных частыми обострениями ХОБЛ также объяснимы системными проявлениями ХОБЛ в виде артериальной ригидности, дисфункции эндотелия и гипоксии, повышающими сопротивляемость почечных сосудов у данных больных. Результаты проведенного нами анализа прогностической значимости RI ДА относительно клубочковых и интерстициальных поражений показали высокую чувствительность и специфичность данного индекса относительно клубочковых и канальцевых поражений почек.
Таким образом, результаты нашего исследования позволяют считать целесообразным измерение RI почечных артерий у больных ХОБЛ. Это обусловлено тем, что резистентность почечного кровотока не только отражает наличие дисфункции почек на доклинической стадии, но и позволяет оценивать возможность ее прогрессирования.
Выводы
- Выявлено влияние частоты обострений ХОБЛ на индекс резистентности почечных артерий.
- Получены достоверные корреляции между RI и лабораторными маркерами почечной дисфункции, наибольшая прогностическая значимость выявлена для RI дуговых артерий.
- Достоверные взаимосвязи между уровнем RI, лабораторными маркерами дисфункции почек и степенью тяжести ХОБЛ демонстрируют возможность практического применения допплерографии для диагностики и оценки прогрессирования дисфункции почек у пациентов с ХОБЛ.



