В течение последних лет отмечена тревожная тенденция в медицине: все чаще и чаще мы сталкиваемся с различными вариантами тромботических микроангиопатий (ТМА).
С одной стороны, это связано с улучшением осведомленности и симптомокомплекса ТМА, с другой – с изменением возможностей диагностики. Например, до недавнего времени при возникновении тромбоцитопении и гемолитической анемии во время беременности обсуждался только HELLP-синдром. В то же время такие физиологические гестационные изменения, как увеличение мультимеров фактора Виллебранда (фВ) и снижение активности расщепляющей их металлопротеиназы ADAMTS13, а также активация системы комплемента, создают предпосылки к реализации иных форм ТМА во время беременности и в ранний послеродовый период: тромботической тромбоцитопенической пурпуры (ТТП), атипичного гемолитико-уремического синдрома (аГУС) и катастрофического антифосфолипидного синдрома (КАФС).
Умение различать разные варианты ТМА особенно важно в нефрологических и реанимационных отделениях, ведь острое повреждение почек (ОПП) у взрослых, связанное с микроангиопатической гемолитической анемией (МАГА) и тромбоцитопенией, представляет диагностические и терапевтические проблемы, поскольку существует множество различных причин, которые не всегда можно быстро распознать, и методы лечения широко варьируются.
Кроме этого в связи с ростом септических осложнений, в т.ч. и фульминантных форм, увеличилось количество вторичных ТМА, ассоциированных с инфекцией. При этом именно клиническая картина ТМА может выходить на первый план в течении септического процесса, тогда как температуры и других признаков инфекции может не быть.
ТМА могут развиваться относительно медленно, что хорошо известно нефрологам. Когда волны тромботической окклюзии сосудов микроциркуляторного русла почек сменяются затишьем, в момент которого репаративные способности эндотелия и определяют дальнейший ход болезни. ТМА в акушерской практике развиваются лавинообразно и требуют быстрого решения о выборе тактики лечения. В связи с тем что ТТП, аГУС, КАФС и септическая ТМА встречаются относительно редко, их проявления практически идентичны, а терапевтические подходы к ведению таких пациенток различаются, проведение дифференциальной диагностики представляется крайне важным и зачастую определяющим прогноз мероприятием.
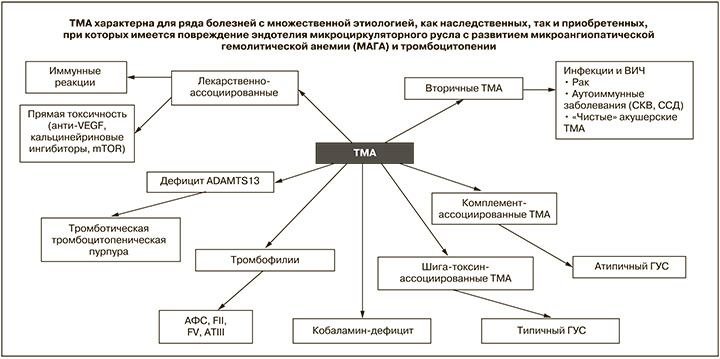
ТМА – клинико-морфологический синдром, проявляющийся МАГА и тромбоцитопенией, которые развиваются вследствие окклюзии сосудов микроциркуляторного русла различных органов, тромбами, содержащими агрегированные тромбоциты и фибрин.
В основе большинства акушерских ТМА лежит повреждение эндотелиальных клеток микроциркуляторного русла, опосредованное различными патогенетическими механизмами, но проявляющееся сходной клинической симптоматикой и морфологическими признаками. Вследствие повреждения эндотелия развивается их отек, отслойка от базальных мембран и тромбирование мелких сосудов. Таким образом, ТМА – особый тип поражения сосудов микроциркуляции, приводящий к тромбозу и асептическому воспалению сосудистой стенки. Морфологическая картина всех ТМА неспецифична, в связи с чем нельзя ориентироваться только на данные гистологического исследования для верификации диагноза.
В настоящее время достигнуты значительные успехи в понимании этиологии и патогенеза различных вариантов ТМА, что позволило создать новую классификацию, в которой выделяют т.н. первичные варианты, когда ТМА развивается в отсутствие других заболеваний, и вторичные, когда ТМА развивается вторично при наличии другой болезни.
К первичным ТМА относят тромботическую тромбоцитопеническую пурпуру (ТТП) – тяжелый дефицит фермента ADAMTS13 (активность менее 10%), типичный ГУС (инфекционно-опосредованный), ранее называемый постдиарейным, или Д+ГУС, который в настоящее время получил другое название – STEC-ГУС (Shiga-Toxin, продуцирующая Esherihia сoli), вызываемый бактериями, продуцирующими шигатоксин (STx), в первую очередь E. coli, и атипичный ГУС – ранее именовавшийся не ассоциированным с диареей, или Д «-» ГУС. АГУС представляет собой комплемент-опосредованную ТМА, развивающуяся вследствие избыточной активации системы комплемента, у большей половины пациентов обусловленной генетическими нарушениями регуляторных белков системы комплемента.
Наряду с первичными существуют многочисленные вторичные ТМА, развитие которых связано с различными заболеваниями или состояниями, например ТМА, ассоциированные с беременностью («чистые акушерские ТМА»: преэклампсия/эклампсия, HELLP-синдром), ТМА, ассоциированные с аутоиммунными заболеваниями: системной красной волчанкой (СКВ), системной склеродермией, антифосфолипидным синдромом (АФС), в рамках которого может реализовать себя катастрофический АФС (КАФС). Хорошо известны инфекционно-ассоциированные ТМА (в т.ч. ВИЧ-ассоциированная) и ТМА, ассоциированная со злокачественными новообразованиями. Описаны также варианты ТМА, ассоциированной с лекарственными препаратами: хинином, интерфероном, ингибиторами кальцинейрина, противоопухолевыми препаратами, оральными контрацептивами, валациклавиром и др.
ТМА диагностируется при наличии тромбоцитопении и микроангиопатического гемолиза в сочетании с признаками поражения хотя бы одного органа.
Основным признаком механического микроангиопатического гемолиза является шизоцитоз, возникающий из-за фрагментации эритроцитов нитями фибрина в тромбированных мелких сосудах (капиллярах, прекапиллярах и концевых артериолах).
В крови здорового человека шизоцитов нет, но процедура забора крови и приготовления мазка может приводить к фрагментации самых хрупких клеток, что отражается в ложноположительном шизоцитозе. Поэтому нормальное количество шизоцитов при условии выполнения всех правил подсчета не должно превышать 0,2% от общего количества эритроцитов.
Из фрагментированных в сосудистом русле эритроцитов высвобождаются лактатдегидрогеназа (ЛДГ) и гемоглобин. Свободный гемоглобин плазмы быстро связывается с гаптоглобином, поэтому уровень свободного гемоглобина даже при выраженной МАГА может не повышаться, а уровень свободного гаптоглобина снижается. Если же продукция гаптоглобина печенью уменьшается, то в крови может определяться свободный гемоглобин. Этот феномен нередко встречается при HELLP-синдроме и ложно экстраполируется специалистами акушерского профиля на все формы ТМА, даже без поражения печени. Тромбоцитопению констатируют при количестве тромбоцитов менее 150 тыс. в мкл, или более чем на 25% от исходного уровня. В редких случаях возможно развитие МАГА без тромбоцитопении.
Наличие МАГА устанавливают на основании выявления у пациентов с анемией шизоцитоза (число шизоцитов в мазке периферической крови выше 0,2%) и/или повышенного уровня ЛДГ, и/или снижения гаптоглобина. При подозрении на ТМА необходимо определение хотя бы двух указанных маркеров. При любой ТМА в течение первых двух дней шизоцитов может не быть – именно столько эритроцит может висеть на нитях фибрина без деформации и «почкования». Если сохраняется ТМА-настороженность, подсчет шизоцитов стоит проводить ежедневно (рекомендации ICSH, 2011).
Клинически все ТМА проявляются абсолютно однотипно: тромбоцитопенией, развивающейся вследствие потребления тромбоцитов в процессах распространенного тромбообразования, микроангиопатической гемолитической Кумбс-негативной анемией (механический гемолиз) и поражением различных органов, главным образом почек, печени, легких и ЦНС. При появлении клинических симптомов острой ТМА во время беременности необходимо определить дальнейшую тактику ведения, которая будет зависеть от нозологического диагноза. К сожалению, нет ни одного клинического или морфологического критерия, позволяющего быстро устанавливать диагноз. В первоочередную задачу входит необходимость проведения дифференциальной диагностики между более распространенным ПЭ/HELLP-синдромом и редкими другими вариантами ТМА.
Разграничение «чистых акушерских» ТМА, т.е. тех вариантов, когда сама беременность запускает реализацию ТМА (ПЭ/HELLP-синдром), от других вариантов (ТТП, аГУС), возможно только после родоразрешения. Это связано и с тем, что пациентка с признаками ТМА во время беременности соответствует критериям тяжелой ПЭ и подлежит родоразрешению, а также с тем, что только элиминация секретируемого плацентой антиангиогенного фактора sFlt-1 купирует симптомы ПЭ. При дебюте ТМА после родов ПЭ/HELLP-синдром не должен рассматриваться.
Только уровень ADAMTS13 менее 10% позволяет устанавливать диагноз ТТП, другие клинико-лабораторные алгоритмы позволяют лишь предполагать диагноз.
Попытки ускорить нозологическую диагностику ТМА привели к появлению алгоритма Коппо: в неосложненных случаях, т.е. без продолжающихся патологических состояний, связанных с активацией комплемента, количество тромбоцитов>30 тыс./мм3 и/или креатинин выше 2,3 мг/дл указывают в большей степени на аГУС, а не на ТТП. Этот алгоритм показал свою довольно высокую специфичность и чувствительность в неакушерских ситуациях, тогда как все случаи развития ТМА в акушерстве исходно осложнены. Данный метод может быть лишь ориентиром, но не должен определять тактику в таких ситуациях.
При наличии признаков поражения желудочно-кишечного тракта (ЖКТ), особенно диареи, необходимо исключение STEC ГУС. Лабораторные исследования следует выполнять в первые сутки госпитализации больного в стационар до начала антибактериальной терапии. Для исключения STEC-ГУС показаны посев кала для выявления культуры STEC (на среду Mac Conkey для E. coli O157:H7), или определение шига-токсина в кале или ректальном мазке методом ПЦР, и/или определение шига-токсина в сыворотке крови, и/или определение в сыворотке крови антител к липополисахариду наиболее распространенного в данном регионе серотипа E. сoli O157:H7).
Диагноз аГУС всегда остается диагнозом исключения. Он должен быть подтвержден лабораторными данными, исключающими другие ТМА, прежде всего ТТП и септические вторичные ТМА.
Тщательный сбор анамнеза, в т.ч. семейного и акушерского, оценка факторов риска развития сепсиса, расспрос про использование лекарственных препаратов, физикальный осмотр, полное клинико-лабораторное обследование при дебюте ТМА позволят сэкономить драгоценное время и правильно выбрать маршрут.
Все пациенты с прогрессированием или персистенцией симптомов ТМА нуждаются в ранней (в течение 24 часов) инициацией плазмообмена (ПО), пока не будет исключена ТТП.
Хотя ASFA (Американское общество по аферезу) в качестве терапии 1-й линии (категория I) рекомендует плазмообмен (ПО) больным только ТТП (1А) и аГУС, а также больным с антителами к фактору Н (2С), при этом относя практически все остальные причины аГУС ко II классу (терапия 2-й линии, 2С), провести дифференциальную диагностику в первые дни заболевания не представляется возможным, в связи с чем может быть потеряно драгоценное время. Надо отметить, что наличие мутации MCP в ASFA указано как противопоказание к ПО (IV категория, 1С), однако стоит помнить, что эти пациенты имеют прогноз, наиболее благоприятный, чем таковые с мутацией фактора H или даже в отсутствие мутаций. И отнесение этой категории больных к классу IV объяснено тем, что ремиссия достигается примерно 90% как без ПО, так и с ПО.
В Испанских рекомендациях 2018 г. указано, что все пациенты с ТМА нуждаются в инициации ПО в течение первых 4–8 часов. До этого необходимо взять образцы крови для исследования ADAMTS13. Объяснить работу ПО в случаях аГУС можно тем, что донорская СЗП содержит функционально активные регуляторные белки системы комплемента, что устраняет дефицит собственных естественных регуляторов – факторов H и I, а также прекращает тромбообразование в сосудах микроцируляторного русла за счет введения естественных компонентов плазмы, обладающих протеолитической активностью в отношении сверхкрупных мультимеров фВ, антикоагулянтов и компонентов системы фибринолиза.
В случае септической ТМА (III класс ASFA, 2В) дополнительным преимуществом ПО является его способность восполнять дефицит ADAMTS13, который в меньшей мере, чем при ТТП, но все же характерен для этой группы больных, а также элиминация воспалительных медиаторов и продуктов генерализованного повреждения клеток.
Во всех случаях вторичной ТМА ПО используется в качестве вспомогательной терапии. Рядом исследователей доказана эффективность ПО при HELLP-синдроме (III класс ASFA, 2С при старте после родов, IV класс при старте до родов). Очевидно, такая тактика позволяет прервать в ряде случаев развитие Б-аГУС и других жизнеугрожающих ТМА, триггером которых может стать HELLP-синдром. Требуются дальнейшие многоцентровые исследования, доказывающие эффективность раннего начала применения экстракорпоральных методов гемокоррекции при HELLP-синдроме, что будет способствовать улучшению клинических исходов.
В случае подтверждения аГУС следует назначать экулизумаб – препарат группы комплемент-ингибирующих антител. Экулизумаб – рекомбинантное гуманизированное моноклональное антитело класса IgG к С5-компоненту комплемента. Экулизумаб блокирует расщепление С5 на С5а и С5b, что препятствует образованию МАК на мембране собственных ЭК. Таким образом, экулизумаб восстанавливает регуляцию активности комплемента в крови и предотвращает дальнейшее повреждение эндотелия. Дефицит терминального комплекса комплемента сопровождается повышенной частотой развития инфекций инкапсулированными микроорганизмами, главным образом менингококковой инфекции. При этом экулизумаб не действует на более ранние этапы активации комплемента, необходимые для опсонизации микроорганизмов и выведения иммунных комплексов. Применение экулизумаба приводит к обратному развитию ТМА и/или предупреждает прогрессирование поражения почек. При принятии решения о начале антикомплементарной терапии больные должны быть вакцинированы от менингококковой инфекции и в течение 2 недель после вакцинации получать соответствующую профилактическую антибиотикотерапию. Вакцинация может быть отсрочена до момента стабилизации состояния, однако в этом случае требуется обязательное профилактическое применение антибиотиков (до 2 недель после вакцинации). Все больные также должны быть ревакцинированы, согласно существующим в РФ стандартам. Взрослым пациентам с аГУС экулизумаб назначается в стандартных дозировках, в фазе индукции (начальный цикл) экулизумаб вводится в дозе 900 мг в виде внутривенной инфузии один раз в неделю в течение первых 4 недель терапии (всего 4 инфузии). На 5-й неделе терапии и далее каждые 2 недели внутривенно вводится 1200 мг препарата (5-я и последующие инфузии).
После перенесенного острого эпизода ТМА всегда есть риск рецидива, поэтому необходимо диспансерное наблюдение и полное клинико-лабораторное обследование нефрологом с обязательным исследованием генетических аномалий системы комплемента, особенно при терапии экулизумабом, для решения вопроса о длительности терапии или при планировании трансплантации.



Заключение
- Любая системная ТМА требует прежде всего дифференциальной диагностики.
- Эпидемия аГУС приводит к неправильному лечению. Атипичный ГУС – диагноз исключения.
- В спектр дифференциальной диагностики ТМА должны прежде всего входить ТТП, аГУС, КАФС, системные инфекции и злокачественные образования.
- Любая ТМА в акушерстве, в т.ч. атипичный ГУС, 0 – критическое состояние, при котором необходима незамедлительная помощь.
- Терапия первой линии любой системной ТМА (при беременности – с признаками прогрессирования после родоразрешения), в т.ч. и атипичного ГУС, – плазмообен.
- Плазмообен при аГУС может быть эффективным (I, II классы рекомендаций ASFA, кроме мутаций МСР), но не снижает риска развития терминальной почечной недостаточности.
- Назначение экулизумаба оправданно в т.ч. тем пациентам, которыми на фоне ПО достигнута гематологическая ремиссия, но сохраняется прогрессирование органной дисфункции.
- Опыт использования экулизумаба продемонстрировал превосходную эффективность, радикально улучшив прогноз в отношении восстановления почечной функции.
- После назначения экулизумаба должна сохраняться настороженность в отношении развития инфекционных осложнений.



