Во вступительном докладе председатель совета, председатель РДО А.М. Андрусёв обосновал исключительную актуальность обновления Национальных рекомендаций. Со времени выхода рекомендаций KDIGO и национальных рекомендаций опубликовано значительное количество эпидемиологических наблюдательных исследований, открытых интервенционных исследований и несколько важных многоцентровых рандомизированных контролируемых исследований, существенным образом повлиявших на представление о патогенезе МКН-ХБП, методах обследования и динамического наблюдения, а также лечения.
За те же годы лечение ХБП (как и большинства других нозологий) перешло в систему обязательного медицинского страхования, где актуальные клинические рекомендации особенно важны, поскольку служат основой формирования стандартов оказания медицинской помощи, которые в свою очередь во многом определяют полноту доступного обследования и лечения основной массы пациентов.
К работе консультативного совета были привлечены в основном авторы национальных рекомендаций, чтобы наилучшим образом обеспечить преемственность и развитие содержащихся в них положений и при необходимости добавить новые.
В ходе консультативного совета авторитетные специалисты представили углубленные обзоры по нескольким актуальным тематикам, а отдельные важные положения или целевые значения параметров выносились на панельную дискуссию.
Основываясь на данных Российского регистра пациентов на заместительной почечной терапии РДО, А.М. Андрусёв продемонстрировал широкую распространенность МКН-ХБП среди диализных пациентов, при этом выраженность вторичного гиперпаратиреоза (ВГПТ) существенно превышает таковую во многих странах мира, а частота адекватного использования стандартной, тем более инновационной, терапии очевидно недостаточна; серьезнейшей проблемой является и широкая распространенность гиперфосфатемии, в значительной части случаев связанной в т.ч. с ВГПТ.
Если исторически ренальная остеодистрофия (термин, использовавшийся в широком понимании до публикации «Изложения позиции KDIGO» [3] в 2005 г.) в основном рассматривалась как костная патология, связанная с высокой или низкой скоростью обмена в кости, то в последние годы стало ясно, что главной составляющей МКН-ХБП, во многом определяющей прогноз лечения пациента в целом, является сосудистая и клапанная кальцификация.
Методы выявления сосудистой кальцификации в свете отбора пациентов на различные варианты активной терапии обсуждены в докладе В.Ю. Ряснянского. Основные причины сосудистой кальцификации: нарушение баланса между ингибиторами и промоутерами кальцификации, а также факторы, способствующие трансдифференцировке гладкомышечных клеток в остеоциты. К факторам, характерным для общей популяции, присоединяются специфические для ХБП: повышенный уровень кальция и фосфатов, дефицит ряда ингибиторов кальцификации, а также неудачно подобранная терапия.
Известно, что по мере снижения СКФ возрастает риск кальцификации коронарных артерий – в 1,68 раза для СКФ 50–59 мл/мин и в 2,82 раза для СКФ менее 30 мл/мин [4].
У диализных пациентов связь выживаемости с тяжестью кальцификации выявляется при оценке последней различными методами (рентгенография, скорость пульсовой волны, пульсовое давление) [5]. Причем зависит выживаемость именно от скорости прогрессирования кальцификации [6]. Важно поэтому определить оптимальные методы оценки сосудистой кальцификации, в т.ч. и для выбора оптимальной терапии. Компьютерная томография остается референсным методом для оценки кальцификации коронарных сосудов и аорты, обеспечивает количественную оценку, позволяет осуществлять последовательный мониторинг прогрессирования кальцификации; дает информацию о кальцификации клапанов, а заодно – и о плотности грудного отдела позвоночника. Однако при этом нет возможности провести дифференциальную диагностику между кальцификацией интимы и медии, а стоимость исследования и лучевая нагрузка высоки; воспроизводимость зависит от метода подсчета шкалы кальцификации (Агатстона или волюметрический) и от опыта интерпретации полученных изображений. Ультразвуковая диагностика кальцификации безопасна и относительно дешева, позволяет оценивать кальцификацию поверхностных сосудов, но ее результаты значимо зависят от опыта оператора, а корреляция с кальцификацией коронарных сосудов ограниченна, как и не существует четких данных о связи ее результатов с летальностью пациентов с поздними стадиями ХБП. Еще в большей степени от опыта оператора зависит интерпретация результатов оценки кальцификации клапанов при эхокардиографическом исследовании. Результаты измерения скорости пульсовой волны зависят от жесткости сосудов, в основном отражающей степень кальцификации, но исследование это малодоступно, является операторзависимым и фактически непрямым методом оценки кальцификации.
 На этом фоне рентгеновские методы отличаются низкой ценой и лучевой дозой, высокой доступностью, хорошей корреляцией с методами оценки коронарной кальцификации по КТ, открывает возможность дифференцировать поражение интимы и медии сосуда, а высокая прогностическая значимость продемонстрирована для диализных пациентов в ряде исследований. Описано несколько методик оценки: по дуге аорты; сосудам таза, бедер и кистей рук, брюшному отделу аорты. Хотя с прогностической точки зрения выделить какой-либо рентгенографический метод сложно, поскольку прямых сопоставлений немного [7], наибольшую популярность в последние годы заслужил метод оценки кальцификации брюшной аорты по Kauppila [8]. Подробное описание метода представлено в недавней публикации результатов пилотного исследования на российской популяции диализных пациентов [9] и на сайте Российского диализного общества www.nephron.ru. Высокая воспроизводимость метода по сравнению с другими продемонстрирована в специальном исследовании [10] пациентов на преддиализных и диализной стадиях ХБП. В нашей популяции 90 % пациентов имели признаки кальцификации аорты (более 1 балла – 75 %), при этом у 13 % индекс превышал 16 (из 24 возможных), а средний балл кальцификации составил 7 ± 6 (диапазон – 1–23 балла). Именно в группе диализных пациентов с баллом 16–24 отмечен статистически значимый риск неблагоприятного исхода (ОР – 2,12; 95 % ДИ – 1,48 ÷ 3,03) в исследовании CORD [11]. В нашем наблюдении кальцификация нарастала с возрастом, при более высоком уровне ПТГ и произведения Са × Р, а также при наличии сердечно-сосудистой патологии в анамнезе.
На этом фоне рентгеновские методы отличаются низкой ценой и лучевой дозой, высокой доступностью, хорошей корреляцией с методами оценки коронарной кальцификации по КТ, открывает возможность дифференцировать поражение интимы и медии сосуда, а высокая прогностическая значимость продемонстрирована для диализных пациентов в ряде исследований. Описано несколько методик оценки: по дуге аорты; сосудам таза, бедер и кистей рук, брюшному отделу аорты. Хотя с прогностической точки зрения выделить какой-либо рентгенографический метод сложно, поскольку прямых сопоставлений немного [7], наибольшую популярность в последние годы заслужил метод оценки кальцификации брюшной аорты по Kauppila [8]. Подробное описание метода представлено в недавней публикации результатов пилотного исследования на российской популяции диализных пациентов [9] и на сайте Российского диализного общества www.nephron.ru. Высокая воспроизводимость метода по сравнению с другими продемонстрирована в специальном исследовании [10] пациентов на преддиализных и диализной стадиях ХБП. В нашей популяции 90 % пациентов имели признаки кальцификации аорты (более 1 балла – 75 %), при этом у 13 % индекс превышал 16 (из 24 возможных), а средний балл кальцификации составил 7 ± 6 (диапазон – 1–23 балла). Именно в группе диализных пациентов с баллом 16–24 отмечен статистически значимый риск неблагоприятного исхода (ОР – 2,12; 95 % ДИ – 1,48 ÷ 3,03) в исследовании CORD [11]. В нашем наблюдении кальцификация нарастала с возрастом, при более высоком уровне ПТГ и произведения Са × Р, а также при наличии сердечно-сосудистой патологии в анамнезе.
«Золотым» стандартом определения функционального состояния костной ткани остается биопсия трабекулярной кости. Это инвазивный болезненный метод, требующий особой технологии обработки недекальцинированных срезов биоптата. Тем ценнее немногочисленные исследования среди диализной популяции с морфологической диагностикой, позволяющей надежно разделить низкообменную остеодистрофию (как правило, адинамическую болезнь кости, характерную для неадекватно низких уровней паратгормона) и высокообменную остеодистрофию (фиброзный остеит – проявление выраженного гиперпаратиреоза) от умеренных нарушений скоростей резорбции/остеогенеза или смешанного поражения – картины, характерной для адекватных уровней ПТГ (150–300 пг/мл).
Анализ новейших исследований в этой области провела профессор Л.Я. Рожинская.
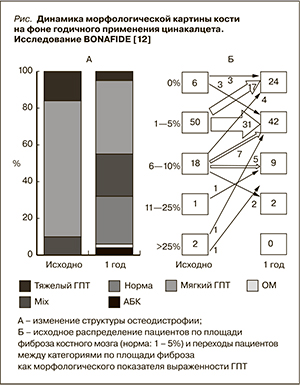
В открытом исследовании BONAFIDE [12] оценено влияние терапии цинакалцетом на костную морфологию и динамику параметров остеогенеза в одной группе пациентов. Первичной конечной точкой было изменение объемной скорости остеогенеза в результате годичной терапии (снизилась на 488 ± 77 мкм2/мм2/день примерно в 2 раза), а вторичными были изменения долей остеобластной (-4,3 ± 1,4 %) и остеокластной (-2,7 ± 1,5 %) поверхностей остеоида, доли поверхности резорбции (-3,4 ± 0,6 %), а также динамика костной фракции щелочной фосфатазы (ЩФ) (-6,6 ± 12,7 %) и других биохимических маркеров костного метаболизма. Снижение ПТГ от исходного уровня 1364 ± 85 пг/мл составило 41,6 ± 4,4 %, кальциемии – 6,5 ± 1,1 %, фосфатемии – 1,1 ± 2,9 %. Доза цинакалцета титровалась от 30 мг/сут по уровням ПТГ и кальция. Разрешен прием аналогов витамина D (у 54 %) и фосфатсвязывающих препаратов (у 84 %). Интересны изменения характера костной патологии на фоне годичной терапии цинакалцетом и динамика доли, занятой в срезе костной ткани фиброзом (представлены на рисунке).
Важным результатом исследования было то, что сочетание уровня ПТГ выше 300 пг/мл и костной фракции ЩФ выше 21 нг/мл исключало адинамическую болезнь кости. В то же время 17 % пациентов имели нормальную скорость остеогенеза, несмотря на повышенные значения ПТГ и ЩФ; по-прежнему мы не можем по биохимическим маркерам точно установить костную морфологию. Стоит также отметить, что у 3 (4 %) пациентов в ходе терапии развилась низкообменная остеодистрофия, что служит дополнительным предостережением от бесконтрольного применения препарата.
Особенности динамики МКН-ХБП после трансплантации почки осветила в своем докладе профессор Н.А. Томилина. Популяция пациентов с РАТ хоть и растет медленно, но достигла уровня 360 человек на 1 млн населения в Европе; пятилетняя выживаемость достигла 90 %, и на важное место выдвинулись долгосрочные осложнения, среди которых – сердечно-сосудистая патология, заболевания скелетно-мышечного аппарата, гиперпаратиреоз, снижение минеральной плотности кости, остеопороз, переломы костей. Вторичный ГПТ – частое осложнение у больных на диализе, и, несмотря на функционирующий РАТ, вторичный ГПТ часто персистирует после АТП [13]. Типичным сценарием является следующий: уровень ПТГ значимо снижается в первые три месяца, а затем стабилизируется на повышенных уровнях (иногда – весьма высоких). Уровень кальция повышается и стабилизируется вблизи верхней границы нормы и выше в течение двух месяцев. Фосфаты быстро снижаются до нормальных величин и ниже, но гипофосфатемия (если развивается) разрешается в течение двух месяцев. Исходно низкий уровень 1,25 (OH)2D, как правило, не достигает нормальных величин – по меньшей мере в течение полутора-двух лет [14]. Минеральная плотность костной ткани прогрессивно снижается после АТП у большинства пациентов, хотя это снижение и демонстрирует различные модели, а анализ относительного вклада влияния иммуносупрессии и уровня паратгормона требуется продолжить [15]. Обсуждается также эффективность бисфосфонатов в предотвращении потери минеральной плотности и сосудистой кальцификации у пациентов с РАТ [16].
Детальное рассмотрение возможной эволюции ВГПТ после удачной АТП выявляет три варианта развития событий:
- ВГПТ (по-видимому, исходно умеренный) в условиях достаточной функции почки разрешается, ПТГ и кальциемия постепенно приходят в норму, оснований для антигиперпаратиреоидной терапии (в частности, цинакалцетом) нет [13, 17].
- ВГПТ персистирует в результате дисфункции РАТ и примерно эквивалентен ВГПТ при ХБП 3–4-й стадий; уровень ПТГ достаточно высокий, но кальциемия остается в пределах нормы. Терапия цинакалцетом приводит к снижению ПТГ, но может способствовать гипокальциемии, тем не менее существует положительный опыт [18]: снижение ПТГ от 200–500 пг/мл на 47 % к шестому месяцу и на 60 % – через год у 32 пациентов с исходной нормокальциемией без значимой динамики уровней кальция и фосфатов.
- ВГПТ персистирует в результате разной степени автономности диффузно-узловой/узловой гиперплазии независимо от функционирования РАТ; ПТГ остается высоким, развивается гиперкальциемия; параллельно развивается гипофосфатемия. Несмотря на то что можно рассчитывать лишь на умеренный антигиперпаратиреоидный эффект терапии цинакалцетом, ее ценность состоит в коррекции гиперкальциемии, что подтверждено в т.ч. и в долгосрочных наблюдениях [19].
Гиперкальциемия после АТП может иметь несколько причин для своего развития: увеличенная реабсорбция кальция в трансплантате в результате действия ПТГ; увеличение всасывания кальция в кишечнике в результате роста уровня 1,25-дигидрокси-витамина D, происходящего в результате уменьшения уровней FGF-23, подавляющего синтез D, и появления новой «площадки» для синтеза – почечной ткани трансплантата. Но основной причиной гиперкальциемии после АТП остается, вероятно, повышенная резорбция кости в результате персистирующего ГПТ, чему способствует, помимо прочего, несохранение антигиперпаратиреоидной терапии после операции: действительно, выраженность гиперкальциемии была прямо связана с уровнем ПТГ перед АТП (хотя это часто маскируется хорошо подобранной терапией) в период до широкого использования цинакалцета, а в работах последних лет – с дозой назначенного цинакалцета до АТП (фактически как маркера тяжести ГПТ) [17, 20].
Последствиями персистирующей гиперкальциемии может стать снижение функции трансплантата в результате:
- вазоконстрикции [21];
- нефрокальциноза (частота выявления возрастает в 3 раза в биоптатах, полученных через 6 месяцев по сравнению с таковыми через 6 недель, а среди пациентов с нефрокальцинозом ухудшение функции РАТ прямо связано с уровнем ПТГ [22]);
- нефролитиаза.
Важнейшим системным эффектом гиперкальциемии является ускорение прогрессирования сосудистой кальцификации. Дополнительными осложнениями могут стать панкреатиты, спровоцированные гиперкальциемией/ГПТ, и последствия эктопической кальцификации мягких тканей.
Существует несколько подходов к коррекции гиперкальциемии после АТП. В случае умеренной бессимптомной гиперкальциемии оправданной может быть выжидательная тактика при регулярном наблюдении. Однако если кальциемия превышает 2,7 ммоль/л и продолжается более года или становится симптоматичной, следует перейти к активной тактике.
Традиционно альтернативой выжидательной тактике была только паратиреоидэктомия (ПТЭ), которую рекомендовали выполнять в субтотальном варианте, чтобы избежать рисков адинамической болезни кости (особенно на фоне терапии стероидами). Даже после появления кальцимиметиков некоторые авторы отдавали ей предпочтение, ссылаясь на экономические аргументы и обозначая ПТЭ как «перманентное» (окончательное) решение [23] в отличие от применения цинакалцета, требующего непрерывного лечения. Такое представление является упрощенным, поскольку, с одной стороны, ПТЭ не исключает персистенцию или возврат ГПТ, с другой – длительная терапия цинакалцетом в части случаев может приводить к регрессу гиперплазии паращитовидной железы [27, 28]. ПТЭ не лишена осложнений и технических проблем: синдром «голодной кости» с тяжелой гипокальциемией, которую часто трудно контролировать, хирургические осложнения (повреждение возвратного нерва), атипичное расположение желез (в т.ч. ретростернальные и другие технически сложные варианты расположения). Остается открытым обсуждение рисков ухудшения функции трансплантата после ПТЭ [24], хотя данные за такие риски не всегда убедительны [25].
В конце 2012 г. опубликованы обзор и мета-анализ работ по результатам применения цинакалцета после АТП [26], в который было включено 21 исследование с 411 пациентами длительностью от 3 до 24 месяцев. По данным мета-анализа, кальциемия снизилась на 0,29 ммоль/л (95 % ДИ – -0,25 ÷ -0,32), уровень фосфатов возрос на 0,15 ммоль/л (95 % ДИ – 0,28 ÷ 0,64), ПТГ снизился на 102 пг/мл (95 % ДИ – -69 ÷ -134), а уровень креатинина не изменился. Терапия цинакалцетом привела 7 (2 %) пациентов к гипокальциемии, а наиболее частыми побочными эффектами стали желудочно-кишечные. В обзоре подчеркивалось, что для подтверждения результатов открытых небольших исследований требуется рандомизированное контролируемое испытание.
Результаты такого исследования были первично представлены на конференции Американского общества нефрологов в ноябре 2013 г. [27]. «Рандомизированное клиническое исследование для оценки эффективности использования цинакалцета с целью коррекции гиперкальциемии у пациентов после трансплантации почки, страдающих автономным гиперпаратиреозом», помимо заявленной в названии цели ставило также задачу оценить эффект цинакалцета на лабораторные показатели, ассоциированные с гиперпаратиреозом, и эффект цинакалцета на минеральную плотность костной ткани (МПК) шейки бедра. По 57 пациентов с гиперкальциемией выше 2,63 ммоль/л были включены в группы цинакалцета и контроля при стратификации кальциемии ниже (n = 45) и выше (n = 69) уровня 2,8 ммоль/л. Первичной конечной точкой исследования были достижения уровня кальциемии ниже 2,55 ммоль/л, вторичными – динамика МПК и биохимических маркеров МНК-ХБП. Пациентов в возрасте 52 ± 10 лет, получавших лечение диализом в течение 62 ± 40 месяцев, в исследование включили через 7 ± 5 месяцев с момента АТП. Исходная кальциемия составила 2,98 ± 0,01 ммоль/л, ПТГ – 317 ± 21 пг/мл, а уровень фосфатов – 0,83 ± 0,02 ммоль/л при расчетной СКФ 56 ± 1,5 мл/мин/1,73 м2. Доли пациентов, достигших основной конечной точки, составили 78,9 % и 3,5 % в группах цинакалцета и плацебо (p < 0,001). Основная вторичная конечная точка – динамика минеральной плотности кости – не была достигнута. Уровень фосфатов увеличился на 0,17 ± 0,2 по сравнению с неизменным уровнем в группе плацебо (p < 0,001), уровень ПТГ снизился на 128 ± 34 пг/мл, кальция – на 0,38 ± 0,25 ммоль/л. Динамика рСКФ в группах не отличалась от 0. Профиль нежелательных эффектов цинакалцета на пациентов, перенесших трансплантацию почки, был аналогичен описанному в предшествующих исследованиях. Наиболее часто отмечавшимся нежелательным явлением являлась диарея. Таким образом, цинакалцет в годичном исследовании продемонстрировал эффективность в разрешении наиболее тревожного проявления гиперпаратиреоза при АТП – гиперкальциемии (при умеренном исходном повышении ПТГ – 317 ± 21 пг/мл, который снизился на 40 % в ходе исследования). По первичному представлению результатов исследования пока трудно оценить меру автономности ПЩЖ в исследованной группе, которая судя по исходному уровню и динамике ПТГ, была относительно невелика.*
Локальный опыт выбора терапии МКН-ХБП представил профессор Е.В. Шутов. В относительно недавнем обзоре и мета-анализе [28] 47 исследований с более чем 300 тыс. пациентов представлено сравнение значимости отклонений параметров МКН-ХБП. По значимости гиперфосфатемия выходила на первое место, будучи связана с большей на 18 % летальностью с ростом уровня фосфатов на каждые 0,33 ммоль/л.
На этом фоне менее значимыми выглядят риски повышения уровней ПТГ (рост риска смерти на 1 % на каждые 100 пг/мл) и кальциемии (рост на 8 % на каждые – 0,25 ммоль/л). Ограничением ценности мета-анализа является, безусловно, тот факт, что анализ рисков не учитывает известный J-эффект зависимости летальности от уровней фосфатов, кальция и ПТГ. В анализе такого влияния на отечественной популяции пациентов [29] при разделении пациентов по тертилям величин фосфатемии пациенты со средним тертилем фосфатемии (1,59–1,95 ммоль/л) характеризовались увеличением риска смерти на 57 %, группа с наибольшей фосфатемией – более чем в 8 раз по сравнению с группой пациентов с наименьшим уровнем фосфатов. Кальциемия не вошла в модели в качестве значимой переменной. При включении уровня паратгормона в качестве категориальной величины (по KDIGO) подгруппы выше и ниже целевого диапазона характеризовались увеличением рисков на 29 и 69 % соответственно. При разделении пациентов на категории с паратгормоном по KDOQI от пациентов целевого диапазона по рискам летальности отличалась только подгруппа с ПТГ < 150 пг/мл, но не подгруппа с ПТГ > 300 пг/мл. Среди традиционных параметров МКН-ХБП как факторов риска летальности пациентов с ХБП твердое место занял фактор роста фибробластов (FGF)-23 – независимо от уровня ПТГ, фосфатов, применения витамина D и т.д. [30]. Повышение FGF-23 связано также с ускоренным прогрессированием сосудистой кальцификации, гипертрофии левого желудочка, нарушением липидного обмена. В небольшом сравнительном исследовании [31] российской популяции пациентов анализировали эффект терапии альфакальцидолом, парикальцитолом в сочетании с цинакалцетом или без него. Использование только альфакальцидола или парикальцитола ассоциируется с повышением фосфатов и кальциемии. Кроме того, альфакальцидол приводил к достоверному повышению FGF-23. Цинакалцет снижал достоверно уровень FGF-23 даже при использовании в комбинации с альфакальцидолом либо с парикальцитолом. Влияние терапии на уровень фосфатов зависело от дозы витамина D (при малых дозах фосфатемия снижалась). Наибольшее снижение уровня ПТГ достигается при применении сочетания цинакалцета и парикальцитола (-62,4 %). В заключительной части своего доклада Е.В. Шутов подчеркнул значимость решения вопросов коррекции гиперпаратиреоза с учетом расширяющегося набора маркеров МКН-ХБП, никогда не оставляя без внимания задачи коррекции фосфатемии, тем более что проблема выбора и тактики использования фосфат-связывающих препаратов далека от разрешения [32].
В подводящем итог обсуждении модератор заседания экспертного совета В.Ю. Шило еще раз высветил ключевые новые исследования, данные по которым должны быть учтены при разработке обновления Национальных рекомендаций по МКН-ХБП, начав с изложения новых идей, которые еще только ожидают веского подтверждения в специально спланированных исследованиях, сам дизайн которых, как и процесс воплощения их результатов в практические клинические рекомендации, уже начал претерпевать принципиальные изменения [33].
На наших глазах меняется парадигма подхода к происхождению и прогрессированию МКН-ХБП с самых ранних стадий ХБП. От представления о том, что высокая фосфатемия в сочетании с гиперпаратиреозом приводит к сосудистой кальцификации и прогрессированию сердечно-сосудистой патологии (что концентрирует внимание только на понижении фосфатов у пациентов с терминальной ХПН, составляющих менее процента от популяции ХБП), мы постепенно переходим к осознанию повреждающего действия высокого уровня фосфатов на почечные канальцы, индуцирующего фиброз. Новой целью может стать понижение уровня FGF-23, и задача эта коснется уже трети пациентов с ХБП – начиная с ХБП-2, -3 [34]. А именно терапия цинакалцетом способна понижать уровень FGF-23, что продемонстрировано в сравнительных исследованиях ACHIEVE (в сочетании с низкими дозами D – на 10 %), PARADIGM (на 40 %), EVOLVE (в сочетании с низкими дозами D – на 25 %) в противоположность альтернативным ветвям исследований, где отмечен только рост FGF-23 (на 4 ÷ 47 %).
Интересно крупное наблюдательное исследование MBD 5D, проведенное в Японии [35], продемонстрировавшее увеличение доли пациентов, достигших при терапии цинакалцетом целевых значений ПТГ на 23 % по сравнению с результатом увеличения дозы активаторов рецепторов витамина D – VDRA (на 12 %); впрочем, сочетание двух стратегий привело к увеличению доли еще выше – на 33 %.
Представляет интерес и параллельное сопоставление результатов анализа фрагмента крупного наблюдательного исследования ARO (532 инцидентных пациента, получавших цинакалцет, с сопоставленной группой из 1790 пациентов) и результатов рандомизированного исследования EVOLVE. Хотя исследование EVOLVE не достигло первичной конечной точки, однако анализ «по протоколу» выявил схожие тенденции с результатами наблюдательного исследования ARO, как и анализ с ограничением времени наблюдения после фактического прекращения терапии (Lag censoring analysis), который оказался доказательным в EVOLVE. Сопоставление показывает, что хорошо спланированные наблюдательные исследования (которые проще организовать и провести, чем крупные рандомизированные испытания) могут сослужить хорошую службу в поиске рациональных стратегий коррекции сложных многофакторных нарушений. В последующем контролируемые исследования способны будут подтвердить разработки.
В исследовании ADVANCE получена устойчивая тенденция к замедлению сердечно-сосудистой кальцификации (хотя статистической значимости изменения достигли только при оценке кальцификации аортального клапана или при изменении способа оценки кальцификации коронарных артерий – применения шкалы объемного счета вместо предварительно запланированной шкалы Агатстона). Но именно пациенты с более выраженной клапанной кальцификацией продемонстрировали в post-hoc-анализе замедление сосудистой кальцификации. Эффект был выражен больше в подгруппе с более тяжелой кальцификацией сосудов [36]. Результат этого реанализа данных – одно из возможных оснований для отбора пациентов, которые получат максимальную пользу от терапии цинакалцетом. Такой отбор необходим, по меньшей мере в случаях ограниченного доступа к возможности обеспечить пациента терапией. Представленные модератором экономические аспекты оценки терапии как имеющей приемлемый (для общества) коэффициент цена/эффективность дополнительно подтверждают неизбежность такого отбора. Например, при оценке отношения цена/эффективность для терапии карбонатом лантана японские исследователи сочли его неприемлемо высоким, а терапию цинакалцетом – имеющей приемлемое отношение только при невозможности проведения паратиреоидэктомии [37]. В анализе соотношения цена/эффективность важнейшее значение имеет выбор первичной (и вторичных) конечной точки, их различие часто приводит к противоположным оценкам, например, при анализе результатов исследований IMPACT [38] и OPTIMA [39].
В ходе обсуждения участники консультативного совета представляли и другие аргументы для выбора пациентов на терапию цинакалцетом.
В исследовании N. Fujii et al. [40], представленном на XLVIII конгрессе ERA-EDTA (но пока не в полной публикации), сопоставление общей когорты из 6137 гемодиализных пациентов, получавших цинакалцет в течение как минимум 1 года, с подобранной контрольной группой из 12 274 пациентов не позволило продемонстрировать снижение риска переломов (ОР – 0,81; 95 % ДИ – 0,61 ÷ 1,07; р = 0,14), но в группе пациентов с гиперфосфатемией выше 1,9 ммоль/л терапия цинакалцетом была связана со снижением риска переломов (ОР – 0,5; 1 95 % ДИ – 0,29 ÷ 0,90) в отличие от группы без гиперфосфатемии. Терапия цинакалцетом также снижала риски переломов в группе с уровнем ПТГ выше 180 пг/мл, но не в альтернативной группе. Национальные рекомендации японского общества по ЗПТ определяют целевым диапазоном ПТГ 60–180 пг/мл для японской популяции диализных пациентов.
Терапия цинакалцетом способна приводить к регрессу узлов паращитовидной железы [41], но эффект этот выражен лишь в небольших узлах – до 500 мм3, для которых продемонстрировано уменьшение васкуляризации, кровотока и размеров по данным УЗ-исследования. Большие узлы с высокой вероятностью являются автономными, и большинство из них почти не реагирует на фармакотерапию. Это дополнительно подчеркивает необходимость раннего начала терапии. В то же время в работе Komaba H. снижение объема желез на фоне терапии цинакалцетом происходило при объеме желез как меньше, так и больше 500 мм3, хорошо коррелируя со снижением уровня паратгормона [42]. Возможно, различия в результатах обусловлены разными целевыми уровнями ПТГ в представленных работах. Во второй (из Японии) – целевым уровнем ПТГ являлся 180 пг/мл, что, возможно, приводило к более раннему началу терапии.
Еще одним предиктором эффективности терапии цинакалцетом может стать число увеличенных желез, также, возможно, оставаясь отражением узловой трансформации исходной гиперплазии. В небольшой группе из 58 пациентов наличие двух и более желез было связано с ОР плохого ответа на терапию цинакалцетом в 5,68; 95 % ДИ – 1,19 ÷ 32,66; р < 0,04 [43].
Предиктором ответа на терапию цинакалцетом может стать быстрота первичного ответа. В небольшом исследовании (57 пациентов) снижение ПТГ на 50 % в течение месяца титрования дозы (от 25 мг до 100 мг максимально) резко увеличивало шанс на достижение целевых диапазонов МКН-ХБП (ОР – 21,5; 95 % ДИ – 2,9 ÷ 157,7) при сочетанной терапии витамином D и ФСП. Интересно, что в группе не ответивших на терапию (18 %) в половине случаев это было связано с достижением максимальной дозы, а в половине случаев – с остановкой увеличения дозы из-за гипокальциемии [44].
Возможно, опыт реальной клинической практики – один из аргументов, которым мы должны не руководствоваться, но учитывать. DOPPS Practice Monitor (http://www.dopps.org/DPM) – один из инструментов ознакомления с этой практикой (в оперативном режиме доступны только данные по США – на момент подготовки настоящей публикации по декабрь 2013 г.).
Например, соотношение пациентов с уровнями ПТГ < 150/150–300/300–600/ > 600 пг/мл в конце 2013 г. составило 14 %/27 %/40 %/19 %; цинакалцет использовался 24 % пациентов – и в 90 % случаев вместе с аналогами витамина D (Россия в 2013 г. тоже вошла в проект DOPPS, и первый стендовый доклад о состоянии ЗПТ в России, по данным DOPPS, представлен на 51-м конгрессе ERA-EDTA). Таким образом, общая тенденция в мире – расширение целевого диапазона ПТГ от 150–300 до 150–600 пг/мл вероятно, и для нас он должен стать таким. Крупные диализные сети этому следуют тверже, отдельные центры и мелкие сети – менее систематически, но движение – общее. Ценой, правда, становится выход существенной части пациентов за целевой диапазон (выше 600 пг/мл). Следовательно, в национальных рекомендациях и протоколах ведения пациентов следует больше уделить внимания «отсечке» значений выше целевого диапазона.
Одним из инструментов достижения целей терапии МКН-ХБП (как и других целей лечения) должны стать стандарты ведения пациентов на диализе. Тщательно отработанный набор проектов таких стандартов находится на рассмотрении МЗ РФ, а частично – вывешен на сайте МЗ РФ. Основу составляют два стандарта амбулаторного ведения пациентов – на гемодиализе и на перитонеальном диализе, которые охватывают месячный период и с необходимой кратностью включают лабораторное и инструментальное обследования (в частности, по МКН-ХБП, в т.ч. и доступные методы оценки кальцификации, минерализации костной ткани, а также методы поиска узлов в паращитовидных железах). Включена в стандарт и терапия, которой (в избранной форме оказания специализированной медицинской помощи – в условиях дневного стационара) диализные отделения/центры будут иметь возможность обеспечивать пациента. Разработанная МЗ РФ технология формирования стандарта объединяет в одну группу АТХ-препараты, из-за которых могли бы начаться споры (цинакалцет и парикальцитол – АТХ H05BX; севеламер, лантан и осварен – АТХ V03AE и т.д.) Так что выбор за лечащими врачами.
Нам предстоит теперь дождаться утверждения этих стандартов и начать добиваться формирования тарифов на оказание помощи нашим пациентам. К сожалению, тарифы должны быть образованы в каждом субъекте федерации, но стандарты утверждаются приказами МЗ РФ, поэтому шансы на достижение результатов у нас есть!



