Введение
По данным ВОЗ, заболеваемость раком предстательной железы (РПЖ) неуклонно растет во всем мире. Россия не исключение – в структуре онкологической заболеваемости РПЖ занимает 3-е место после рака легких и желудка. Прирост заболеваемости за последние 10 лет составил 152,3 %. Около 3 % мужчин имеют шанс умереть от РПЖ.
«Золотым» стандартом лечения локализованного РПЖ служит радикальная простатэктомия (РПЭ) [1]. В 75–79 % случаев пациентам с выявленной локализованной формой РПЖ выполняется лечение в объеме РПЭ. По данным мировой медицинской литературы, специфическая пятилетняя выживаемость после РПЭ по поводу РПЖ достигает 95 % [1, 2, 4, 5, 7]. Безрецидивная пятилетняя выживаемость этих пациентов варьируется в пределах 75–95 % [1–4, 6, 7], но при местнораспространенных формах РПЖ снижается вплоть до 40 %. Обзор публикаций в настоящее время указывает на развитие местного рецидива не менее чем в 15 % случаев лечения локализованного РПЖ независимо от выбранного метода лечения [6]. Росту количества рецидивов помимо прочих факторов также способствует более активная хирургическая тактика при местнораспространенном РПЖ стадии T3a.
К сожалению, до сих пор не существует единых критериев диагностики и выбора тактики лечения локального рецидива РПЖ после РПЭ. Методом лечения с доказанной эффективностью, но неидеальным профилем сохранения качества жизни является дистанционная лучевая терапия. Инновационными, перспективными, но остающимися экспериментальными для этой группы больных методами считаются лечение высокоинтенсивным фокусированным ультразвуком (ВИФУ) и криодеструкция [13–15].
 В ряде европейских стран (Франция, Германия) лечение ВИФУ является «методом выбора» пациентов с местным рецидивом после РПЭ. В ряде наиболее крупных европейских исследований [8–13] общее число пациентов составило более 70, средний уровень простатспецифического антигена (ПСА) – 2,87 нг/мл до сеанса ВИФУ, надир ПСА в среднем – 0,21 нг/мл, безрецидивная выживаемость – до 55 %, 84 % контрольных биопсий имели отрицательный результат, минимальный период наблюдения – 7 месяцев, средний – 23. С учетом ограниченности выбора метода лечения такие результаты обнадеживают и позволяют надеяться на улучшение результатов лечения этих пациентов.
В ряде европейских стран (Франция, Германия) лечение ВИФУ является «методом выбора» пациентов с местным рецидивом после РПЭ. В ряде наиболее крупных европейских исследований [8–13] общее число пациентов составило более 70, средний уровень простатспецифического антигена (ПСА) – 2,87 нг/мл до сеанса ВИФУ, надир ПСА в среднем – 0,21 нг/мл, безрецидивная выживаемость – до 55 %, 84 % контрольных биопсий имели отрицательный результат, минимальный период наблюдения – 7 месяцев, средний – 23. С учетом ограниченности выбора метода лечения такие результаты обнадеживают и позволяют надеяться на улучшение результатов лечения этих пациентов.
Материал и методы
В России лечение больных РПЖ ВИФУ проводится с 2003 г.
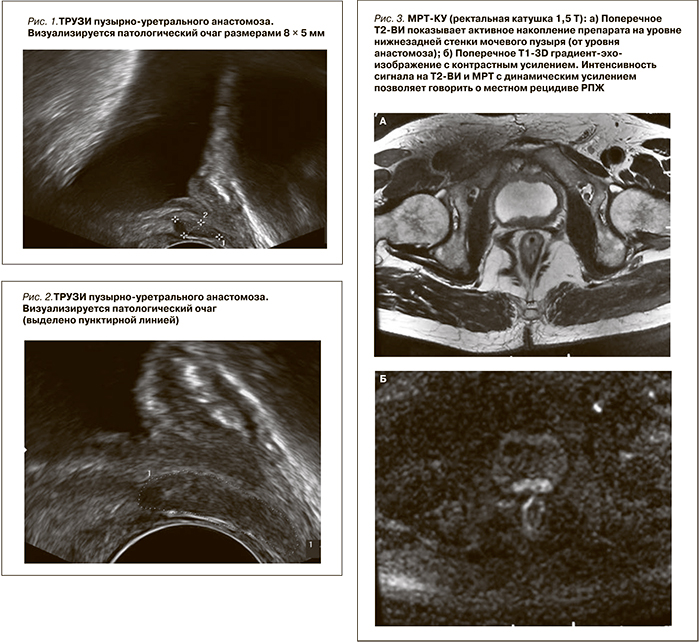
Одним из первых учреждений здравоохранения, где выполняется лечение этим методом, является клиника урологии Первого МГМУ им. И.М.Сеченова. Накопленный опыт позволил применить данную методику к пациентам с локальным рецидивом РПЖ после РПЭ. До выполнения сальважной абляции ВИФУ всем больным было проведено стандартное комплексное обследование: определение уровня ПСА, пальцевое ректальное (ПРИ), ультразвуковое исследования (УЗИ), трансректальное УЗИ (ТРУЗИ), урофолоуметрия. Наряду с обычными обследованиями (ПСА, ПРИ, УЗИ, ТРУЗИ) пациентам выполнялась магнитно-резонансная томография с контрастным усилением (МРТ-КУ; ректальная катушка, напряженность поля 1,5 Т), остеосцинтиграфия и небольшой группе пациентов (28 %) – гистосканирование. Результаты МРТ-КУ (рис. 1–3) оценивались на Т1–Т2 взвешиваниях.
Преимущественно местный рецидив имел место в группах высокого и умеренного онкологического риска. Наиболее часто местный рецидив диагностировался в области пузырно-уретрального анастомоза (66 %), семенных пузырьков (26 %), подвздошных лимфатических узлов (8 %). Рецидив заболевания во всех случаях был доказан морфологически. Для этого пациентам проводилась пункционная биопсия в зависимости от зоны накопления контрастного препарата. После операции проводился мониторинг уровня ПСА и динамики ультразвуковой картины через месяц и далее каждые 3 месяца.
Говоря о принципах воздействия ВИФУ, следует отметить эффект локальной гипертермии без повреждения окружающих тканей. Именно это позволило применить ВИФУ при местном рецидиве РПЖ после РПЭ.
В комплектацию аппарата для ВИФУ входят:
- лечебный модуль – операционный стол с электронными блоками внутри корпуса и приспособлениями для контроля за неподвижностью пациента;
- управляющий модуль – компьютерная консоль и программное обеспечение;
- эндоректальный зонд – совмещенный ультразвуковой сканер с частотой 7,5 МГц, позволяющий получать изображение в продольной и поперечной плоскостях, и генератор фокусированного ультразвука (3 МГц, фокусное расстояние – 40 мм);
- одноразовые расходные материалы – реагенты к охлаждающей системе для защиты стенки прямой кишки и др.
Этот аппарат позволяет осуществлять всю процедуру лечения без смены зондов, имеет автоматизированную систему контроля в реальном времени за положением пациента и стенкой его прямой кишки, что максимально снижает риск ее повреждения и развития осложнений.

Противопоказания к лечению ВИФУ: утолщенная стенка прямой кишки (> 7 мм при ТРУЗИ); предшествующие или имеющиеся ректоуретральные фистулы; раковая инфильтрация стенки прямой кишки; металлические клипсы в зоне анастомоза или другие гиперэхогенные включения между прямой кишкой и зоной лечения, препятствующие прохождению ультразвуковых волн; ампула прямой кишки < 50 см3; отсутствие прямой кишки. Сеанс ВИФУ проводился под спинальной анестезией, больной укладывался на правый бок.
Всем больным перед сеансом ВИФУ устанавливался по уретре катетер в мочевой пузырь не только для дренирования, но и для лучшей ориентировки во время планирования лечения при ультразвуковом наведении (рис. 4–6).
На рис. 4 видно, что благодаря наличию уретрального катетера мы можем более четко дифференцировать окружающие ткани, позволяя более детально формировать ход лечения ВИФУ.
 Алгоритм абляции ВИФУ зоны уретровезикального анастомоза принципиально не отличается от такового при первичном лечении, поэтому подробно останавливаться на этом мы не будем. Однако следует отметить, что время лечения зависит от объема ткани и, как правило, сеанс выполняется 1–2 блоками за 15–40 минут. Пациенты в среднем проводят в операционной час, что значительно отличается от первичного сеанса ВИФУ, когда лишь время лечения составляет 2–3 часа. После планирования лечения уретральный катетер удаляется и лечение парауретральной зоны проходит бе знего. Уретральное дренирование возобновлялось после лечения.
Алгоритм абляции ВИФУ зоны уретровезикального анастомоза принципиально не отличается от такового при первичном лечении, поэтому подробно останавливаться на этом мы не будем. Однако следует отметить, что время лечения зависит от объема ткани и, как правило, сеанс выполняется 1–2 блоками за 15–40 минут. Пациенты в среднем проводят в операционной час, что значительно отличается от первичного сеанса ВИФУ, когда лишь время лечения составляет 2–3 часа. После планирования лечения уретральный катетер удаляется и лечение парауретральной зоны проходит бе знего. Уретральное дренирование возобновлялось после лечения.
В послеоперационном периоде больным проводилась антибактериальная и противовоспалительная терапия. Уретральный катетер удалялся на 5–7-е сутки.
Новаторство нашего исследования заключалось не только в лечении локального рецидива РПЖ, но и в применении инновационных методов для визуализации патологического процесса, в частности гистосканирования (HistoScanning). Данная методика позволяет проводить структурный математический анализ ультразвуковой картины области анастомоза, выявляя подозрительные на неопластический процесс изменения.

В клинике урологии Первого МГМУ им. И.М. Сеченова данный метод диагностики РПЖ широко применяется в клинической практике с 2011 г. Технология HistoScanning разработана на основе сравнения результатов гистологического исследования и акустических характеристик опухолевой ткани простаты у 40 тыс. пациентов. Изменения, обнаруженные с помощью HistoScanning, неразличимы при традиционном УЗИ в серой шкале и в допплеровском режиме.
Метод гистосканирования позволяет врачам клиники урологии Первого МГМУ им. И.М. Сеченова точнее и результативнее выполнять биопсии зоны уретровезикального анастомоза у пациентов с подозрением на местный рецидив РПЖ. Также вышеописанный метод позволяет сокращать число биоптатов.

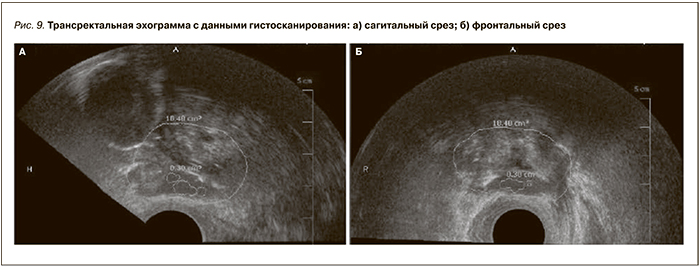
На рис. 7, 8 представлены гистокарты, или гистосканограммы, полученные в результате гистосканирования зоны уретровезикального анастомоза. Отличием от гистосканирования ПЖ является произвольный выбор зоны интереса для структурного анализа, ориентиром – шейка мочевого пузыря. В отсутствие визуализируемых при ТРУЗИ изменений в зоне анастомоза мы выбирали для анализа зону, по форме близкую к эллипсоиду с осью длиной 3 см вдоль уретры и короткими осями по 2 см перпендикулярно к ней. При наличии визуализируемого участка, подозрительного на рецидив, зона сканирования могла быть ограничена лишь им. Так мы поступали при его размере более 1 см в любом из измерений.
 С учетом вышесказанного при выполнении биопсии для повышения ее точности мы ориентировались на картину ТРУЗИ с экстраполированными результатами гистосканирования (рис. 9 а, б). При ведении медицинской документации и статистического анализа достаточно было гистокарты. Впоследствии мы оценили степень совпадения результатов гистосканирования и гистологического исследования биоптатов.
С учетом вышесказанного при выполнении биопсии для повышения ее точности мы ориентировались на картину ТРУЗИ с экстраполированными результатами гистосканирования (рис. 9 а, б). При ведении медицинской документации и статистического анализа достаточно было гистокарты. Впоследствии мы оценили степень совпадения результатов гистосканирования и гистологического исследования биоптатов.
Для лучшего понимания топографии везикоуретрального анастомоза перед биопсией мочевой пузырь дренировался уретральным катетером, как правило, не более суток. На рис. 10 микроскопическая картина аденокарциномы простаты, рецидив после РПЭ, полученной при выполнении биопсии (рис. 11).
Результаты исследования
В клинике урологии Первого МГМУ им И.М.Сеченова с октября 2004 по февраль 2014 г. 54 пациентам произведено лечение локального рецидива после РПЭ ВИФУ. Объем ПЖ до РПЭ составил от 21 до 106 см3. Средний возраст пациентов – 63 года, минимальный – 46 лет, максимальный – 68. Уровень ПСА перед сеансом ВИФУ варьировался от 0,4 до 18,0 нг/мл. Надир ПСА составил ≤ 0,1 нг/мл к 3 месяцам наблюдения. Такие показатели преобладали у пациентов группы низкого онкологического риска. Более подробный анализ динамики ПСА в зависимости от онкологического риска представлен ниже – в табл. 2.
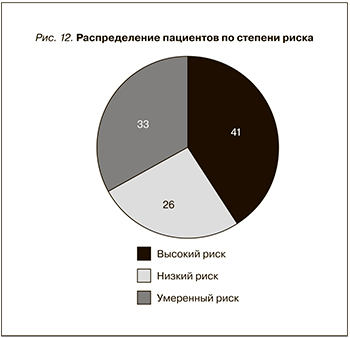
Для 34 пациентов локальный рецидив РПЖ был доказан морфологически контрольной биопсией, остальным 20 больным сеанс ВИФУ был выполнен на основании данных МРТ и наличия биохимического рецидива. Все больные до и после РПЭ были стратифицированы по стадиям (TNM) и степени онкологического риска (D'Amico), в ряде случаев послеоперационная оценка удаленной простаты изменяла стадию заболевания (рТ). Распределение пациентов по степени риска представлено на рис. 12.

С локализованной формой заболевания наблюдались 54 пациента:
- низкий риск – 14 пациентов, Т и рТ совпали у всех больных;
- умеренный риск – 18 пациентов, у 2 больных выявлена рТ3а, у 16 Т = рТ;
- высокий риск – 14 пациентов, рТ3а выявлена у 4 пациентов, у 10 Т = рТ.
Местнораспространенная форма заболевания (стадия Т3а) была до РПЭ у 8 пациентов, из них рТ2в – у 4, рТ3а – тоже у 4.
В клинической практике мы смогли добиться пятилетней безрецидивной выживаемости более чем для 50 % пациентов группы умеренного риска (табл. 1).
Некоторые результаты применения ВИФУ к больным с местным рецидивом РПЖ после РПЭ в зависимости от риска онкологической прогрессии представлены в табл. 2.
 В табл. 3 представлена статистика интра- и послеоперационных осложнений. У 20 % пациентов нами было отмечено отхождение некротических масс в послеоперационном периоде, 26 % больных отмечали жалобы на боль в промежностной области, которая самостоятельно проходила в среднем через месяц после лечения. У 29,6 % пациентов мы отмечали рубцовую деформацию и стриктуры зоны пузырно-уретрального анастомоза, что в связи с плохим мочеиспусканием требовало хирургической коррекции в виде оптической уретротомии или резекции склеротически измененных тканей шейки мочевого пузыря и зоны анастомоза. У ряда пациентов после сеанса ВИФУ возникло недержание мочи, однако лишь у одного больного отмечено недержание мочи III степени. В нашей клинической практике (54 пациента) нам удалось избежать наиболее тяжелых послеоперационных осложнений, таких как ректоуретральные фистулы. Суммируя данные, приведенные в табл. 3, мы уже сейчас можем говорить, что ВИФУ – один из наиболее безопасных методов лечения рецидива РПЖ.
В табл. 3 представлена статистика интра- и послеоперационных осложнений. У 20 % пациентов нами было отмечено отхождение некротических масс в послеоперационном периоде, 26 % больных отмечали жалобы на боль в промежностной области, которая самостоятельно проходила в среднем через месяц после лечения. У 29,6 % пациентов мы отмечали рубцовую деформацию и стриктуры зоны пузырно-уретрального анастомоза, что в связи с плохим мочеиспусканием требовало хирургической коррекции в виде оптической уретротомии или резекции склеротически измененных тканей шейки мочевого пузыря и зоны анастомоза. У ряда пациентов после сеанса ВИФУ возникло недержание мочи, однако лишь у одного больного отмечено недержание мочи III степени. В нашей клинической практике (54 пациента) нам удалось избежать наиболее тяжелых послеоперационных осложнений, таких как ректоуретральные фистулы. Суммируя данные, приведенные в табл. 3, мы уже сейчас можем говорить, что ВИФУ – один из наиболее безопасных методов лечения рецидива РПЖ.
Клиническое наблюдение. Пациент Х. 73 лет с диагнозом «аденокарцинома простаты pT2aN0M0G2». В 2004 г. в связи с повышением ПСА до 8,1 нг/мл выполнена биопсия ПЖ, обнаружена умеренно-дифференцированная аденокарцинома. Тогда же выполнена РПЭ, гистологическое заключение № 40419-25/04 – аденокарцинома 3 + 3 = 6 баллов по Глисону, края резекции отрицательные.
В дальнейшем, в 2008 г., отмечен рост уровня ПСА, составивший 4,49 нг/мл. При УЗИ в зоне пузырно-уретрального анастомоза выявлен участок солидной ткани, подозрительный на локальный рецидив РПЖ. 23.10.13 выполнена пункционная трансректальная биопсия зоны пузырно-уретрального анастомоза с применением гистосканирования. Гистологическое заключение № 7678/51467-71(5) – картина умеренно дифференцированной аденокарциномы 3 + 4 = 7 баллов по Глисону (рис. 10).
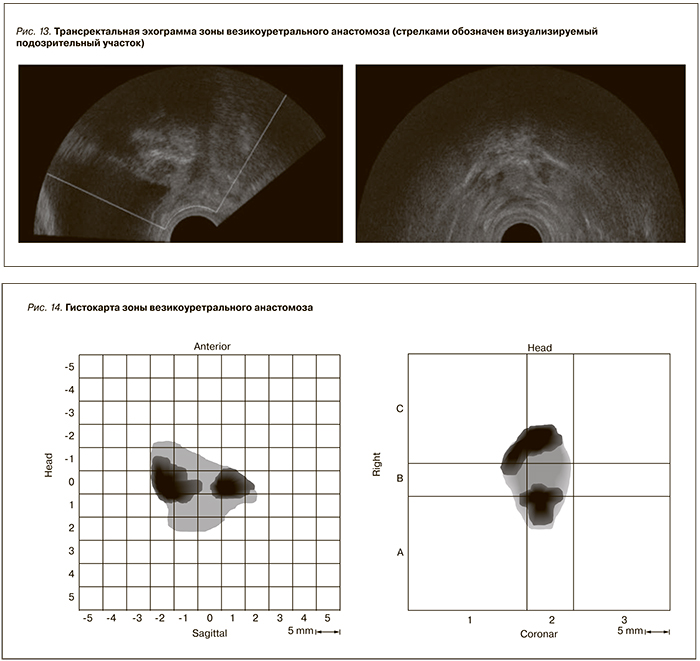
 При ТРУЗИ в зоне анастомоза выявлен солидный участок ткани, подозрительный на рецидив, размером до 2,5 × 1,1 × 1,4 см (рис. 13).
При ТРУЗИ в зоне анастомоза выявлен солидный участок ткани, подозрительный на рецидив, размером до 2,5 × 1,1 × 1,4 см (рис. 13).
При гистосканировании были выявлены участки ткани подозрительной структуры в зоне анастомоза (рис. 14).
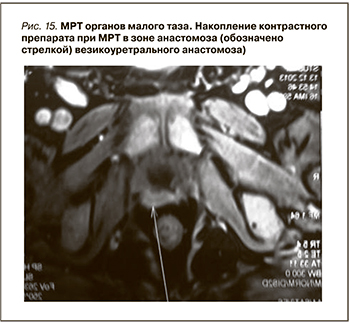
При МРТ-КУ малого таза в проекции пузырно-уретрального анастомоза отмечена гомогенная структура со сниженной интенсивностью сигнала размером 20 × 8 × 10 мм, расположенная преимущественно по передней и правой стенкам анастомоза, накапливавшая контрастное вещество (рис. 15).
Пациенту выполнена абляция ВИФУ зоны пузырно-уретрального анастомоза с патологическим участком.
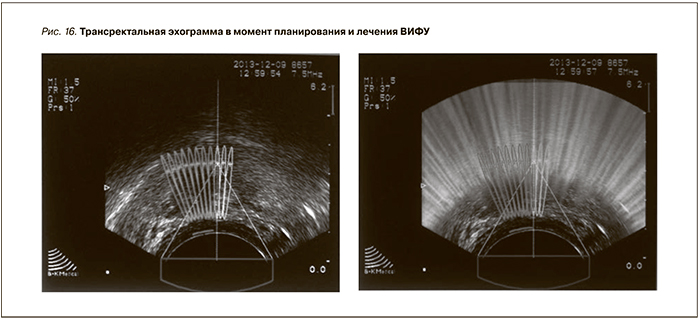
До начала сеанса лечения мочевой пузырь дренирован уретральным катетером. После разметки и планирования зоны абляции катетер удален, лечение производилось 2 блоками (рис. 16). Время операции составило 28 минут. После окончания лечения мочевой пузырь вновь дренирован уретральным катетером Фоли № 14 Сн.
Уретральный катетер был удален на 5-е сутки, пациент провел на стационарном лечении 7 дней. Через 2 месяца после операции уровень ПСА – 0,01 нг/мл, через 6 – 0,005 нг/мл. Неоадъювантная или адъювантная гормональная терапия пациенту не назначалась. При контрольном ТРУЗИ и гистосканировании через 6 месяцев солидных образований в зоне анастомоза визуализировать не удалось.
Заключение
Эндоректальная МРТ-КУ – современный и эффективный метод лучевой диагностики для выявления локального рецидива РПЖ после РПЭ со специфичностью 64 % и чувствительностью 96 %.
ВИФУ у больных с местным рецидивом РПЖ после РПЭ служит высокоэффективным методом лечения. С помощью ВИФУ возникает некроз измененной ткани уретровезикального анастамоза с минимальным повреждением окружающих тканей и минимальными побочными эффектами, имеется возможность ранней оценки эффективности лечения и прогноза. В случае неудовлетворительного результата вмешательства возможно прибегнуть к иному лучевому виду лечения либо повторить сеанс ВИФУ.
Несомненно, применение ВИФУ представляет большой интерес как для практикующих урологов, так и для пациентов, страдающих РПЖ. Данная тактика имеет статус «экспериментальной», но, опираясь на клинические данные, малое количество интра- и послеоперационных осложнений, лечение ВИФУ местного рецидива РПЖ может занять достойное место в лечении онкоурологических пациентов. Необходимо дальнейшее изучение этой технологии с получением отдаленных результатов лечения.



