Введение
В патогенезе ишемического/реперфузионного повреждения (ИРП) большое значение имеют не только повреждение клеток и их прямые межклеточные взаимодействия, но и циркулирующие факторы, поскольку после включения в кровоток трансплантированной почки происходит поступление в сосудистое русло реципиента массы токсинов, медиаторов и продуктов анаэробного метаболизма [1–5].
Реакции, происходящие в ПАТ, подвергнутому реперфузии, опосредуются различными видами медиаторов. Из них основными регуляторами воспаления, экспрессии молекул адгезии и активации лейкоцитов служат цитокины [6–8].
Цитокины – пептиды с небольшим молекулярным весом, являются регуляторными белками. Ишемия почки приводит к активации транскрипционных факторов – NF-κβ, белка теплового шока HSP, гипоксия-индуцируемого фактора (HIF). Транскрипционный ответ на острую ишемию приводит к выделению провоспалительных цитокинов – ИЛ-1, -2, -6, -8, ФНОα, γ-интерферона. Цитокины играют важную роль как в местных, таких и в системных процессах у донора и реципиента. Известно, что селективное блокирование или удаление цитокинов способно ослабить тяжесть ИРП [8].
М.В. Гринев и соавт. рассматривают синдром ишемии-реперфузии как неспецифический процесс и отмечают схожесть патогенеза ИРП при сепсисе, травматическом и ожоговом шоке, остром панкреатите, синдроме ишемии-реперфузии при трансплантации почек, ишемии нижних конечностей при поражении сосудов, кишечной непроходимости. При этом одну из основных ролей в развитии этих состояний авторы отводят циркулирующим цитокинам [6].
Подходы к борьбе с ИРП при АТТП можно разделить на три основных направления. Первое – борьба с неспецифическими факторами: уменьшение продолжительности холодовой и тепловой ишемии, улучшение контроля за состоянием донора на предагональном этапе, совершенствование способов консервирования трансплантата и др. Второе – применение различных препаратов для коррекции метаболических нарушений в ПАТ и его фармакопротекции для воздействия на отдельные звенья патогенеза реперфузионного повреждения. Однако, несмотря на множество предложенных методик, возможности как первого, так и второго названных подходов на сегодняшний день очень ограничены, что диктует необходимость совершенствования методов борьбы с ИРП [9–11].
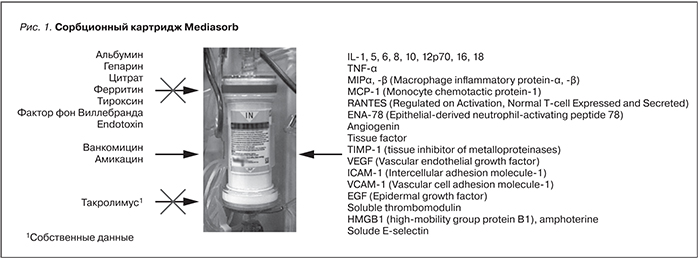
Третий подход к лечению ИРП – применение методов экстракорпоральной гемокоррекции. Весьма перспективным, однако, недостаточно изученным является метод селективной сорбции цитокинов в комбинации с гемофильтрацией [13, 14]. В основе этой методики лежит процедура сочетанной плазмофильтрации и адсорбции (СПФА) в специальном картридже – Mediasorb. Мы используем этот метод в комбинации с гемофильтрацией, в т.ч. и для снижения тяжести ишемического и реперфузионного повреждения. Первые результаты свидетельствуют в пользу эффективности этого метода. Однако отдаленные результаты пока не изучены.
Цель исследования: оценить отдаленные результаты применения сочетанной плазмофильтрации и адсорбции в раннем послеоперационном периоде для снижения тяжести ишемического и реперфузионного повреждения почечного трансплантата.
Материал и методы
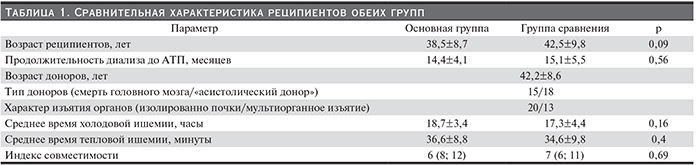
Проведено открытое рандомизированное исследование, в которое включили 33 пары реципиентов. Пациенты, которым проведена СПФА, составили основную группу. Парные почки были трансплантированы больным группы сравнения. Характеристики больных обеих групп представлены в табл. 1.
Больные находились под наблюдением от 9 до 17 месяцев.
СПФА проведена на аппарате Lynda (Bellco, Италия) с применением картриджа Mediasorb (рис. 1). Также в экстракорпоральный контур был включен гемофильтр. ГФ (гемофильтрация) проведена в режиме постдилюции. Доза ГФ подобрана индивидуально в интервале 25–35 мл/кг/ч. Процедура проведена непосредственно после трансплантации почки, т.е. примерно через 2–4 часа после реперфузии. Всем больным проведена одна процедура длительностью 8–12 часов. Схема процедуры представлена на рис. 2.
Мы оценили функцию ПАТ: истинную скорость клубочковой фильтрации (СКФ), концентрации креатинина и мочевины, а также показатель суточной протеинурии на протяжении года после АТП. Протокольные биопсии выполнены всем 33 парам реципиентов через год после трансплантации. Помимо этого биопсии выполнялись по показаниям при дисфункции трансплантата.
Всем больным проведена трехкомпонентная иммуносупрессивная терапия: такролимус (стартовая доза – 0,2 мг/кг/сут с последующим контролем концентрации в крови), микофенолат мофетил (2 г/сут), преднизолон (30 мг/сут) с индукцией базиликсимабом (в/в 20 мг – 0 и 4-е сутки) и метилпреднизолоном (в/в на 0, 2-е и 4-е сутки, суммарная доза – 1,5–2 г).
При анализе различий качественных признаков использованы критерий χ2 и точный критерий Фишера. Для сравнения средних двух несвязанных выборок применен критерий Стьюдента с учетом однородности дисперсий. Оценен двусторонний уровень значимости. Значения p<0,05 считались статистически значимыми. Анализ проведен в программе SPSS v. 17. Настоящее исследование было одобрено независимым комитетом по этике ГБУЗ МО МОНИКИ.

Результаты исследования
Были проанализированы основные лабораторные показатели: уровень азотемии, СКФ (как показатели, характеризующие функциональную состоятельность трансплантата), а также суточная протеинурия (как прогностический показатель) через 3 (табл. 2), 6 (табл. 3) и 12 месяцев (табл. 4) после АТП.
Как следует из табл. 2, в основной группе через три месяца после АТП уровни азотемии были ниже, а СКФ выше, чем у больных группы сравнения. Однако различия между группами были статистически незначимыми. Тем не менее суточная протеинурия была статистически значимо ниже у больных основной группы, что может свидетельствовать о меньшей выраженности трансплантационной нефропатии.
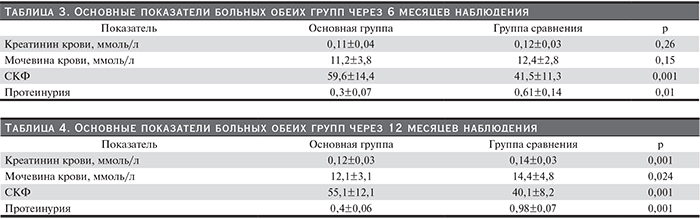
Через 6 месяцев после АТП уровни азотемии еще больше снизились. Это может свидетельствовать о том, что процесс регенерации почечной паренхимы после АТП длительный и восстановление почечной функции продолжается значительный период времени. При этом различия в уровне азотемии были статистически не значимы. В то время как СКФ была значимо выше, а протеинурия значимо ниже у больных основной группы.
Через год после трансплантации различия между группами стали еще более выраженными: по всем анализируемым параметрам больные основной группы имели статистически значимо лучше показатели, чем больные группы сравнения. При этом у больных обеих групп СКФ несколько снизилась, а протеинурия осталась практически на прежнем уровне.
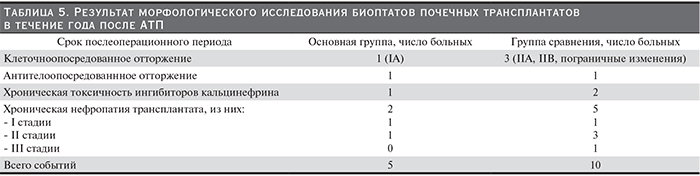
Результаты биопсий через год после АТП представлены в табл. 5.
Всего у 2 пациентов основной группы и 4 – группы сравнения выявлены признаки отторжения.

У одного пациента основной группы клеточноопосредованное хроническое отторжение было выявлено при протокольной биопсии через год после АТП. Это состояние не сопровождалось клинической симптоматикой. При морфологическом исследовании ПАТ было выявлено, что имеется отек интерстиция, значительная интерстициальная инфильтрация интерстиция мононуклеарными клетками (>25% паренхимы) и очаги умеренного тубулита (тубулит до 5–7 клеток на сечение канальца) (i2, t2). Было диагностировано острое клеточноопосредованное отторжение IА. Проведена пульс-терапия метилпреднизолоном с положительным эффектом.
В группе сравнения клеточноопосредованное отторжение выявлено у 3 реципиентов. У 2 выявлен рост креатинина (на 3-м и 8-м месяцах послеоперационного периода): с 95 до 180 и с 110 до 210 мкмоль/л. При морфологическом исследовании ПАТ выявлено, что одного из них имеется среднетяжелый интимальный артериит (v1), у другого – тяжелый интимальный артериит, составивший >25% от люменальной области (v2). Было диагностировано клеточноопосредованное отторжение IIA- и IIB-типов соответственно. Еще у одного реципиента группы сравнения были выявлены пограничные изменения, подозрительные на клеточноопосредованное отторжение лишь при протокольной биопсии через год после АТП: очаговая инфильтрация интерстиция (i1) и фокальный тубулит (t1-2). После терапии все пациенты были выписаны с улучшением функции ПАТ.
У двух реципиентов (по одному из каждой из групп) развилось острое отторжение трансплантата по гуморальному типу, диагностированное по свечению C4d-компонента комплемента в перитубулярных капиллярах. Обоим пациентам был проведен курс плазмафереза и терапия иммуноглобулином, после чего отторжение было купировано, функция трансплантата восстановилась. При контрольной биопсии выявлены остаточные явления, признаков активности процесса нет.
Признаков острой нефротоксичности ингибиторов кальциневрина при морфологическом исследовании мы не отметили. Зато у одного реципиента основной группы и у 2 – группы сравнения мы обнаружили признаки хронической нефротоксичности: нодулярные гиалиновые депозиты афферентных артериол, «полосатый» интерстициальный фиброз, изометрическая вакуолизация клеток канальцев, гиперплазия юкстагломерулярного аппарата, склероз отдельных клубочков.
Хроническая неспецифическая нефропатия трансплантата была выявлена у 2 пациентов основной группы и 5 пациентов группы сравнения. У пациентов выявлялся нефросклероз, установить природу которого не удалось. Подобные поражения могут быть следствием целой группы факторов: тяжелого ишемического и реперфузионного повреждения, тяжелой артериальной гипертензии, тяжелого криза отторжения и др.
Основным критерием тяжести поражения ПАТ является распространенность интерстициального фиброза (ci) и атрофии канальцев. По одному реципиенту в каждой группе имели минимальные изменения (ci и ct<25%) без каких-либо признаков другой патологии, что соответствовало первой степени ХТН. У 1 реципиента основной группы и 3 реципиентов группы сравнения имели выраженные изменения: фиброз 25–50% интерстиция и атрофия более четверти канальцев. Это состояние сопровождалось выраженным нарушением функции ПАТ и соответствовало II степени ХТН.
У одного реципиента группы сравнения функция трансплантата была выраженно нарушена (СКФ 22 мл/мин, креатинин крови 480 мкмоль/л) в результате ХТН III степени.
У этого реципиента при морфологическом исследовании были выявлены выраженные фиброз интерстиция и склероз более половины канальцев.
Обсуждение
На большом клиническом материале доказано, что некоторые параметры могут служить прогностическими критериями долгосрочной выживаемости трансплантата [15–23], причем площадь под ROC кривой достигает 0,86, что указывает на достаточную прогностическую ценность этих показателей. Большинство авторов сходятся во мнении, что в качестве таких критериев могут использованы такие простые и, что важно, неинвазивные методы, как измерение СКФ, концентрации креатинина и суточной протеинурии.
Известно, что СКФ>60мл/мин через год после трансплантации ассоциируется с хорошим прогнозом долгосрочной выживаемости ПАТ [24], тогда как снижение этого показателя <30мл/мин – с плохим [24–26]. Нами была проведена стратификация больных по показателям СКФ через год после АТП (табл. 6).
К сожалению, различия между группами не достигли необходимого уровня статистической значимости – р=0,055. Тем не менее видно, что в обеих группах большинство пациентов имели СКФ от 30 до 60 мл/мин. При этом в основной группе 9 пациентов имели СКФ более 60 мл/мин, когда как в группе сравнения их было 2. Число реципиентов с СКФ менее 30 мл/мин было вдвое ниже в основной группе.
Также прогностической ценностью может обладать значение креатинина крови, а именно – порог в 250 мкмоль/л [27]. Распределение больных по отношению к этому порогу предсталвено в табл. 7.
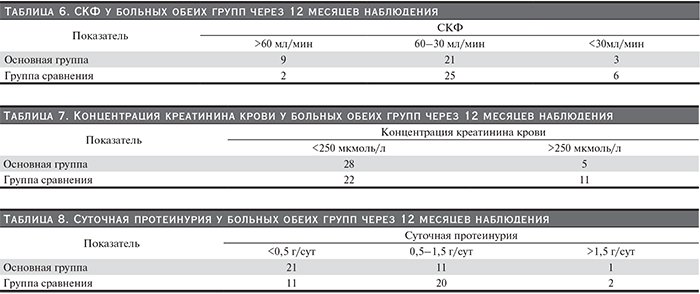
Различия между группами также не достигли необходимого уровня статистической значимости – р=0,085. Однако число больных креатинином крови более 250 мкмоль/л было в два раза меньше в основной группе.
Важным нам представляется уровень суточной протеинурии (табл. 8). Известно, что суточная протеинурия>0,5 г/л сопряжена с увеличением относительного риска утраты ПАТ в 4 раза. Тогда как при уровне суточной протеинурии более 3 г/сут, этот риск возрастает в 19 раз [23, 27].
При этом большинство больных основной группы имели показатели суточной протеинурии менее 0,5 г/сут. Различия между группами были статистически значимыми – р=0,048.
Выводы
Таким образом, в результате применения СПФА в раннем послеоперационном периоде можно ожидать улучшения функции в долгосрочной перспективе, а также улучшения прогноза выживаемости трансплантата. Главным образом это обусловлено уменьшением числа и тяжести эпизодов острого отторжения и снижением скорости прогрессирования хронической трансплантационной нефропатии.



