Результаты трансплантации трупной почки и длительность функционирования органа во многом зависят от первичной функции и скорости восстановления азотовыделительных показателей. Первичная функция трансплантата и быстрая нормализация уровня креатинина в плазме крови в течение первой недели после операции являются объективными прогностическими критериями хорошей выживаемости почечного аллотрансплантата (ПАТ) [1, 2, 3]. Ишемическое и реперфузионное повреждения донорской почки могут быть одной из основных причин отсроченной функции трансплантата.
В связи с этим понятен непрерывно возрастающий интерес к разработке новых методов устранения негативных факторов, отягощающих травму почки.
Ранняя дисфункция пересаженной почки – это сложный многофакторный процесс, в котором условно можно выделить три этапа. Первый связан с негативными факторами, воздействующими на почку еще в организме донора, затем – в процессе консервации органа и во время хирургического вмешательства, что проявляется различной степенью ишемического повреждения трансплантата. Второй этап связан с реперфузией органа после длительной ишемии, третий – с воздействием иммунной системы реципиента на донорскую почку, что обусловливает рост напряженности иммунологического конфликта между организмом хозяина и трансплантатом.
При парных трансплантациях почки от одного и того же донора разным реципиентам с определенными допущениями можно согласиться с тем, что влияние на первом этапе аноксических факторов на обе почки или одинаково, или сопоставимо. После восстановления кровотока в кровяное русло реципиента поступают продукты патологически измененного метаболизма трансплантата, поврежденного в период ишемии. В настоящее время общепризнанно, что вызываемые свободными радикалами кислорода окислительные повреждения мембран занимают важное место среди ишемических и реперфузионных осложнений и оказывают существенное влияние на результаты трансплантации. Считается, что в основном именно реперфузионное повреждение почки приводит к первичной дисфункции трансплантата [4–7].
Для снижения тяжести ишемического и реперфузионного повреждения в настоящее время предложено достаточное количество методик: от фармакопротекции донорского органа на этапах концидионирования донора [8, 9] и консервации [10–12] до различных вариантов аппаратной перфузии во время консервации [13, 14]. При этом плазмаферез (ПА) обладает высоким потенциалом коррекции нарушений гомеостаза, возникающих в трансплантированной почке в результате ишемии и реперфузии уже после трансплантации.
Использование нами ПА в течение первых часов после операции было направлено на то, чтобы ограничить или по возможности устранить воздействие негативных факторов.
В связи с этим эффективность ПА мы оценивали по функции, степени ишемического повреждения трансплантата, а также сроку нормализации выделительной функции и выживаемости трансплантатов.
Целью настоящего исследования была оценка влияния ПА на функцию почечного аллотрансплантата.
Материал и методы
Обследованы 80 реципиентов аллогенных почек, которым выполнена стандартная трансплантация почки. Во всех случаях использовали гипотермическую консервацию трансплантата с применением раствора Кустодиол в течение 12–28 (17,1 + 5,6) часов. Время вторичной тепловой ишемии не превысило 45 минут.
Всех пациентов разделили на две группы. В первую вошли 40 реципиентов, которым проведен сеанс ПА не позднее 3 часов после начала реперфузии трансплантата; во вторую – 40 больных, которым ПА не проводился. Всем больным предложена одинаковая лекарственная терапия. Схема иммуносупрессии включала ингибитор кальцинейрина (циклоспорин А или такролимус), микофенолаты и преднизолон.
Характеристики групп представлены в табл. 1. Из нее видно, что сравниваемые группы были хорошо сопоставимыми по анализируемым признакам.
Сеанс ПА проведн на аппарате фирмы Haemonetics PCS-Ultralite на протяжении 1,5–5,0 часов. За сеанс ПА удалено 1150–3250 мл плазмы (30–40 мл/кг массы тела больного) со скоростью 600–1200 мл/ч.
Удаленный объем плазмы рассчитан согласно должному ОЦП с учетом показателя гематокрита, который на момент начала процедуры колебался в пределах 25–35 %. Заместительная терапия составила 70–150 % от объема удаленной плазмы с инфузией от 1,2 до 3,3 (2,64 + 0,62) литра различных растворов, объем и состав которых зависели от состояния гемодинамики, величины диуреза, характера и темпа отделяемого по дренажу: использованы раствор Рингера, дисоль, физиологический раствор, 10 %-ный раствор альбумина и свежезамороженная плазма.
 Для оценки функции ПАТ в послеоперационном периоде ежедневно определяли ряд показателей: скорость клубочковой фильтрации (СКФ) оценивали по клиренсу эндогенного креатинина, степень ишемического повреждения трансплантата – по СКФ в первые сутки после операции, азотовыделительную функцию почки – по содержанию креатинина и мочевины в плазме крови. Кроме того, проведена сравнительная оценка групп пациентов по срокам нормализации азотовыделительной функции ПАТ, по количеству сеансов гемодиализа, потребовавшихся до восстановления функции трансплантата, и количеству утраченных трансплантатов по причине отсутствия функции.
Для оценки функции ПАТ в послеоперационном периоде ежедневно определяли ряд показателей: скорость клубочковой фильтрации (СКФ) оценивали по клиренсу эндогенного креатинина, степень ишемического повреждения трансплантата – по СКФ в первые сутки после операции, азотовыделительную функцию почки – по содержанию креатинина и мочевины в плазме крови. Кроме того, проведена сравнительная оценка групп пациентов по срокам нормализации азотовыделительной функции ПАТ, по количеству сеансов гемодиализа, потребовавшихся до восстановления функции трансплантата, и количеству утраченных трансплантатов по причине отсутствия функции.
Результаты и обсуждение
В табл. 2 представлены показатели диуреза и число пациентов, нуждавшихся и не нуждавшихся в проведении гемодиализа в первый день после операции. Среди пациентов 1-й группы (которым проведен ПА) немедленная функция трансплантата наблюдалась в 90 % и только в 10 % случаев потребовалось проведение гемодиализа. Во 2-й группе реципиентов (которым ПА не проводился) с олигоанурией было значительно больше.
Все пересаженные почки на первые сутки после операции характеризовались снижением показателя клубочковой фильтрации по сравнению с нормальной. Величина клубочковой фильтрации на первые сутки после операции, темп ее увеличения в динамике совместно с начальной функцией имеют существенное значение для оценки выраженности ишемического и реперфузионного повреждения и прогнозирования функции трансплантата. Распределение пациентов по величине клубочковой фильтрации на первые сутки после операции представлено на рис. 1. Количество ПАТ с СКФ более 20 мл/мин в 1-й группе было в 2 раза больше, чем во 2-й, а с СКФ 6 мл/мин – всего лишь 10 % по сравнению с 42,5 % во 2-й. Реципиентам, у которых СКФ ПАТ превышала 20 мл/мин, гемодиализ не проводили, а всем реципиентам с клубочковой фильтрацией менее 6 мл/мин потребовалось проведение гемодиализа. Помимо этого у пациентов 1-й группы количество сеансов и длительность применения ГД были значительно меньше по сравнению с пациентами второй группы: 5 (4–9) и 12 (9–14) соответственно. Четырем реципиентам 2-й группы с СКФ в диапазоне от 6 до 20 мл/мин также потребовалось проведение гемодиализа в послеоперационном периоде.
Количество проведенных сеансов ГД зависело от степени ишемического и реперфузионного повреждения трансплантата, величины клубочковой фильтрации в первые сутки после операции и первичной функции пересаженной почки. ПА оказывал существенное положительное воздействие на первичную функцию и сроки нормализации азотовыделительной функции трансплантатов.
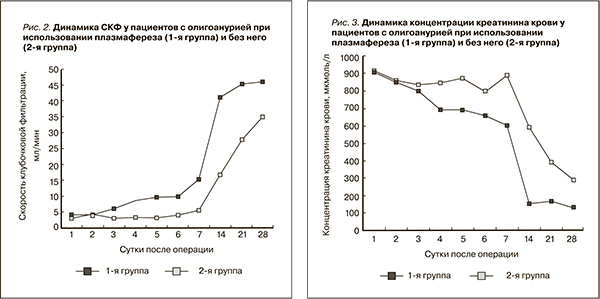
Нормализация азотовыделительной функции почки наступала тем быстрее, чем больше была величина клубочковой фильтрации. В 1-й группе пациентов темп нормализации СКФ был значительно выше, чем во 2-й, – рис. 2.
Темп нормализации азотемии был также значительно выше среди больных 1-й группы – рис. 3.
Выживание трансплантатов в течение года после операции в 1-й группе составило 95,0, во 2-й – 87,5 %. В 1-й группе было удалено два функционирующих ПАТ в связи с необходимостью отмены иммуносупрессии вследствие развития тяжелой инфекции.
В нашем исследовании в 1-й группе пациентов не было первично нефункционирующих трансплантатов, в то время как среди реципиентов парных почек (2 группа) было 3 первично нефункционирующих трансплантата (7,5 %). При этом в 1-й группе было только 4 трансплантата (10 %), тяжелая травма которых привела к олигоанурии в раннем послеоперационном периоде, во 2-й – 17 (42,5 %).
Необходимо отметить, что 4 парные почки прошли через стадию олигоанурии как в 1-й группе с ПА, так и во 2-й. Считаем, что основные аноксические повреждения эти 8 почек получили именно на первом этапе ишемического воздействия на трансплантат. Анализ наличия негативных факторов во время кондиционирования доноров установил, что все страдали длительной, медикаментозно некорригируемой артериальной гипотонией; в трех случаях диурез в последние часы перед изъятием отсутствовал. В одном случае почка имела четыре артерии, что, возможно, сделало проблемной адекватную перфузию органа консервирующим раствором после и увеличило срок вторичной тепловой ишемии при трансплантации. Кроме того, срок консервации двух пар почек приблизился к предельно допустимому и составил 26–28 часов.
Однако даже в этих случаях применение ПА положительно повлияло на сроки восстановления функции трансплантатов в раннем послеоперационном периоде. Действительно, азотовыделительная функция трансплантатов при проведении ПА нормализовалась в 2–3 раза быстрее, чем у реципиентов парных почек без ПА: в 1-й группе у пациентов нормализацию функции наблюдали к концу второй недели, во 2-й – между 4-й и 6-й неделями. Кроме того, на период восстановления функции трансплантата реципиентам 2-й группы потребовалось значительно больше сеансов ГД, чем пациентам 1-й группы.
У 4 из 21 пациента (2-я группа) с отсроченной функцией трансплантата в первые послеоперационные сутки наблюдалась полиурия.
Можно предположить, что в 13 (32,5 %) случаях олигоанурии и в 4 – полиурии у реципиентов 2-й группы отсроченная функция трансплантата была обусловлена тяжелой реперфузионной травмой, что заслуживает особого внимания и отдельного анализа. Так, из четырех почек с полиурией в трех случаях причиной развившейся впоследствии анурии явилось тяжелое ишемическое повреждение трансплантата, в одном – криз отторжения. Во всех случаях диагноз верифицирован морфологическим исследованием. Из этих почек один трансплантат был удален по причине его нефункционирования. Из 13 почек с олигоанурией первично нефункционирующий трансплантат наблюдался в двух случаях, в 4 – послеоперационный период осложнился острой реакцией отторжения, что потребовало усиления иммуносупрессивной терапии. Всем этим реципиентам проведены сеансы ГД. При этом пациенты 1-й группы, которым трансплантировали парные почки от тех же доноров и провели ПА, не нуждались в каких-либо других дополнительных процедурах, за исключением двух реципиентов, которым была проведена пульс-терапия метилпреднизолоном, поскольку дуплексная сонография выявила у них начальные признаки реакции отторжения трансплантата.
Таким образом, у пациентов 2-й группы сроки нормализации креатинина и количество сеансов гемодиализа, потребовавшихся до восстановления функции ПАТ, были значительно больше, а СКФ – ниже по сравнению с пациентами 1-й группы. Так, СКФ менее 6,0 мл/мин в первые сутки после операции указывала на пролонгированное течение острого канальцевого некроза, а скорость ее восстановления – на тяжесть ишемического и реперфузионного повреждения трансплантата, что определяло количество проведенных сеансов гемодиализа.
Результаты настоящего исследования могут служить прямым доказательством выраженного позитивного воздействия процедуры ПА в раннем послеоперационном периоде на функцию ПАТ, сроки нормализации азотовыделительной функции в раннем послеоперационном периоде и выживаемость трансплантатов.
Уже на этом этапе исследования полученные данные позволяют предположить разную этиологию и различную степень воздействия повреждающих факторов, влияющих на восстановление функции ПАТ. Позитивное влияние ПА на дальнейшую выделительную функцию ПАТ может быть связано с устранением минимум двух причин: коррекции последствий ишемической травмы и реперфузионного синдрома и предотвращением возможного скрытого иммунологического конфликта. Наши данные позволяют говорить о положительном влиянии ПА одновременно на оба эти фактора.
О возможном предотвращении скрытого иммунологического конфликта посредством ПА в наших наблюдениях можно судить в связи с тем, что у больных 1-й группы признаки острого отторжения отмечены лишь в 2 случаях, в группе сравнения – в 5. При этом в крови всех больных наблюдались терапевтические концентрации ингибиторов кальциневрина.
Многие исследователи подтверждают предположение о природе первично нефункционирующего трансплантата преимущественно иммуно-ишемического характера, причем иммунологический компонент во многих случаях имеет первостепенное значение. Отсутствие функции трансплантата на фоне немедленной функции другой парной почки, по мнению А.Ю. Беляева и соавт. (2000), может свидетельствовать о наличии недиагностированного иммунологического конфликта [15].
Таким образом, полученные нами данные убедительно доказывают, что процедура ПА, проведенная не позднее 3–5 часов после операции, оказывает выраженное положительное воздействие на функциональное состояние аллотрансплантированной почки как в ближайшем, так и в отдаленном послеоперационном периоде. Безопасность и отсутствие осложнений позволяют рекомендовать ПА в качестве профилактического мероприятия по устранению и предупреждению постишемических и реперфузионных повреждений, а механизм его действия нуждается в дальнейшем изучении.