Трансплантация почки (ТП) – оптимальный метод лечения пациентов в терминальной стадии хронической болезни почек (ХБП-V). Однако пациенты с трансплантированными органами имеют повышенный риск развития различных злокачественных новообразований [1]. После ТП наблюдается 15-кратное повышение риска развития почечно-клеточной карциномы по сравнению с общей популяцией [2]. Из всех почечно-клеточных карцином (ПКК), развившихся после ТП, папиллярный рак составляет около 40%, в общей популяции – только 10–15% [3]. Помимо традиционных факторов риска, таких как курение, избыточная масса тела, злоупотребление анальгетиками, длительная иммуносупрессия, вирусные инфекции (ВК-вирус), болезнь фон Гиппеля–Линдау, немаловажное значение для возникновения злокачественных опухолей после ТП как в собственных (нативных) нефункционирующих почках, так и в трансплантированной почке – функционирующей или нефункционирующей, имеет приобретенная кистозная болезнь почек (ПКБП), которая встречается среди 70–90% пациентов, находящихся на лечении заместительной почечной терапией [4].
В 1977 г. Mike Dunnill доложил об особой форме опухоли почки, которая развивается из кист почек у больных, длительное время находящихся на лечении гемодиализом. Автор систематизировал аутопсии 30 больных, страдающих ХБП- V, леченных систематическим гемодиализом (ГД).
У 14 из них он нашел многочисленные почечные кисты, 6 из них имели почечноклеточную карциному, 1 – метастазы опухоли в почку. Небольшие размеры кист, отсутствие клинических симптомов не позволили оценить эти изменения в почках как клиническую проблему. Однако это позволило выделить особую форму кистозной болезни, развившейся на фоне лечения ГД и способствовавшей возникновению рака почки, а именно приобретенную кистозную болезнь почек [5]. Было показано, что время, проведенное на лечении ГД, служит важным фактором риска для возникновения ПКБП и как следствие – рака почки. Частота диагностирования ПКБП у больных при лечении длительным диализом варьировалась от 20 до 90%. Проведены также исследования по оценке частоты возникновения ПКБП у различных групп больных в зависимости от длительности лечения ГД [6]. M.A. Matson et E.P. Cohen исследовали развитие ПКБП и ее соотношение с почечно-клеточным раком (ПКР) у пациентов ХБП-V. Авторы показали, что существует тесная корреляция между ПКБП и длительностью заместительной почечной терапии, но не с типом диализа, которое проводилось. Чаще всего ПКБП наблюдалась у больных, находившихся на лечении длительным систематическим ГД. ПКБП диагностируется у 20% пациентов, находящихся на лечении ГД от 1 года до 3 лет, и в >90% у тех, кто был на диализе от 5 до 10 лет [7]. Вероятность ПКК у пациентов с ПКБП составляет 4–7% в течение 7–10 лет с годовой заболеваемостью 0,18% [8]. У реципиентов с успешно трансплантированной почкой меньший риск образования ПКБП меньше, и у них даже может происходить регресс кист [9]. Однако в 2006 г. Moudouni et. al. отметили высокую частоту возникновения ПКР в собственных почках при ПКБП и у реципиентов после трансплантации – в основном у больных, до трансплантации длительное время лечившихся ГД. Большинство опухолей почек, развившихся на фоне ПКБП, имеет сравнительно благоприятный прогноз [10]. В 2007 г. L.E. Ianhez et al. сообщили, что у 10 из 1375 пациентов, которым была выполнена трансплантация почки, диагностированы ПКК и ПКБП. Все эти больные лечились ГД, в среднем 8,4 года [11]. Показано, что ПКБП увеличивает частоту ПКК примерно на 20%. У больных, получающих диализную терапию, показатель заболеваемости ПКР в 40–100 раз выше, чем в популяции людей, не страдающих болезнью почек [12].
Y. Kojima et al. привели ретроспективные данные 2624 больных, леченных ГД. У 81,8% из них после лечения ГД в среднем в течение 11 лет они обнаружили приобретенные кисты почек. Однако только у 44 (1,68%) больных был диагностирован рак почки [6]. По данным американских исследователей, у 1/5 из 30% больных, страдающих ПКБП, развивается рак почки, что составляет 6% от общей диализной популяции [3]. Опухоли почек, как правило, возникают в молодом возрасте, часто они мультифокальные и билатеральные, чаще всего низкой степени злокачественности и градации по Фурману, однако возникновение метастазов может приводить к смертельным осложнениям [13]. Для постановки диагноза ПКБП необходимы наличие в почках как минимум трех кист, отсутствие семейного анамнеза кистозных образований почек, отсутствие кист до начала лечения гемодиализом и наличие почечной недостаточности. На практике число приобретенных кист различно, они могут отличаться по размеру и морфологическому строению, поражать более 25% почечной паренхимы. Кисты могут быть выстланы однослойным уплощенным эпителием, однослойным или гиперплазированным многослойным кубическим эпителием. Кровотечение из кист – распространенное явление, в связи с чем в цитоплазме эпителия часто выявляется пигмент гемосидерина. В кистах при ПКБП также часто выявляются кристаллы оксалата, что может быть использовано в качестве одного из диагностических критериев этой патологии [14]. Предполагаемая модель роли оксалатов в развитии ПКБП, ассоциированной с ПКР, следующая. В результате сморщивания почки возникает почечная недостаточность, что ведет к увеличению концентрации оксалатов в крови. В свою очередь оксалаты накапливаются в эпителии канальцев почки с образованием кристаллов. Тубулярный эпителий почек в результате возникновения высокого уровня оксалата натрия страдает от оксидативного стресса и процесса периокисления липидов, что ведет к повреждению ДНК и как следствие – к мутации и образованию раковой опухоли. Однако до настоящего времени не ясен механизм возникновения ПКБП и образования ПКР на фоне этой патологии.
Существует гипотеза, будто образование кист в пораженной почке идет за счет гиперплазии эпителия канальцев, активации эпидермального фактора роста, активации фактора роста гепатоцитов и т.н. протоонкогенов [15]. В большинстве, но не во всех случаях опухоли собственных почек развиваются в ассоциации с ПКБП. Было высказано предположение, будто ПКБП служит независимым фактором риска развития ПКР [3, 16]. Папиллярная гиперплазия эпителия кист регистрируется практически во всех исследованиях опухолей, возникающих при ПКБП, и, вероятно, является патогенетической основой для развития опухолей почек не только при ПКБП, но и при аутосомно-доминантном поликистозе почек, осложненной ХБП-V [17]. После трансплантации почки малигнизация кист ПКБП наблюдается чаще у больных, до трансплантации лечившихся ГД более 10 лет [18]. I. Ishikawa et al. в своем проспективном исследовании собственных почек у 61 реципиента в сроки от 1 года до 2 лет после трансплантации у 52,5% из них наблюдали ПКБП почек. У 14,8% больных не было зафиксировано изменений в количестве кист, у 14,8% число кист уменьшилось, у 17,9% – увеличилось. Было высказано предположение, будто ПКБП была вызвана гиперплазией эпителия канальцев в результате сморщивания почек и уремии. Снижение уровня уремии после успешной трансплантации может приводить к регрессу ПКБП [19]. К аналогичному предположению пришли ученые из Кореи. Они показали, что частота ПКБП у реципиентов после успешной трансплантации была ниже, чем у пациентов, леченных ГД. Также статистически значимой была зависимость между ПКБП и частотой ПКР по сравнению с группой пациентов с трансплантационной почкой (р<0,01) [20].
В отечественной литературе мы не нашли описания пациентов с ПКБП, у которых после трансплантации почки произошла малигнизация кист как собственной почки, так и трансплантата. Ниже приводим описание клинического наблюдения пациента с развитием папиллярной почечно-клеточной карциномы через 7 лет после трансплантации почки.
Больной П. 38 лет поступил 13.02.2016 с диагнозом «хронический диффузный гломерулонефрит, нефрогенная гипертензия, миокардиодистрофия, ХБП-V, состояние после трансплантации почки в 2009 г.».
Болен с 2004 г., когда при обследовании диагностированы хронический диффузный гломерулонефрит, артериальная гипертензия. Лечился амбулаторно. Ухудшение с мая 2006 г.
С июня 2006-го – уремическая интоксикация. Креатинин крови – 1250 мкмоль/л, мочевина крови – 34,2 ммоль/л. Гиперкалиемии нет. При обследовании: ультразвуковое исследование (УЗИ) почек – почки обычной формы, уменьшены в размерах 66×28, 71×29. Контуры четкие, ровные. Дифференциация на слои сохранена. Паренхима до 8 мм, эхогенность обычная. ЧЛС не расширена, конкрементов нет. В проекции надпочечников патологических образований нет. В брюшной полости и забрюшинном пространстве лимфоузлы не увеличены.
14.07.2006 больному имплантирован перитонеальный катетер и начато лечение постоянным амбулаторным перитонеальным диализом. Постепенно состояние больного улучшилось, что позволило включить пациента в лист ожидания трансплантации почки. 13.02.2009 поступил в отделение трансплантации почки и диализа для выполнения экстренной операции трансплантации почки. Совпадение по системе HLA по трем лейкоцитарным антигенам: A2, B21, Dr2. Выполнена операция без особенностей: 1 артерия, 1 вена. Уретероцистоанастомоз по антирефлюксной методике. Выполнена стандартная индукция: симулект в сумарной дозе 40,0. Во время трансплантации: метилпреднизолон – 500,0 в/в. Установлен Stent № 6 в донорский мочеточник. Назначена трехкомпонентная иммуносупрессивная терапия: циклоспорин А – 180, преднизолон – 35, микофенолат – 1500. Послеоперационный период осложнился острым канальцевым некрозом трансплантата, разрешенным на 10-е сутки. Проведен перитонеальный диализ. На 20-е сутки после трансплантации при УЗИ выявлен мочевой затек. Выполнена ревизия трансплантата. Обнаружен тотальный некроз трети донорского мочеточника, дистальной его части. Выполнен реуретероцистоанастомоз. Послеоперационный период осложнился формированием лимфоцеле в области нижнего полюса трансплантата. Осуществлено внутреннее дренирование лимфоцеле. Больной выписан домой на 60-е сутки с удовлетворительной функцией трансплантированной почки. УЗИ трансплантата: размер11,0×5,3×6,1 см, контуры ровные четкие. Корковый слой – 1,7 см. Дифференциация на слои сохранена. Чашечно-лоханочная система не расширена, конкрементов, жидкостных образований нет. Ri – 0,72. По данным компьютерной томографии от 23.11.2009, одиночные мелкие подкапсульные образования диаметром 2–3 мм в верхнем и нижнем сегментах донорской почки. Умеренное утолщение стенки лоханки и мочеточника. Затека контрастного вещества нет. С 2016 г. ухудшение функции трансплантированной почки. Креатинин крови – 875 мкммоль/л, мочевина крови – 45 ммоль/л. Количество мочи за сутки до 800,0 мл. Больной переведен на лечение систематическим ГД. В анализах мочи: потеря белка до 4,5 г/сут. Посев мочи: роста нет. При обследовании: УЗИ брюшной полости выявило округлое образование, гипоэхогенное с четкими контурами в нижнем полюсе правой почки размером 42×35×30 мм, определяются локусы интра- и пердулярного кровотока, подозрение на опухоль. Размер почек: справа – 5,0×4,5×4,0 см, слева – 5,0×4,3×4,0 см. В левой почке простая киста размером 1,5х1,0 см, рис.1.
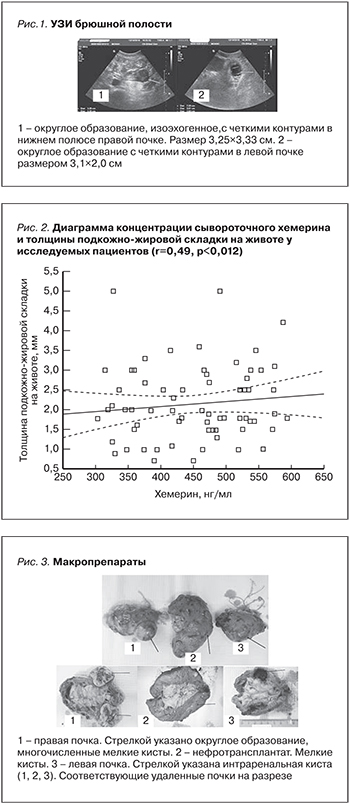 Выполнена компьютерная томография брюшной полости: в нижнем полюсе правой почки определяется образование с четкими ровными контурами, округлой формы, диаметром 36 мм, неоднородной структуры. Образование располагается преимущественно экстраренально. Трансплантат размером 117×94×60 мм. Паренхима истончена повышенной эхогенности с наличием множественных разнокалиберных кист диаметром от 3 до 30 мм. Чашечно-лоханочная система почки и мочеточник не расширены, рис.2.
Выполнена компьютерная томография брюшной полости: в нижнем полюсе правой почки определяется образование с четкими ровными контурами, округлой формы, диаметром 36 мм, неоднородной структуры. Образование располагается преимущественно экстраренально. Трансплантат размером 117×94×60 мм. Паренхима истончена повышенной эхогенности с наличием множественных разнокалиберных кист диаметром от 3 до 30 мм. Чашечно-лоханочная система почки и мочеточник не расширены, рис.2.
Поскольку функция донорской почки не восстанавливается, больной находится на лечении ГД, имеется подозрение на опухолевое образование собственной правой почки, множественные кисты левой почки, было принято решение выполнить билатеральную нефрэктомию и трансплантатэктомию. С учетом стабильного состояния пациента 02.11.2016 выполнена симультантная операция: билатеральная нефрэктомия и трансплантатэктомия чрезбрюшинным доступом. При ревизии парааортальных, паракавальных лимфоузлов патологии не выявлено. Послеоперационный период без осложнений. Больной выписан домой.
На рис. 3 представлены правая и левая почки, нефротрансплантат. В области нижнего полюса правой почки имеется округлое образование 3,5×3,5 см, плотное на ощупь. В левой почке имеются многочисленные кисты. В нефротранплантате – многочисленные кисты и аденоматозные узлы, рис. 3.
Гистологическое исследование нефротрансплантата. Микроскопическое описание препарата: в удаленном нефротрансплантате обнаружены множественные кортикальные папиллярные аденомы размером до 0,8 см, т.н. почечный аденоматоз, многочисленные кисты, выстланные уплощенным и кубическим с окцитофильной цитоплазмой. Отмечается неравномерно выраженный склероз интерстиция с диффузно-плазмоклеточной инфильтрацией, многочисленные фокусы тубулярной атрофии. В просвете отдельных канальцев мелкоочаговые кальцификаты. Глобальный и перигломерулярный склероз большинства клубочков. Гиалиноз артериол. Заключение: морфологическая картина хронического отторжения трансплантата. Нефросклероз трансплантата. Множественные кортикальные папиллярные аденомы. Солитарная папиллярная опухоль с низким злокачественным потенциалом, стадия I. Фурман I. TI, M0, N0. Многочисленные кисты нефротрансплантата, рис. 4.
Гистологическое исследование левой почки. Макроскопическое описание препарата: размер левой почки: 11,5×7×6 см. Жировая клетчатка почечного синуса избыточная, паренхима до 1,8 см. Обнаруживаются кисты диаметром от 0,1 до 0,3 см, беловато-желтого и серого цвета узелки, расположенные непосредственно под капсулой и в корковом веществе от 0,1 до 0,8 см. Микро: в левой почке атрофия паренхимы, диффузный склероз интерстиция. В ткани почки определяются многочисленные кисты. В одном из препаратов обнаружена онкоцитарная аденома (1,5 мм), рис. 5.
Гистологическое исследование правой почки: макроскопическое описание препарата. Размер почки – 7,5×4 см. Нижний полюс занимает четко отграниченный узел, достигающий капсулы почки, желтовато-серого цвета и диаметром 3,5 см.
 Паренхима до 0,5 см. Микроскопическое описание: узел почечноклеточного рака размером 3,5 см. Grade 2 по Фурману. Инвазии в капсулу почки не выявлено. Отмечаются атрофия паренхимы, диффузный склероз интерстиция, многочисленные фокусы канальцевой атрофии (тиреоидизация), глобальный и перигломерулярный склероз большинства клубочков. Определяются многочисленные кисты в ткани почки. При иммуногистохимическом (ИГХ) исследовании клетки опухоли экспрессируют цитокератин 7, AMCAR, виментин, очагово – CD10. Средний индекс Ki-67 не превышает 5%. Заключение: особенности строения и иммунофенотипа опухолевых клеток соответствуют папиллярному варианту почечноклеточного рака, Grade 2, рис. 6.
Паренхима до 0,5 см. Микроскопическое описание: узел почечноклеточного рака размером 3,5 см. Grade 2 по Фурману. Инвазии в капсулу почки не выявлено. Отмечаются атрофия паренхимы, диффузный склероз интерстиция, многочисленные фокусы канальцевой атрофии (тиреоидизация), глобальный и перигломерулярный склероз большинства клубочков. Определяются многочисленные кисты в ткани почки. При иммуногистохимическом (ИГХ) исследовании клетки опухоли экспрессируют цитокератин 7, AMCAR, виментин, очагово – CD10. Средний индекс Ki-67 не превышает 5%. Заключение: особенности строения и иммунофенотипа опухолевых клеток соответствуют папиллярному варианту почечноклеточного рака, Grade 2, рис. 6.
Заключение
По совокупности особенностей гистологического и иммуногистохимического исследований удаленных органов: папиллярный вариант почечно-клеточного рака правой почки (Grade 2 по Фурману) TIM0 N0, множественные кисты вторично сморщенной правой почки. Онкоцитарная аденома левой почки. Картина хронического отторжения, нефросклероз трансплантата. Множественные кортикальные папиллярные аденомы. Солитарная папиллярная опухоль с низким злокачественным потенциалом, многочисленные кисты нефротрансплантата.
Поскольку у больного диагностирован папиллярный вариант почечно-клеточного рака правой почки и аналогичная опухоль в трансплантате, повторную трансплантацию следует выполнять не менее чем через 2 года. Перед внесением больного в лист ожидания трансплантата необходимо выполнение компьютерной томографии брюшной полости для выявления возможных мест метастазирования. В случае отсутствия метастазирования трансплантация почки возможна.
В представленном случае раковому поражению подверглись правая почка больного и нефротрансплантат. Обнаружение многочисленных кист как в собственных почках, так и в трансплантате диктует онкологическую настороженность больных, получающих длительную иммуносупрессию. Раннее выявление патологии в нефротрансплантате у данного больного позволило бы произвести конверсию циклоспорина А на ингибиторы m-TOR, что, возможно, продлило бы функцию трансплантированной почки. Отмена циклоспорина А или существенное снижение его дозы в сочетании с назначением ингибиторов m-TOR позволяет большинству реципиентов ренального трансплантата, имеющих в анамнезе опухолевое поражение почек, добиться нераспространения опухолевого процесса. Обнаружение папиллярной опухоли с низким злокачественным потенциалом в правой почке и в трансплантате в стадии I. TI.M0.N0. предполагает отсутствие метастазов в лимфоузлах и других органах. Это обстоятельство положительно влияет на дальнейшую судьбу больного в плане трансплантации почки.
Кроме того, показано, что у достаточно тяжелых больных онкологическим поражением органов при необходимости возможно симультанное удаление органов, а именно билатеральная нефрэктомия с одновременным удалением трансплантированной почки. Данная операция избавляет больного от дополнительного оперативного вмешательства – трансплантатэктомии.
Недорогое неинвазивное УЗИ-исследование как собственных почек, так и трансплантата по-прежнему имеет важное значение при скрининге с целью выявления опухолей почек, приближающегося к 100% [10]. Скрининг должен быть проведен в течение месяца, а затем через каждые 6 месяцев после трансплантации почки. Как только имеется подозрение на патологическое образование в почке, необходимо выполнять компьютерную томографию (КТ), которая позволяет улучшать качество диагностики в 100% случаев [21]. Поражение опухолью собственных почек у реципиента почечного трансплантата, как правило, выявляется случайно при УЗИ или КТ брюшной полости, причем при других, как правило не связанных с собственными почками, показаниях. Это связано с тем, что большинство опухолей почек имели небольшие размеры и бессимптомны. Средний размер опухоли составлял 2,0–2,5 см [22]. В исследовании Chi Yuen Cheung у 11 больных с пересаженной почкой выявленные опухоли были бессимптомны и только у 1 пациента отмечена гематурия. Все опухоли были pTIM0N0 [23]. Лучший прогноз – выявление злокачественного образования при скрининговом обследовании, а не при появлении симптомов опухоли [19]. Большинство опухолей, ассоциированных с ПКБП, имеют благоприятный прогноз, однако исследования показывают, что имеется доля высокодифференцированных опухолей с летальностью до 25%, несмотря на агрессивное хирургическое лечение [24]. Хирургическое лечение, а именно нефрэктомия, является предпочтительным методом лечения для большинства больных с опухолью почек в стадии TIN0M0, без метастазов [25]. Выполнять резекцию пораженных собственных почек больным ХБП-V даже при маленьких опухолях не имеет смысла, поскольку почки уже не выполняют своей функции. Больной либо находится на лечении ГД, либо имеет хорошо функционирующий трансплантат.
В этом случае после удаления пораженных собственных почек и заживления раны при функционирующем трансплантате производится конверсия с циклоспорина А на m-TOR-ингибиторы, которые блокируют рост и размножение опухолевых клеток и подавляют ангиогенез [26].
Исследования показали, что появление в собственных почках даже одной кисты повышает у реципиентов почечного трансплантата риск развития ПКР в 1,7 раза [21]. Высокий уровень при ПКБП возникновения двусторонних опухолей дискутирует вопрос о необходимости профилактической билатеральной нефрэктомии. С учетом высокой частоты возникновения у пациентов с ПКР опухолей разных типов и того, что заболеваемость ПКБП возрастает с увеличением продолжительности диализа, для ранней диагностики предраковых и злокачественных новообразований пациентам на лечении ГД в течение 3–5 лет предложен периодический скрининг на выявление ПКБП и ассоциированного с ней ПКР [27]. A. Schwarz et al. предложили скрининговый подход к оценке кистозных образований, выявленных у реципиентов почечных трансплантатов, основанный на классификации кистозных образований в почках по Босняку:
- Всем реципиентам, находящимся на лечении ГД, необходимо проходить ежегодное обследование собственных почек независимо от наличия у них ПКБП.
- При выявлении ПКБП и наличии кист I и II по Босняку проводить обследование 2 раза в год, включающее УЗИ и КТ.
- При наличии ПКБП и кист IIF по Босняку УЗИ-исследование должно проводиться 4 раза в год и 1 раз в год КТ или МРТ.
- При прогрессировании кист (их росте и количестве, изменении содержимого), при сомнительных кистозных образованиях по Босняку-III и -IV выполнение нефрэктомии обязательно.
- В случае выявления ПКБП и явно злокачественных кистозных образований нефрэктомия обязательна [3, 9].
Характеристика кист по Босняку: I – простая доброкачественная тонкостенная киста без перегородок; II – доброкачественная киста, содержащая несколько тонких перегородок; IIF – кисты содержат множество перегородок с утолщением и кальцификатами; III – кисты с неравномерно утолщенными стенками и перегородками; IV – явно злокачественные кистозные образования [28].
При выявлении даже солитарной кисты, подозрительной в отношении злокачественной трансформации, даже в отсутствие симптоматики у реципиентов почечного трансплантата необходима нефрэктомия. Поэтому рутинное скрининговое обследование больных, находящихся на лечении ГД, обязательно, даже несмотря на отсутствие у них соответствующей симптоматики [29]. По нашему мнению, скрининговую оценку кистозных образований нужно применять всем больным, получающим длительное лечение заместительной почечной терапией как ГД, так и перитонеальным диализом, особенно пациентам, находящимся в листе ожидания на трансплантацию почки. При подозрении на опухолевое поражение трансплантата необходимо выполнение УЗИ и КТ как пересаженной, так и собственных почек.
Безусловно у всех больных после трансплантации почки должна быть онкологическая настороженность. Поэтому перед трансплантацией больной должен быть максимально «чист» в отношении не только возможных инфекционных очагов, но и возможных мест опухолевого поражения. В связи с этим в вопросе профилактической билатеральной нефрэктомии у больных ПКБП необходима дискуссия [30]. Возможно, ее следует выполнять преимущественно больным, находящимся в листе ожидания трансплантата, т.к. после трансплантации риск озлокачествления кист достаточно велик. Особенно это касается больных кистозным перерождением собственных почек, а именно ПКБП. В настоящее время не существует никаких отработанных и утвержденных рекомендаций на этот счет. Это направление требует дальнейших исследований и обобщения данных на достаточно репрезентативном материале.



