Введение
У больных терминальной стадией хронической почечной недостаточности (ТХПН), получающих лечение гемодиализом (ГД), заболеваемость почечно-клеточным раком (ПКР) в 10 раз выше, чем в общей популяции [1]. Это обусловливает необходимость выявления предикторов ПКР, выделение групп высокого риска и проведение скрининга. Особенно это важно для пациентов, которым планируется трансплантация почки, т.к. раннее выявление опухоли в большинстве случаев обусловливает благоприятный онкологический прогноз и возможность проведения пересадки почки без задержек [1, 2].
Мужской пол, возраст, африканское происхождение, множественные кисты почек, ТХПН в исходе хронического гломерулонефрита, длительный период ГД увеличивают риск развития ПКР [1–3]. E.A. Engels ei al. сообщают, что заболеваемость ПКР может быть бимодальной, достигнув пика в первый год после начала диализа и затем снова через 4 года [3].
В отношении скрининга на сегодняшний день нет однозначного мнения. После 3 лет диализа у большинства пациентов развиваются приобретенные множественные кисты почек, часто ассоциированные с ПКР, после 10 лет – кисты почек обнаруживаются у 80% больных [1, 4]. Поскольку развитие приобретенных кист почек соответствует продолжительности диализа, некоторые авторы высказались за рутинный скрининг ПКР у пациентов, находящихся на диализе более 3 лет [1]. Однако относительно низкая частота ПКР в сочетании с высокой общей смертностью пациентов с ТХПН и необходимостью проведения компьютерной (КТ) или магнитно-резонансной томографии (МРТ) для эффективного скрининга побудили других предположить, что рутинный скрининг положительным образом не повлияет на смертность и не является экономически эффективным [4]. Анализ проблемы показал, что скрининг может приводить к увеличению ожидаемой продолжительности жизни на 1,6 года в течение 25-летнего периода при условии, что он проводится только молодым пациентам с ожидаемым длительным сроком жизни [1].
Пациенты с ТХПН всегда представляли собой сложную категорию больных для хирургического лечения. К особенностям оперативного лечения пациентов с ТХПН относится повышенный риск кровотечения ввиду таких факторов, как артериальная гипертензия, проведение ГД с гепарином [5]. В основе повышенной кровоточивости во время и после операции лежат морфологические изменения эндотелия сосудов, анемия, тромбоцитопения, нарушение адгезии и агрегации тромбоцитов, снижение скорости выработки тромбина и фибринолиз [6]. Еще важно и то, что при ТХПН зачастую имеется метаболический ацидоз. Риск усугубления гиперкапнии и ацидоза за счет снижения функциональной емкости легких на фоне карбоксиперитонеума ограничивает широкое использование лапароскопической НЭ пациентами, получающими лечение ГД [7].
Другой проблемой является пересадка почки пациентам, которые перенесли НЭ по поводу ПКР. Несмотря на то что многие авторы утверждают об отсутствии риска прогрессирования рака почки с благоприятным прогнозом после трансплантации и об отсутствии необходимости в дополнительном сроке наблюдения перед пересадкой, в ведущих центрах трансплантации в РФ до настоящего время рекомендуется срок наблюдения не менее 2 лет после НЭ по поводу рака [8–10].
Цель исследования: в попытке лучше разобраться в очерченных проблемах мы провели ретроспективный анализ собственного опыта лечения больных этой категории.
Материал и методы
В исследование были включены 26 пациентов с ПКР, находившихся на лечении ГД, которым выполнена НЭ в ГБУЗ ГКБ № 52 ДЗМ за период с 2010 по 2020 г.
С целью выявления факторов риска ПКР у пациентов с ТХПН проведено сравнение двух групп больных. Первую группу составили 26 больных ПКР, во вторую группу были случайным образом отобраны 100 пациентов, проходивших лечение ГД за указанный период. В качестве предикторов ПКР рассматривались следующие факторы: пол, возраст, продолжительность диализа, множественные кисты почек, заболевание, приведшее к ТХПН. За множественные кисты принимали кисты, расположенные в обеих почках, в количестве более 5.
Подавляющему большинству (n=21, 80,8%) пациентов выполнена лапароскопическая НЭ, при этом в 5 случаях – билатеральная. Показанием к билатеральной НЭ были у 1 пациентки синхронный рак, в 2 случаях – осложненные кисты поликистозных почек и в 2 – наличие кист по Bosniak III. Прогноз после НЭ определяли по стадии TNM, номограммы UICC и балльной оценке Лейбовича. Благоприятным прогнозом считали первую стадию заболевания по классификации TNM, вероятность 5-летней выживаемости, по данным UICC, не менее 91,1% и низкий риск метастазирования по шкале Лейбовича (не более 2 баллов).
Для статистической обработки данных использовали программу SPSS 26-й версии (IBM, USA). Оценку факторов риска ПКР проводили с помощью бинарного логистического регресса с исключением факторов по Вальду. Для оценки зависимости выживаемости пациентов от времени наблюдения использовали метод Каплана–Мейера.
Результаты
Среди пациентов с ТХПН и ПКР в значительной степени преобладали мужчины (n=23, 88,5%), медиана возраста составила 61 (Q1–Q3: 52–67) год. Медиана продолжительности диализа до постановки диагноза ПКР была 10 месяцев (Q1–Q3: 1–36), минимальный период – 1 месяц, максимальный – 228.
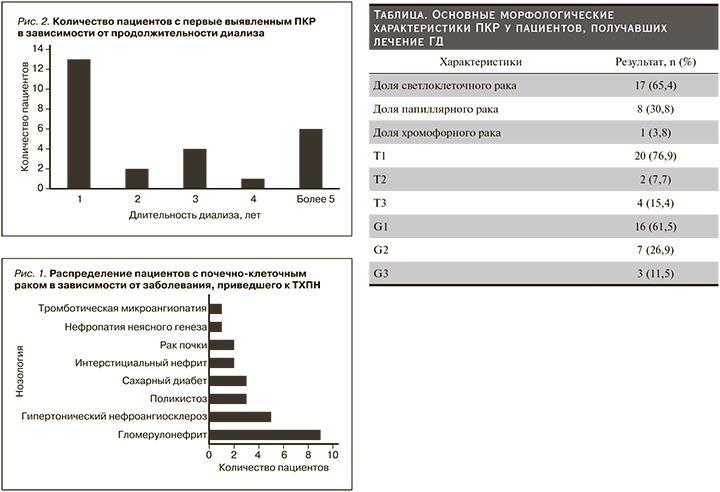
Заболевания, приведшие к ТХПН, представлены на рис. 1. Наиболее частыми нозологиями были хронический гломерулонефрит, гипертонический нефроангиосклероз. Эти заболевания наблюдались более чем у 50% респондентов.
Мы отметили бимодальный пик выявления ПКР у пациентов на ГД в первый год и спустя 5 лет (рис. 2).
В соответствии с коэффициентами бинарного логистического регресса установлено, что шансы развития ПКР у пациентов, получающих лечение ГД, увеличивались у мужчин (отношение шансов [OШ]=5,1, 95% доверительный интервал [ДИ]: 1,34– 14,4; р=0,015) и наличие множественных кист почек (ОШ=3,2; 95%ДИ: 1,56–16,43; р=0,008). Возраст, продолжительность диализа, заболевание, приведшее к ТХПН, статистически не влияли на риск развития ПКР.
Бессимптомное течение отмечено у 22 (84,6%) больных. У двух имелась рецидивирующая макрогематурия, у одного тупая боль, в 1 случае пациент поступил в экстренном порядке в связи с разрывом опухоли и забрюшинной гематомой (ПКР диагностирован только при гистологическом исследовании). Диагноз поставлен 21 пациенту на основании ультразвукового исследования (УЗИ) органов брюшной полости, которое проведена в связи с другими причинами, а опухоль почки была случайной находкой. В четырех случаях ПКР выявлен только при гистологическом исследовании (инцидентальный ПКР), средний размер опухоли был 1 см. Три пациента страдали аутосомно-доминантной поликистозной болезнью почек, 1 – множественными приобретенными кистами почек, при этом 3 пациента имели длительный период ГД (7, 11 и 19 лет).
Для уточнения диагноза 16 пациентам выполнена мультиспиральная компьютерная томография (МСКТ) с контрастным усилением, чувствительность метода составила 75%, МРТ проведена 9 больным, чувствительность составила 77,8%. Относительно низкая чувствительность данных методов обусловлена малым размером ПКР у пациентов с поликистозом почек и в одном случае имелась обширная забрюшинная гематома, не позволившая верифицировать опухоль при МСКТ. Медиана размера опухоли составила 3 см (Q1–Q3: 2–4), у подавляющего числа пациентов имелись множественные кисты почек (n=21, 80,8%). В зависимости от гистологического типа, градации по Т (размер опухоли), по Фурман пациенты распределились, как представлено в таблице.
Среднее время односторонней лапароскопической НЭ составило 140±51 минуту, а среднее время стационарного лечения– 7±3 дня. При билатеральной лапароскопической НЭ среднее время было 158±54 минуты, длительность стационарного лечения – 8±2 дня. Практически сопоставимое время операций при односторонней и двусторонней НЭ обусловлено тем, что в первом случае операция выполнялась, как правило, начинающими хирургами, во втором – хирургами с большим опытом лапароскопической хирургии. При проведении люмботомии время операции было меньше и составило 92±24 минуты, а сроки стационарного лечения незначительно больше – 9±3 дня.
Согласно протоколу нашего учреждения, всем пациентам, находящимся на программном ГД, накануне операции проводился сеанс диализа без использования гепарина. Тем не менее у 5 (19,2%) больных, которым выполнена лапароскопическая НЭ, сразу после операции отмечена гиперкалиемия, потребовавшая проведения ГД. У 1 пациента, оперированного в экстренном порядке через люмботомный доступ, в послеоперационном периоде развилось рецидивирующее кровотечение на фоне системной гипокоагуляции, ему трижды выполнена релюмботомия. Еще у одного пациента в послеоперационном периоде отмечено развитие абсцесса в ложе удаленной почки, которое потребовал чрескожного дренирования. Тромбоз артериовенозной фистулы для ГД развился у двух пациентов, им успешно была проведена реконструкция.
В раннем послеоперационном периоде скончались два пациента, один – в результате тромбоэмболии ветвей легочной артерии, второй – по причине нозокомиальной пневмонии. На основании стадии TNM, номограммы UICC и балльной оценки Лейбовича благоприятный онкологический прогноз отмечен у 17 (65,4%) пациентов. Медиана наблюдения за пациентами после НЭ составила 20 (Q1–Q3: 8,5–45,0) месяцев, минимальный срок – 2, максимальный – 72 месяца. Скончались 3 больных. Среднее время наступления летального исхода после НЭ составило 62,7±4,6 месяца (95% ДИ: 53,5–72,0). Ни в одном из случаев смерть не была связана с прогрессированием рака почки. Один пациент скончался от острого нарушения мозгового кровообращения, второй – от тромбоэмболии ветвей легочной артерии и третий – от острого инфаркта миокарда.
Обсуждение
В нашем исследовании достоверным предиктором развития ПКР были только мужской пол и наличие множественных кист почек. В отличие от других исследований мы не отметили достоверной связи с возрастом, длительностью диализа и заболеванием, приведшим к развитию ТХПН. Более того, у 13 пациентов ПКР диагностирован в течение первого года после начала ГД, что согласуется с результатами E.A. Engels et al. [3]. Мы полагаем, что высокая частота выявления ПКР в течение первого года лечения диализом не обусловлена проведением заместительной почечной терапии, а связана с более тщательным медицинским обследованием пациентов с впервые выявленной ТХПН. Хотя длительность диализа в нашей работе не являлась статистически достоверным фактором риска ПКР с учетом того факта, что три пациента с инцидентальным ПКР много лет находились на лечении диализом, мы окончательно не отрицаем этой взаимосвязи.
Учитывая наши и литературные данные, принимая во внимание высокую частоту ПКР в популяции пациентов с ТХПН, скрининг с использованием УЗИ является наиболее целесообразным для пациентов мужского пола с наличием множественных кист почек начиная с первого года начала диализа. Особое внимание должно быть уделено пациентам, находящимся в листе ожидания трансплантации почки. УЗИ обладает высокой диагностической эффективностью в первичной диагностике опухоли почки у пациентов с ТХПН [11]. Несмотря на то что пациенты после трансплантации почки обладают повышенными рисками развития инфекционных и геморрагических осложнений, мы только в одном случае отметили рецидивирующее кровотечение у пациента с системной гипокоагуляцией и в одном – формирование абсцесса в ложе удаленной почки после лапароскопической НЭ. У 5 пациентов мы столкнулись с гиперкалиемией непосредственно после НЭ, при этом кардиальных осложнений не было. Всем пациентам проведен сеанс ГД без осложнений. О высокой вероятности развития гиперкалиемии у пациентов с ТХПН после операции сообщают и другие авторы [12]. С учетом риска гиперкалиемии необходим интраи послеоперационный мониторинг уровня электролитов крови. Для профилактики тромбоза артериовенозной фистулы целесообразно во время операции стремиться минимизировать периоды гипотонии и соблюдать правильную укладку руки. Два летальных исхода в раннем послеоперационном периоде не были связаны непосредственно с хирургическим вмешательством. В целом на основании наших и литературных данных можно утверждать, что радикальная лапароскопическая НЭ является безопасным вмешательством в отношении пациентов на диализе, обладает удовлетворительными онкологическими результатами [13].
Оценка прогноза после радикальной НЭ – основной критерий определения сроков трансплантации почки. Стадирование по классификации TNM является первым инструментом для прогнозирования [14, 15]. Гистологический тип ПКР также служит важным прогностическим признаком. Светлоклеточный ПКР отличается худшим прогнозом по сравнению с папиллярным раком I типа и хромофобным ПКР [16, 17]. Пятилетняя выживаемость для светлоклеточного рака колеблется от 43 до 83%, для папиллярного рака – от 61 до 90% и для хромофорного рака – от 80 до 100% [18, 19]. Однако в связи с широким диапазоном выживаемости морфологические разновидности не следует учитывать как отдельный прогностический признак. Только наличие рабдоидной или саркоматоидной дифференцировки служит предвестником неблагоприятного прогноза [20]. Степень ядерной атипии по Фурман – еще один признак, который в отличие от морфологического типа доказал свою прогностическую значимость, однако его оценка тесно связана с опытом патологоанатома и не исключает субъективизма. В настоящее время рекомендуется упрощенная система градации по Фурман [21].
Прогностические системы рутинно не используются для оценки прогноза при локализованной форме ПКР, однако возможность измерять результат пациентов с ТХПН может помочь в выборе тактики лечения, в т.ч. в определении сроков трансплантации почки [22]. Для оценки 5-летней выживаемости часто используется номограмма UICC, которая учитывает градацию по Т, степень ядерной атипии и общесоматический статус по ECOG (Eastern Cooperative Oncology Group) [23]. С целью прогнозирования риска метастазирования широко используется балльная оценка Лейбовича, суммирующая данные по параметрам Т, G, N и наличию некроза опухоли [24].
Публикации последних лет указывают на отсутствие прогрессирования ПКР после трансплантации почки без дополнительного периода наблюдения за больными с хорошим прогнозом [8–10]. На основании стадии TNM, номограммы UICC и балльной оценки Лейбовича благоприятный онкологический прогноз отмечен у 17 (65,4%) пациентов, при медиане наблюдения в течение 20 месяцев (Q1–Q3: 8,5–45 минимальный срок 2 месяца, максимальный – 72) не зарегистрировано ни одного случая прогрессирования ПКР. Мы полностью поддерживаем авторов, утверждающих о безопасной с точки зрения прогрессирования ПКР трансплантации почки без периода ожидания после НЭ при условии благоприятного онкологического прогноза, который может быть определен с помощью вышеуказанных инструментов [8–10].
Заключение
Мужской пол, множественные кисты почек служат фактором риска развития ПКР независимо от длительности диализа, однако с увеличением продолжительности заместительной почечной терапии, вероятно, увеличивается доля инцидентального ПКР. Скрининг ПКР при помощи УЗИ почек целесообразен для мужчин с ожидаемой длительной продолжительностью жизни, у которых имеются множественные кисты почек, причем скрининг необходимо начинать с первого года начала диализа.
Лапароскопическая НЭ обладает удовлетворительными онкологическими результатами, а частота развития инфекционно-воспалительных, геморрагических осложнений не велика. Во время и после НЭ показан мониторинг уровня калия крови.
Большинство пациентов с ПКР и ТХПН характеризуются благоприятным онкологическим прогнозом, и у них нет необходимости в сроке наблюдения перед трансплантацией почки.



