Введение
HLA-комплекс обусловливает генетическую предрасположенность к ряду заболеваний или, наоборот, связан с устойчивостью к определенным заболеваниям [1]. Изучение механизмов связи между системой HLA и разнообразной почечной патологией, начатое в области трансплантологии, нашло широкое распространение при многих патологических состояниях, в первую очередь иммуновоспалительной природы [2–4].
Анализ связи наличия определенных лейкоцитарных антигенов у пациентов с диагнозом «терминальная хроническая почечная недостаточность» (ТХПН), проживающих в Казахстане, ранее не проводился.
В последние годы значительно возросло число больных, хроническая почечная недостаточность (ХПН) которых обусловлена артериальной гипертензией, сахарным диабетом. При этом диагностика почечной недостаточности зачастую осуществляется в далеко зашедших стадиях, когда уже необходимо проведение гемодиализа и прогноз больного значительно хуже.
За последние 15–20 лет число больных, получающих заместительную почечную терапию, возросло в 4–5 раз [5]. В ближайшие 10 лет число пациентов, нуждающихся в заместительной почечной терапии, увеличится втрое и составит более 2 млн человек. Это связано с постоянным увеличением численности людей преклонного возраста и широкой доступностью получения в мире гемодиализной терапии.
В возрастной структуре ТХПН в Казахстане преобладают больные от 21 года до 50 лет (73%), 26 (5%) пациентов составляют больные до 20 лет, включая детей, 79 (17%) пациентов – в возрасте 51–60 лет и 28 (6%) – старше 60 лет; 60% больных ТХПН на хроническом гемодиализе (ХГД) составляют пациенты с продолжительностью лечения до 2, 19% – до 4 лет, 15,8% пациентов находятся на хрониодиализе свыше 5 лет и лишь 4,7% – 10 и более лет [6].
Несмотря на усилия, направленные на раннее выявление и профилактику заболеваний почек, частота ХПН увеличивается. По данным литературы, число больных ХПН в странах Европы, США и Японии колеблется от 157 до 443 на 1 млн населения среди больных старше 15 лет [7].
Целью исследования стало изучение распределения генетического полиморфизма антигенов, гистосовместимости пациентов с диагнозом ТХПН и доноров (здоровых лиц) среди населения Республики Казахстан.
Материал и методы
Изучили частоту встречаемости HLA-антигенов I (HLA-A, B) и II классов (HLA-DRB1*) у больных ТХПН, проживающих в Казахстане.
Обследовали 7033 человека: 3646 здоровых доноров крови и 3387 пациентов с диагнозом ТХПН. Среднее значение возраста доноров (контрольная группа) составило 41 год (от 18 до 64 лет), пациентов (группа исследования) – 44 (возраст от 1 до 98 лет). Распределение по половому признаку среди пациентов было следующим: мужчин – 1989 (58,7%), женщин – 1398 (41,2%). Среди доноров преобладали лица мужского пола – 2161 (59%), женщины – 1485 (41%).
Образцы крови доноров и пациентов по HLA-A, B-, DRB1 локусам определяли молекулярно-генетическим методом на наборах Рrotrans (Рrotrans, Германия).
Результаты оценили с использованием дескриптивных статистик непараметрического χ2-критерия, отношения шансов (ОШ) и 95% доверительного интервала (95% ДИ).
Результаты исследования показаны в табл. 1–3.
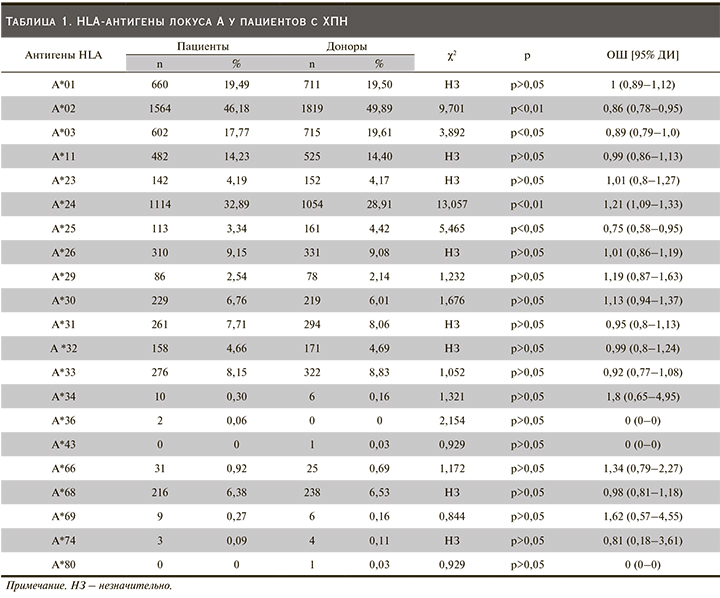
По результатам исследования установлено достоверное увеличение встречаемости в группе пациентов антигена HLA-A*24 (OR=13,057, CI: 1,09–1,33; p˂0,01), что позволяет констатировать ассоциацию ХПН с данным антигеном. В контрольной группе было отмечено HLA-A*02 (OR=9,701, CI: 0,78–0,95; p<0,01), *03 (OR=3,892, CI: 0,79–1,0; p<0,05), *25 (OR=5,465, CI: 0,58–0,95%; p<0,05), что позволяет предположить наличие их протективного эффекта в отношении развития ХМЛ. Также следует отметить, что в ходе нашего исследования не был обнаружен антиген А*36, *43, *80 (p>0,05).
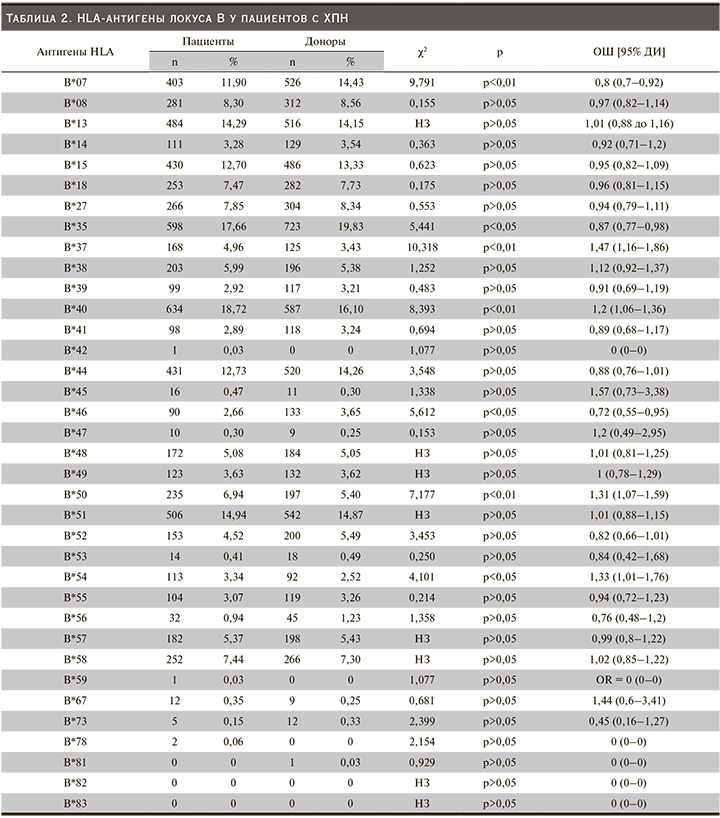
При анализе распределения HLA-антигенов в группе пациентов с ХПН были отмечены антигены HLA-B*37 (OR=10,318, CI: 1,16–1,86; p˂0,01), *40 (OR=8,393, CI: 1,06–1,36; p<0,01), *50 (OR=7,177, CI: 1,07–1,59; p<0,01), *54 (OR=4,101, CI; 1,01–1,76; p<0,05), что позволяет предположить наличие ассоциации ХПН с данными антигенами системы HLA. В контрольной группе не было обнаружено увеличение частоты встречаемости антигенов по системе HLA, что, возможно, является нашей популяционной особенностью.
В ходе нашего исследования не был обнаружен ряд антигенов: HLA-B*42, *78, *81, *82, *83.
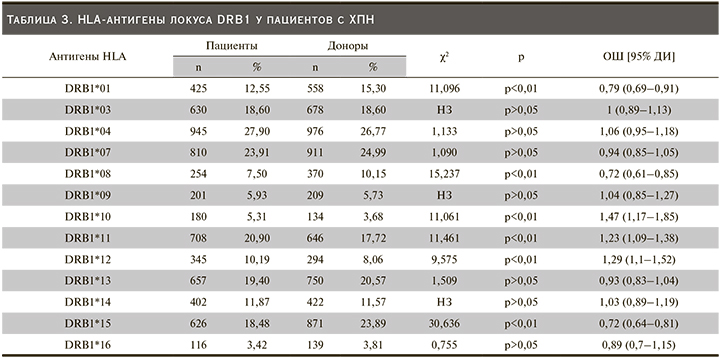
По DRB1-локусу у пациентов чаще встречались антигены HLA-DRB1*10 (OR=11,061, CI: 1,17–1,85; p˂0,01), *11 (OR=11,461, CI: 1,09–1,38; p˂0,01), *12 (OR=9,575, CI: 1,1–1,52; p˂0,01), у здоровых лиц преобладали HLA-DRB1*01 (OR=11,096, CI; 0,69–0,91; p˂0,01), *08 (OR=15,237, CI: 0,61–0,85; p˂0,01), *15 (OR=30,636, CI 0,64–0,81; p˂0,01), что позволяет предположить наличие их протективного действия в отношении развития ХПН.
Обсуждение
Увеличение частоты встречаемости антигена HLA-A*24 позволяет констатировать ассоциацию ХПН с данным антигеном.
В аналогичных зарубежных публикациях имеется подтверждение наших выводов о предрасполагающей роли в развитии почечной патологии, приводящей к ХПН [8].
В контрольной группе обнаружено увеличение частоты встречаемости антигенов HLA-A*02, *03, *25. Указанные антигены можно рассматривать как имеющие протективные свойства в развитии почечной патологии, приводящей к ХПН. По данным Российской Федерации, имеется противоположная закономерность по отношению HLA-A*02, *03 [9].
Учеными ряда стран, таких как РФ и Украина, HLA-A*11, *28 выявлены как предрасполагающие к развитию ТХПН [8–11]. Исследователи из Кувейта отметили протективную роль HLA-A*28 [12], однако в нашем исследовании не были обнаружены антигены данного локуса А*36, *43, *80.
Увеличение частоты встречаемости антигенов HLA-B*37, *40, *50, *54 позволяет констатировать ассоциацию ХПН с данными антигенами системы HLA. В зарубежных публикациях найдены данные, подтверждающие наши результаты [8].
N.M. Hamdi et al. продемонстрировали противоположную закономерность по отношению HLA-B*50, определив данный ген с негативной ассоциацией ТХПН. Исследователи в ходе анализа отметили, что HLA-B*15-ген обладает предрасполагающим эффектом к развитию ТХПН в Саудовской Аравии [13]. К такому же выводу пришли и группа A. Cegielska в Польше, где данный ген также был отмечен как обладающий предрасполагающим к ХПН эффектом [14]. Также зарубежные исследователи выделяют ген HLA-B*08 как предрасполагающий к развитию ТХПН.
Мы не выявили различия частоты встречаемости данного гена у пациентов и здоровых лиц, что, возможно, является нашей популяционной особенностью [5, 18]. Присутствие антигенов HLA-B*07, *35, *46 чаще наблюдалось в контрольной группе, что позволяет предположить их протективное действие в отношении развития почечной патологии.
По литературным данным, HLA-B*07, *35, *52 – ген в ряде генов, обладающий защитным эффектом, что подтверждают и наши данные [15–17], однако группа исследователей из России чаще выявляли ген HLA-B*35 в группе пациентов с ХПН [14]. Также в исследовании было установлено, что ряд антигенов не был обнаружен: HLA-B*42, *78, *81, *82, *83.
По DRB1-локусу у пациентов чаще встречались антигены HLA-DRB1*10, *11, *12, у здоровых лиц преобладали HLA-DRB1*01, *08, *15, что позволяет предположить наличие их протективного действия в отношении развития ХПН. К аналогичному выводу пришли C.S. Dai et al. при исследовании популяции Тайваня предположившие, что HLA-DRB1*11 связан с предрасположенностью к развитию ТХПН [16]. Среди популяции Кувейта данный ген преобладал среди здорового населения [5]. В публикациях исследователей из Марокко и Йемена по HLA-антигенам II класса также указано, что HLA-DRB*08, *15-гены обладают протективным действием [11, 12], что подтверждают наши результаты. Исследователи из Китая, Польши определяют ген HLA-DRB*15 как обладающий предрасполагающей ролью в развитии почечной патологии [9, 13].
Заключение
Проведенный анализ выявил характерный профиль распределения специфичностей системы HLA у пациентов с почечной недостаточностью в казахстанской популяции. Результаты нашего исследования показали, что для больных ХПН – представителей казахской этнической группы характерно определенное распределение антигенов. Изучение распределения антигенов системы HLA у пациентов с ХПН позволило предположить существование ассоциативных связей между наличием в фенотипе пациентов HLA-A*24; B*37, *40, *50, *54; DRB1 *10, *11, *12 и развитием почечной патологии. Также установлена предположительно протективная роль в отношении почечной патологии ряда антигенов HLA-A*02, *03, *25; B*07, *35, *46; DRB1*01, *08, *15.
В перспективе полученные данные могут быть использованы для ранней диагностики и профилактики почечных заболеваний.



