Введение
Определение прогноза сердечно-сосудистых и церебральных заболеваний при хронической болезни почек (ХБП) является сложной, но необходимой задачей, решение которой формирует стратегию терапии лиц с высоким риском развития ренальной дисфункции [1, 2]. Еще в 2009 г. было высказано мнение, что пациенты с увеличенной концентрацией цистатина С плазмы крови относятся к категории лиц повышенного сердечно-сосудистого риска [3]. Стратификация нефро-и кардиоцеребрального риска при ХБП на преддиализной стадии заболевания включает комплексную оценку клинических симптомов, инструментальных и лабораторных изменений [4, 5]. Известно, что многие годы ХБП протекает в тени социально значимых заболеваний, таких как гипертоническая болезнь (ГБ), ожирение, сахарный диабет 2 типа (СД2), ишемическая болезнь сердца (ИБС), хроническое обструктивное заболевание легких (ХОБЛ), цереброваскулярные заболевания (ЦВЗ) и др. [1, 5]. Ранняя диагностика субклинической стадии ХБП сокращает расходы на меры по проведению нефропротективной терапии и уменьшению сердечно-сосудистого риска, обусловленного почечной дисфункцией [6, 7]. В этом направлении особый интерес у исследователей и клиницистов вызывает изучение роли ингибитора цистеиновых протеаз – цистатина С. Это обусловлено тем, что исследование содержания цистатина С плазмы крови имеет двоякое значение. Во-первых, цистатин С является более чувствительным, чем креатинин, маркером дисфункции почек, что позволяет определять нарушение азотовыделительной функции почек на самых ранних этапах ее развития. Дело в том, что цистатин С содержится в плазме крови, а его выведение из организма осуществляют почки [8]. Кроме того, цистатин С постоянно синтезируется с определенной скоростью всеми ядросодержащими клетками, свободно проходит через клубочковую мембрану, полностью расщепляется проксимальными канальцами нефрона и в отличие от креатинина не секретируется в тубулярных пространствах [9]. Отмеченные свойства цистатина С позволили предположить, что его содержание в плазме крови может быть маркером суммарной азотовыделительной функции почек, т.е. скорости клубочковой фильтрации (СКФ) [10, 11]. К тому же даже однократное определение уровня цистатина С в плазме крови позволяет вычислить СКФ [12, 13]. Примечателен тот факт, что концентрация цистатина С в крови в отличие от креатинина одинакова для мужчин, женщин и детей и не зависит от пола, возраста, мышечной массы, этнической принадлежности, особенностей питания, физической активности [13, 14]. Вместе с тем показано, что цистатин С не проходит через плаценту и возможно его внутриутробное и неонатальное измерение [15, 16]. Многочисленные исследования позволили сделать вывод о том, что чем тяжелее почечная патология, тем хуже цистатин С проходит через почки и тем выше его уровень в крови [17, 18–23]. В проведенных исследованиях было предположено, что уровень цистатина С плазмы крови существенно возрастает уже на ранних стадиях нарушения функции почек. Так, функция почек может оказаться сниженной более чем на 50% к тому моменту, когда уровень креатинина плазмы крови только превысит верхнюю границу нормы [10]. Таким образом, цистатин С является более чувствительным показателем снижения почечной функции, чем креатинин, и служит достоверным маркером для раннего выявления субклинической почечной недостаточности, даже при нормальном уровне креатинина. По мнению отдельных исследователей, СКФ по цистатину С целесообразно определять, когда имеются сомнения в наличии у пациента ХБП, например СКФ составляет от 45 до 59 мл/мин/1,73 м2 и нет других признаков повреждения почек [24].
Вторым аргументом для повсеместного использования цистатина С плазмы крови является его предикторное свойство, т.е. более высокие уровни цистатина С при ХБП ассоциируются с ростом частоты сердечно-сосудистых заболеваний и смертности [25, 26]. Поэтому исследования по изучению возможности использования цистатина, одного из почечных биомаркеров, в качестве средства для оценки сердечно-сосудистых нарушений получили в последнее время широкое распространение [20, 21–23, 27, 28–30].
Цель исследования: анализ и взаимосвязь содержания цистатина С плазмы крови с аугментационным индексом и центральным артериальным давлением (ЦАД) у лиц терапевтического профиля.
Материал и методы
Работа выполнена на кафедрах факультетской терапии им. М.Е. Вольского – М.М. Миррахимова КГМА им. И.К. Ахунбаева и терапии № 2 КРСУ им. Б.Н. Ельцина (Бишкек).
В исследование были включены 645 пациентов терапевтического профиля в возрасте старше 16 лет, из них мужчин – 294 (45,6%), женщин – 351 (54,4%). Средний возраст обследованных лиц составил 50,5±11,1 года. Исследование было одобрено Комитетом по вопросам этики КГМА им. И.К. Ахунбаева.
Дизайн исследования. Одномоментное эпидемиологическое исследование – случай–контроль. В зависимости от содержания цистатина С плазмы крови все обследованные лица были подразделены на две группы. В 1-ю группу (n=298) вошли пациенты с уровнем цистатина С˂1,0 мг/л, во 2-ю (n=347) – со значениями цистатина С≥1,0 мг/л. Всем пациентам проводили физикальное обследование, оценку общего состояния, клиническое измерение артериального давления (АД) на обеих руках в положении пациента сидя по методу Короткова, антропометрию с определением индекса массы тела (ИМТ), выполнялся также подсчет числа сердечных сокращений (ЧСС). ИМТ рассчитывался по формуле: ИМТ=масса тела (кг)/рост² (м²). У 523 (81,0%) пациентов было выполнено исследование липидного спектра плазмы крови: общий холестерин (ХС), ХС липопротеидов высокой плотности (ЛПВП), ХС липопротеидов низкой плотности (ЛПНП) и триглицериды (ТГ)]. Кроме того, у всех лиц исследовали уровень мочевой кислоты и кальция плазмы крови. Оценку содержания липидов и липопротеидов плазмы крови проводили в соответствии с критериями Европейского общества кардиологов и Европейского общества атеросклероза по диагностике и лечению дислипидемий [31], согласно которым повышенными уровнями общего ХС (гиперхолестеринемия) и ТГ (гипертриглицеридемия) считаются их содержание ≥5,0 и ≥1,7 ммоль/л соответственно.
С учетом общепринятых рекомендаций диагностировали также ожирение [32] и гиперурикемию [33].
Дополнительно у всех пациентов исследовали концентрацию цистатина С в плазме крови иммунотурбидиметрическим методом усиленными латексными частицами. Референсными нормальными значениями цистатина С плазмы крови считали его уровни в пределах 0,40–0,99 мг/л. Функциональное состояние почек определяли на основании СКФ, рассчитанной по формуле F.J. Hoek et al.: СКФ=(80,35/цистатин С)-4,32 [34].
Клинические диагнозы ГБ, СД2, ИБС, ЦВЗ, ХОБЛ, хронический гломерулонефрит (ХГН) и хронический пиелонефрит (ХПН) подтверждались представленной медицинской документацией.
Исследования ЦАД и аугментационного индекса (АИ) проводили на аппарате «АнгиоСкан-01» (ООО «АнгиоСкан-Электроникс», Россия) в соответствии с требованиями по подготовке испытуемого и процедуре проведения тестов [35].
Контурный анализ пульсовой волны проводился в затемненной комнате после 15-минутного отдыха пациента, в утренние часы, натощак, в удобном сидячем положении с неподвижными кистями с фотоплетизмографическими датчиками на концевых фалангах указательных пальцев. За 24 часа до исследования исключались физические нагрузки и курение, прием кофеина, алкоголя и других стимуляторов. АИ рассчитывался как разница между вторым и первым систолическими пиками давления пульсовой волны, выраженная в процентах от пульсового давления.
Значения АИ выражали в процентах и вычисляли по формуле: АИ=100%×(D[T2]– D[T1])/D[Tmax], где D [Tn] – значение данных в момент n. Статистический анализ полученных данных осуществлялся при помощи программного пакета «Statistica 10,0». Все количественные переменные представлены в виде среднее±стандартное отклонение, медианы и квартилей [Ме (Q25; Q75)]. Значимость различий между группами оценивалась с помощью t-критерия Стьюдента (для переменных с нормальным распределением) и теста Манна–Уитни (для переменных с непараметрическим распределением) [36].
Корреляционный анализ проводился по критерию Пирсона (для переменных с нормальным распределением) и коэффициенту Спирмена (для переменных с непараметрическим распределением). Для всех видов анализа статистически значимыми считались значения p<0,05.
Результаты исследования
Нозологическая характеристика включенных в исследование лиц представлена в табл. 1.

Как показали результаты исследования, среди обследованных пациентов превалировали лица с ГБ (27,2%) и ожирением (37,6%). Доли пациентов с коморбидной патологией ИБС были равнозначными, 17,8 и 17,4% соответственно (табл. 1). Целесообразно отметить, что в нашем исследовании принимали участие пациенты с ХОБЛ (3,2%), подагрой (3,4%), бронхиальной астмой – БА (4,6%), полиморбидными заболеваниями (5,7%), ЦВЗ (7,4%), СД2 (9,7%), ХГН (12,4%) и пиелонефритом (14,8%). Среди лиц с нарушениями жирового обмена преобладали пациенты с ожирением I степени (48,1%), у двоих обследованных пациентов отмечалась тяжелая (IV) степень ожирения. Лабораторная часть данной работы, отраженная в табл. 1, показывает, что наличие гиперхолестеринемии регистрировалось у 39,7%, гипертриглицеридемии – у 28,8%, гиперурикемии – у 35% участников исследования. Большинство (61,5%) обследованных лиц имели высокие уровни цистатина С плазмы крови, следовательно, снижение расчетной СКФ≤60 мл/мин отмечалось в 35% случаев.
На следующем этапе была проведена сравнительная оценка клинико-лабораторных параметров обследованных пациентов, результаты которой отражены в табл. 2.
При этом оказалось, что во 2-й группе, т.е. среди лиц с повышенным уровнем цистатина С плазмы крови, такие показатели, как средний возраст обследованных пациентов (54,5±14,8 года против 44,1±13,4; р<0,05), ИМТ (27,9±5,5 против 26,5±5,2 кг/м2; р<0,05), величина систолического АД (133±19 против 124±16 мм рт.ст.; р<0,05) и ЦАД (130±21 против 122±17 мм рт.ст.; р<0,05)? были достоверно выше по сравнению с 1-й группой. Как и следовало ожидать, в группе лиц с повышенным уровнем цистатина С плазмы крови средние значения расчетной СКФ (52,2±18,5 против 91,7±13,4 мл/мин; р<0,05) оказались достоверно ниже (табл. 2). Одновременно в той же группе прослеживалfсь тенденция к увеличению степени АИ: 12,6 (0,60–22,90) против 10,8 (-3,10–20,40)% (р=0,060). Примечательно, что каких-либо различий по содержанию кальция, общего ХС, ХС ЛПНП, ТГ и мочевой кислоты плазмы крови между сравниваемыми группами получено не было (табл. 2). Концентрация ХС ЛПВП оказалась достоверно ниже в группе лиц с повышенным уровнем цистатина С плазмы крови по сравнению с 1-й группой (1,12±0,29 против 1,18±0,28 ммоль/л; р<0,05 соответственно). Справедливости ради необходимо отметить тот факт, что полученный межквартильный размах по содержанию ТГ плазмы крови между группами не достигал статистически значимого уровня (табл. 2).
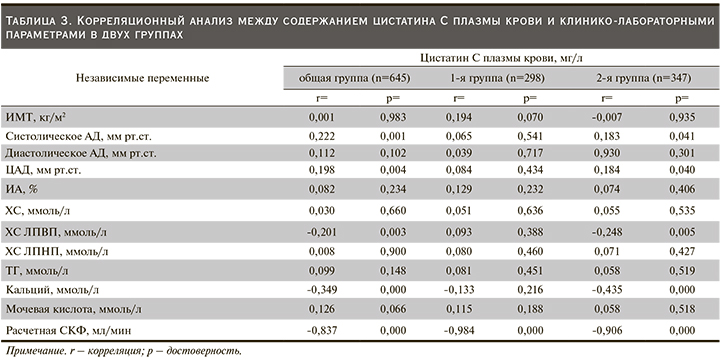
Как следует из табл. 3, оценка корреляционной связи между концентрацией цистатина С плазмы крови и клинико-лабораторными показателями проводилась сначала в общей, затем в каждой группе отдельно. Так, в общей выборке отмечена тесная прямая корреляционная связь уровней систолического АД (r=0,222; р=0,001) и ЦАД (r=0,198; р=0,004) с величиной цистатина С плазмы крови. В то же время связь показателей содержания ХС ЛПВП (r=-0,201; р=0,003), кальция (r=-0,349; р=0,000) и расчетной СКФ (r=-0,837; р=0,000) с уровнем цистатина С плазмы крови была отрицательной. Дальнейший внутригрупповой анализ продемонстрировал, что статистически высокозначимая связь отмечена только между величиной расчетной СКФ и цистатином С плазмы крови (r=-0,984; р=0,000). Сходные корреляционные сдвиги свойственны и лицам 2-й группы, т.е. среди пациентов с повышенным уровнем цистатина С плазмы крови регистрировалась существенная отрицательная связь между расчетной СКФ и цистатином С плазмы крови (r=-0,906; р=0,000). Кроме того, в одноименной группе пациентов положительная корреляционная взаимосвязь цистатина С плазмы крови отмечалась с уровнем систолического АД (r=0,183; р=0,041) и ЦАД (r=0,184; р=0,040) и отрицательная – с величиной ХС ЛПВП (r=-0,248; р=0,005) и содержанием кальция (r=-0,435; р =0,000) (табл. 3).
Обсуждение
У пациентов со стабильной почечной функцией концентрация креатинина в плазме крови обычно постоянная, колеблется в течение суток не более чем на 8% [37, 38]. Креатинин свободно фильтруется в клубочках, не реабсорбируется, но (до 15%) активно секретируется почечными канальцами [39]. При выраженной почечной дисфункции увеличивается экскреция креатинина через желудочно-кишечный тракт [40]. Из-за секреции креатинина почечными канальцами при оценке СКФ по клиренсу креатинина зачастую значение СКФ превышает истинное. Здесь уместно будет отметить, что для сывороточного креатинина свойственна более высокая вариабельность (75%), чем для цистатина С плазмы крови (7%) [41], хотя известны и факты о том, что содержание цистатина С в плазме крови повышается при лечении глюкокортикоидами (в больших дозах) [42], ВИЧ-инфекции [43] и опухолях [44, 45]. В наше исследование не были включены пациенты с иммунодефицитами и онкологическими заболеваниями, а также находящиеся на режиме интенсивной глюкокортикоидной терапии. Зато в нем, как указано в табл. 1, принимали участие пациенты с БА. Как подробно описано в работе В.Н. Минеева и соавт. [46, 47], БА и почечная дисфункция имеют единые патогенетические механизмы развития. В ранее проведенных исследованиях также показано, что при БА повышение экспрессии фактора некроза опухоли α способствует ремоделированию бронхов, с одной стороны [48], и формированию ХБП, с другой [49]. Кроме того, следует добавить, что высокие уровни цистатина С плазмы крови указывают на системное воспаление, которое играет важную роль и в прогрессировании ХОБЛ [50]. Так, Е.В. Болотова и соавт. (2017), изучив данные 226 пациентов с ХОБЛ с целью оценки функционального состояния почек, установили, что расчет СКФ на основе сывороточного цистатина С предпочтителен для больных ХОБЛ, т.к. уровень цистатина С не зависит от состояния мышечной ткани и антропометрических показателей [51]. Среди обследованных нами пациентов лица с БА и ХОБЛ составили не более 8% (табл. 1).
В то же время сравнительная доля пациентов с ГБ в нашем исследовании оказалась довольно многочисленной (27,2%). Что касается связи между АД и цистатином С плазмы крови, то ее наличие продемонстрировано в ряде исследований. Так, изучение взаимосвязи цистатина С плазмы крови у лиц ГБ группы среднего и высокого риска развития сердечно-сосудистых осложнений продемонстрировано в работе Е.В. Ощепковой и соавт. (2014). Так, авторы сделали вывод, согласно которому связь между цистатином С, с одной стороны, и 24-часовым диастолическим АД, доклиническим поражением сердца, сосудов и почек, с другой, по-видимому, может свидетельствовать в пользу существования концепции кардиоренального синдрома у больных ГБ уже на ранних стадиях [27]. Данная мысль подтверждается и нами, т.е. в группе пациентов с повышенным уровнем цистатина С плазмы крови регистрируется увеличение уровня как систолического, так и диастолического АД (табл. 2). Более того, в той же группе (табл. 3) и общей выборке нами была установлена прямая связь между содержанием цистатина С плазмы крови и значениями АД, чего не отмечалось в группе пациентов с нормальным содержанием цистатина С плазмы крови. Сходные данные были получены и в исследовании С.Г. Шулькиной и соавт. (2017), где выявлена тесная связь между уровнем цистатина С плазмы крови и величиной АД у пациентов с АГ. Одновременно авторам удалось продемонстрировать, что у пациентов с АГ расчет СКФ по формуле F.J. Hoek выявляет снижение почечной функции при оптимальном уровне СКФ по формуле CKD-EPI (Chronic kidney disease Epidemiology Collaboration). Кроме того, в этом исследовании установлена ассоциация между уровнем сывороточного цистатина С и степенью ожирения [52]. В то же время нами не было выявлено какой-либо взаимосвязи уровня цистатина С плазмы крови с ИМТ (табл. 3). Однако было высказано предположение о том, что использование цистатина С вполне допустимо для улучшения стратификации сердечно-сосудистого риска.
Создается впечатление, будто сегодня цистатин С уже рассматривается как маркер сердечно-сосудистого риска [3, 53], поскольку высокая концентрация цистатина С в крови постоянно и сильно ассоциируется с сердечно-сосудистыми проявлениями в различных клинических ситуациях [54, 55]. Так, Т.Е. Кузнецова и соавт. (2014) недавно исследовали уровень цистатина С плазмы крови у 110 пациентов, страдающих хронической сердечной недостаточностью (ХСН) [56]. Показано, что у пациентов по мере утяжеления функционального класса ХСН уровень цистатина С плазмы крови имеет тенденцию к увеличению. Наряду с этими данными авторы также сообщают, что показатель цистатина С может рассматриваться как более чувствительный маркер для диагностики ранних стадий ХБП у больных ХСН в реальной клинической практике. Повышенные концентрации цистатина С сигнализируют о ранних нарушениях азотовыделительной функции почек [57], что нашло потдверждение и в нашем исследовании (табл. 2, 3). В большинстве опубликованных исследований внимание сосредоточено на оценке клинической и прогностической роли цистатина С плазмы крови [17, 22, 23]. В этом отношении определенный интерес вызывают результаты исследования Н.А. Козиоловой и соавт. (2018), где снижение концентрации цистатина С плазмы крови и прирост величины СКФ регистрировались в подгруппе пациентов с ХСН ишемической этиологии+ХБП на фоне 6-месячной терапии триметазидином [58]. В другой работе T. Keller et al. [59] оценили прогностическую роль цистатина С у 1827 пациентов с ИБС и острым коронарным синдромом, но с нормальной или слегка измененной СКФ, которые участвовали в наблюдательном исследовании «Атерогенез» [60]. Среди пациентов, имеющих высокие уровни цистатина С плазмы крови, регистрировался наиболее высокий риск смерти от сердечно-сосудистых заболеваний. Есть основание полагать, что воспаление, сочетающееся с атерогенными изменениями, может быть одним из важных механизмов, связанных с цистатином С и сердечно-сосудистым риском [61, 62].
Однако цистатин С, по некоторым данным, может быть не просто маркером дисфункции почек и сердечно-сосудистого риска, но и предиктором содружественного течения заболеваний. Так, в более ранних исследованиях W. Koenig et al. (2005) отметили, что высокие концентрации цистатина С сочетались с пожилым возрастом, СД, развитием ИБС [63]. В целом число пациентов с наличием ко- и полиморбидными заболеваниями в нашем исследовании составило 152 (23,5%). Из табл. 1 видно, что в исследовании достоверно преобладали лица с ожирением (37,6%), а уровень ИМТ оказался достоверно выше в когорте пациентов с повышенной концентрацией цистатина С плазмы крови (табл. 2). Однако нам не удалось выявить тесной корреляционной связи между цистатином С и ИМТ как в общей, так и в каждой отдельной выборке (табл. 3). Между тем известно, что значительная часть цистатина С синтезируется адипоцитами жировой ткани [64], а наличие ожирения ассоциируется со значительным повышением продукции цистатина С адипоцитами [65]. По данным О.М. Урясьева и соавт. (2016), у лиц с СД2 с ожирением III степени отмечены достоверно более высокие показатели цистатина С по сравнению с пациентами с избыточной массой тела, а суммарная почечная функция, рассчитанная по формулам CKD-EPI-cys, была достоверно ниже в группе больных СД2 с ожирением II и III степеней [66]. В этом исследовании выявлена также положительная корреляционная связь уровня цистатина С с ИМТ (r=0,605; p=0,0001), толщиной интраабдоминального жира (r=0,379; p=0046) и отрицательная – между СКФ и данными показателями (r=-0,524, p=0,035 и r=-0,386, p=0,046 соответственно). Возможности цистатина С диагностировать ХБП при ЦВЗ [67, 68], метаболическом синдроме [69, 70] и СД2 [71] показаны и в работах других авторов. В исследовании D. Krishna et al. (2012), посвященном роли цистатина С в развитии сердечно-сосудистого риска среди лиц с ожирением, отчетливо продемонстрировано, что имеется отрицательная взаимосвязь (r=-0,52) между цистатином С и ХС ЛПВП плазмы крови [72]. Следует подчеркнуть, что отрицательные корреляционные сдвиги, отмеченные и в нашей работе между цистатином С и ХС ЛПВП (табл. 3), были продемонстрированы также в поперечно-срезовых исследованиях [73, 74]. С обсуждаемой точки зрения представляет интерес также взаимосвязь цистатина С плазмы крови с АИ и ЦАД. Ранее нами была установлена самостоятельная роль увеличения ЦАД [75] и скорости распространения пульсовой волны в прогрессировании ХБП и сердечно-сосудистых заболеваний [76]. Так, давлением аугментации принято называть разницу между давлением первого (T1) и второго (T2) систолических пиков пульсовой волны. Именно эта часть пульсового АД существенно возрастает при повышении артериальной жесткости, обусловливая рост ЦАД и повышение постнагрузки на миокард левого желудочка [77, 78]. Из табл. 2 видно, что межгрупповых различий по АИ в обследуемой выборке обнаружено не было. К тому же и не отмечалось корреляции между содержанием цистатина С плазмы крови и величиной АИ. На наш взгляд, это связано с тем, что в исследуемой выборке имела место субклиническая почечная дисфункция (табл. 2).
Тесная ассоциация повышения уровня цистатина С плазмы крови с ухудшением параметров артериальной ригидности среди лиц пожилого возраста была получена в исследовании M. Madero et al. (2009) [79]. В другом одномоментном исследовании установлена связь уровня цистатина С плазмы крови с повышением жесткости артерий среди лиц молодого возраста в отсутствие выраженной дисфункции почек [80]. Сходные результаты отмечены также в работе I.M. Su et al. (2018), где показана независимая ассоциация роста уровня цистатина С плазмы крови с увеличением жесткости артерий при СД2 [81].
Думается, что повышенный уровень цистатина С плазмы крови может служить также предиктором уменьшения массы костной ткани (остеопороз) и появления минерально-костных нарушений при почечной дисфункции, поскольку при проведении корреляционного анализа нами зарегистрирована обратная связь между уровнем цистатина С и содержанием кальция плазмы крови.
Как следует из табл. 3, эта связь присутствовала как в общей (r=-0,349; р=0,000), так и в группе лиц с высоким содержанием цистатина С плазмы крови (r=-0,435; р=0,000). Полученные нами данные вполне согласуются с результатами работ других авторов, где показано, что плазменный уровень цистатина С ассоциируется с тяжестью остеопороза среди лиц женского пола [82]. В ряде исследований также установлено, что имеется связь между риском кальцификации коронарных артерий и цистатином С плазмы крови [83].
Подводя итог, необходимо отметить, что выполненное нами одномоментное исследование раскрывает определенную часть возможной патогенетической и диагностической роли определения цистатина С плазмы крови в развитии нефро- и кардиоцеребрального риска у пациентов терапевтического профиля. Таким образом, повышение концентрации цистатина С плазмы крови сопровождается увеличением уровня систолического и ЦАД с тенденцией прироста АИ, с одной стороны, и снижением содержания ХС ЛПВП и существенным торможением расчетной СКФ, с другой. У пациентов терапевтического профиля показатель цистатина С отрицательно коррелирует с содержанием кальция плазмы крови.



