Микроскопический полиангиит (МПА) является системным заболеванием, поражает многие системы и органы, приобретает жизнеугрожающее течение при поражении легких. Патология легких при МПА диагностируется в 25–70% случаев может проявляться геморрагическим некротизирующим альвеолитом. Клиническая картина заболевания в этом случае характеризуется тяжелой паренхиматозной дыхательной недостаточностью с развитием взаимоотягощающей полиорганной недостаточности [1–3]. Другие варианты поражения легких могут проявляться рентгенологической картиной «матового стекла», неспецифичными инфильтрататами, лимфоаденопатией.
Наиболее тяжелым легочным проявлением МПА является некротизирующий геморрагический альвеолит, который может быть первоначальным проявлением аутоиммунного заболевания и до 45% случаев может осложняться потенциально фатальным диффузным кровотечением, стремительным развитием в течение нескольких минут или часов тяжелого острого респираторного дистресс-синдрома (ОРДС) с зарегистрированной смертностью от 12 до 60% [4]. Повреждение легких при этом носит вторичный характер и обусловлено опосредованными нарушениями микроциркуляции в легочных капиллярах, что препятствует процессам оксигенации и выведения углекислого газа [2, 4–8]. В исходе геморрагического альвеолита возможно формирование диффузного интерстициального фиброза легких, что часто ассоциируется с гиперпродукцией антинейтрофильных цитоплазматических антител (ANCA) к миелопероксидазе (МПО).
Острая дыхательная недостаточность (ОДН) в значительной части случаев представляет реальную угрозу для жизни пациента и требует экстренного применения методов респираторной поддержки. Наиболее часто используется искусственная вентиляция легких (ИВЛ) с высокой концентрацией кислорода в «агрессивных» режимах с высоким уровнем положительного давления конца выдоха, высоким пиковым давлением, инверсией соотношения вдоха и выдоха.
Для коррекции гипоксемии у пациентов с тяжелой ОДН, при которой не удается добиться адекватного газообмена для обеспечения должной доставки кислорода органам и тканям при помощи усовершенствованной механической вентиляции, эффективной респираторной поддержкой является экстракорпоральная мембранная оксигенация (ЭКMO), которая обеспечивает эффективную оксигенацию крови и удаление углекислого газа в течение нескольких недель [9–13].
В течение последних 15 лет в клиническую практику лечения обратимого легочного повреждения активно внедряется современный высокоэффективный метод интенсивной терапии ЭКМО при лечении тяжелой острой респираторной (вено-венозная EКMO) или недостаточности кровообращения (веноартериальная EКMO). При веноартериальном (ВА) варианте ЭКМО пациенту обеспечивается не только респираторная поддержка, но и значительное улучшение основных параметров гемодинамики. Веновенозная (ВВ) ЭКMO представляет собой жизненно важное лечение пациентов с тяжелым ОРДС, резистентным к другим видам респираторной поддержки, при котором механическая вентиляция маловероятна для обеспечения удовлетворительной оксигенации крови с целью предотвращения дальнейшего повреждения жизненно важных органов и фатального прогрессирования заболевания. Согласно базе данных 2000–2012 гг. Организации экстракорпорального жизнеобеспечения (ELSO), общий коэффициент эффективности ЭКМО при ОДН у взрослых составляет 57% [2, 14–16].
Вено-венозный (ВВ) режим ЭКMO при ОДН предпочтителен и обеспечивает значительно более высокую выживаемость по сравнению с веноартериальным (ВА) режимом (частота применения ВВ/ВА – 82 и 23%, коэффициент выживаемости – 60 и 40% соответственно, р<0,001) [17, 18].
ВВ ECMO не обеспечивает лечения острого и тяжелого повреждения легких, но позволяет пациенту пережить критический этап тяжелого ОРДС, поддерживая должный газообмен до тех пор, пока не будет восстановлена функция легких в результате патогенетической терапии основного заболевания. В дополнение к предотвращению смерти от гипоксемии этот метод также может предотвращать дальнейшее прогрессирование повреждения легких из-за механической вентиляции [15, 19–22].
Доказательства необходимости использования ЭКМО пациентами с тяжелой респираторной недостаточностью при геморрагическом альвеолите, ассоциированном с ANCA- васкулитом, ограничиваются небольшим числом клинических наблюдений с учетом тяжести состояния пациентов и смертельным исходом заболевания, наступающим до развития эффекта от патогенетической иммуносупрессивной терапии [2, 7, 23–26].
Мы сообщаем о случае успешной терапии тяжелого полиорганного поражения при ANCA-ассоциированном васкулите комбинацией ЭКМО, патогенетической иммуносупрессивной терапии и заместительной почечной терапии.
Клинический случай
Пациентка Щ. 26 лет, медицинская сестра, 31.05.1917 госпитализирована в больницу скорой медицинской помощи г. Липецка в тяжелом состоянии с жалобами на кровохарканье, чувство нехватки воздуха.
 Считает себя больной с 23.05.2017, когда стала отмечать плохое самочувствие, субфебрилитет, появление герпетических высыпаний на лице. Обратилась к врачу 26.05.2017, были назначены аскорутин, витамины В1 и В6, мирамистин, хлорфилипт, цефтриаксон. С 28.05.2017 стала отмечать появление прожилок крови в мокроте, нарастание одышки и при повторном обращении к врачу была экстренно госпитализирована.
Считает себя больной с 23.05.2017, когда стала отмечать плохое самочувствие, субфебрилитет, появление герпетических высыпаний на лице. Обратилась к врачу 26.05.2017, были назначены аскорутин, витамины В1 и В6, мирамистин, хлорфилипт, цефтриаксон. С 28.05.2017 стала отмечать появление прожилок крови в мокроте, нарастание одышки и при повторном обращении к врачу была экстренно госпитализирована.
В анамнезе повышение артериального давления (АД) до 150/100 мм рт.ст. в течение полутора лет, частые носовые кровотечения. Около года назад впервые выявлено повышение уровней креатинина и мочевины в сыворотке крови. В течение последних 6 месяцев прогрессивно нарастали отеки ног и гиперазотемия, однако о результатах лабораторных исследований сообщить не могла. Принимала эналаприл и индапамид.
При поступлении состояние крайне тяжелое. При аускультации легких констатировано ослабленное везикулярное дыхание с рассеянными сухими и влажными хрипами. При компьютерной томографии (КТ) органов грудной клетки (31.05.2017) выявлены признаки двусторонней полисегментарной пневмонии. В связи с развитием неврологического дефицита консультирована неврологом; констатированы гипоксическая и метаболическая энцефалопатия, отек и дислокация головного мозга, бульбарный паралич, тетраплегия, кома с нарушением витальных функций. В связи с коматозным состоянием и нарастающей ОДН больная переведена на ИВЛ. Назначена антибактериальная (левофлоксацин, меропенем), дезинтоксикационная противовоспалительная гормональная терапия, сурфактант, пентаглобин, низкомолекулярный гепарин.
С учетом тяжести состояния, неэффективности проведения ИВЛ для определения дальнейшей тактики ведения и решения вопроса об использовании метода ЭКМО больная была проконсультирована мобильной бригадой специалистов Центра экстракорпоральной мембранной оксигенации ГКБ 52 ДЗМ г. Москвы.
 Состояние пациентки признано критическим, констатирована крайняя степень ОДН (на фоне искусственной вентиляции легких с FiO2=100%, PaCO2 – 60 мм рт.ст., индекс оксигенации [PaO2/FiO2] менее 50, сатурация по пульсоксиметру – 85%). Была установлена система ВВ ЭКМО с использованием транспортной консоли с помощью бедренно-яремного подключения. 07.06.2017 начата процедура ЭКМО, проведение ИВЛ в режиме BiPAP через трахеостому, позволившие на фоне проводимой интенсивной терапии поддерживать на удовлетворительном уровне параметры газового состава крови, кислотно-основного состояния, показатели гемодинамики при протективных режимах ИВЛ. Пациентка в сопровождении реанимационной бригады и продолжавшейся ЭКМО была эвакуирована санитарной авиацией МЧС в отделение реанимации и интенсивной терапии (ОРИТ) «ГКБ 52 ДЗМ».
Состояние пациентки признано критическим, констатирована крайняя степень ОДН (на фоне искусственной вентиляции легких с FiO2=100%, PaCO2 – 60 мм рт.ст., индекс оксигенации [PaO2/FiO2] менее 50, сатурация по пульсоксиметру – 85%). Была установлена система ВВ ЭКМО с использованием транспортной консоли с помощью бедренно-яремного подключения. 07.06.2017 начата процедура ЭКМО, проведение ИВЛ в режиме BiPAP через трахеостому, позволившие на фоне проводимой интенсивной терапии поддерживать на удовлетворительном уровне параметры газового состава крови, кислотно-основного состояния, показатели гемодинамики при протективных режимах ИВЛ. Пациентка в сопровождении реанимационной бригады и продолжавшейся ЭКМО была эвакуирована санитарной авиацией МЧС в отделение реанимации и интенсивной терапии (ОРИТ) «ГКБ 52 ДЗМ».
При поступлении состояние больной было расценено как крайне тяжелое. По данным КТ органов грудной клетки (по сравнению с 30.05.2017), выявлена отрицательная динамика в виде увеличения инфильтрации легочной ткани с обеих сторон, картина тотального острого альвеолярного повреждения легких (рис. 1). При КТ брюшной полости – умеренно выраженные гепатоспленомегалия и асцит, периренальный отек. При КТ головного мозга – точечные кровоизлияния в правой гемисфере до 6 мм.
По данным лабораторного исследования крови: гемоглобин 96 г/л, тромбоциты 100 тыс., нейтрофильный лейкоцитоз до 91% при лейкоцитозе 17,9×109/л, общий белок 46 г/л, гипоальбуминемия 24 г/л, С-реактивный белок 16 мг/л, уровень лактатдегидрогеназы более 600 ЕД, холестерин 2,2 ммоль/л, креатинин 230 мкмоль/л на фоне постоянной гемодиафильтрации. В общем анализе мочи белок 0,2 г/л, микрогематурия до 300 клеток в мкл. С учетом наличия легочно-почечного синдрома, нарушения функции почек, повышенного АД в анамнезе, поражения сосудов головного мозга и ЛОР-органов заподозрено системное заболевание. При обследовании выявлена гиперпродукция антител к МПО иммуноглобулина G (IgG) – 186 МЕ/л (при верхней границе нормы 20 МЕ/л). По данным исследования жидкости бронхоальвеолярного лаважа: уровень галактоманнана 0,136, пневмоцисты не обнаружены, грамположительные кокки.
Выставлен диагноз: системный ANCA-ассоциированный васкулит, МПА с гиперпродукцией антител к МПО с поражением ЛОР-органов (по анамнезу), легких (двусторонний геморрагический альвеолит, кровохарканье), почек (быстропрогрессирующий гломерулонефрит), центральной нервной системы (цереброваскулит с геморрагическим инсультом в правом полушарии головного мозга и развитием тетрапареза). Кома III cт. ОДН III (ИВЛ с 31.05.2017). ВВЛ в режиме BiPAP и СРАР через трахеостому (c 7.06.2017). ВВ/ ЭКМО (с 07.06.2017). Острое повреждение почек на фоне ХБП. Продленная вено-венозная гемодиафильтрация. Герпетическая вирусная инфекция – реконвалесцент. Анемия тяжелой степени тяжести.
Во время нахождения в ОРИТ проведены следующие мероприятия интенсивной терапии:
Антикоагулянтная терапия: гепарин 25 тыс./сут во время процедуры ЭКМО, далее фрагмин 5000 ЕД/сут.
Энтерально-парентеральное питание: Кабивен и Нутрикомп.
Инфузионно-трансфузионная терапия: коррекция нарушений гемостаза (1 доза тромбоконцентрата, 4 дозы свежезамороженной плазмы [СЗП]), коррекция анемии (эритроцитарная масса 10 доз, препараты железа), коррекция гипоальбуминемии (25%-ный раствор альбумина – 1200 мл суммарно).
Патогенетическая иммуносупрессивная терапия: метилпреднизолон (1 г/сут в течение 3 дней в сочетании с обменным плазмафереза [до и после процедуры плазмофереза 125 и 875 мг соответственно]) первые 3 процедуры, далее 48 мг внутрь. Циклосфосфан (ЦФ) 1,0 г внутривенно (9.06.2017), иммуноглобулины внутривенно 10 г/сут (октагам в течение 10 суток). Сеансы обменного плазмафереза с замещением свежезамороженной плазмой в объеме 3 литра суммарно № 6.
Антибактериальная терапия: Меронем 3 г/сут (с 7.06 по 16.06.2017); Линезолид 1200 мг/сут (с 7.06 по 9.06, отменен в связи с развитием тромбоцитопении и диареи), противовирусная терапия: ацикловир 750 мг/сут (в течение 5 дней); Амикацин 1500 мг/сут ингаляционно; Сульперазон 8 г/сут (с 16.06 по 24.06); Колистин 6 млн/сут ингаляционно (с 16.06 по 4.07); Полимиксин В 150 мг/сут (с 16.06 по 24.06), муколитическая терапия (ингаляции, флуимуцил, Эреспал); противоязвенная (Омез 40 мг/сут) и пробиотическая терапия (Энтерол, L нормобакт).
На фоне проведенной терапии состояние стабилизировалось, почечная недостаточность не прогрессировала, прекращена веновенозная гемофильтрация, проведенная в течение 10 дней; инфекционных осложнений не наблюдалось, маркеры воспаления оставались отрицательными. Параметры газового состава крови, кислотно-основного состояния, показатели гемодинамики стабилизировались, что позволило отрешить пациентку на 17-е сутки от ЭКМО. На 24-е сутки с момента развития тяжелой ОДН деканюлирована трахеостома, пациентка отлучена от кислородной поддержки и переведена на спонтанное дыхание через естественные дыхательные пути.
Однако на следующие сутки рецидив лихорадки до 38°С с лейкоцитозом до 39,0×109/л, расцененные как проявление поздней нозокомиальной пневмонии, в связи с чем продолжена антибактериальная терапия меронемом, колистином, линезолидом, амфолипом, бисептолом. На фоне проводимой терапии температура тела, уровни лейкоцитов и Т-лимфоцитов в крови нормализовались.
Пациентка переведена во 2-е нефрологическое отделение. В отсутствие признаков системного воспаления 05.07.2017 принято решение о повторном введении иммуноглобулина в дозе 0,5 г/кг массы тела и с учетом сроков терапии 800 мг ЦФ (масса тела – 65 кг).
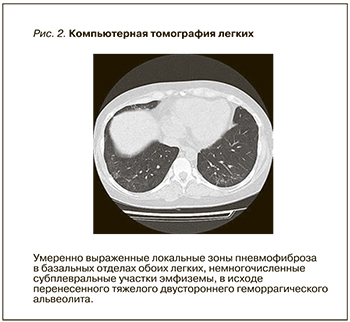
При лабораторном контроле: креатинин сыворотки 202 мкмоль/л, гемоглобин 88 г/л, лейкоциты 8,0×109/л, склонность к тромбоцитозу до 436 тыс., паратиреоидный гормон 160 пг/мл. Суточная протеинурия 1,2 г, микрогематурия до 40 клеток в мкл. При контроле уровня антител к МПО – 10 ЕД/мл (при норме до 20 Ед/мл). По данным КТ легких, отсутствовали свежие очагово-инфильтративные изменения легочной паренхимы, выявлены зоны пневмофиброза в исходе геморрагического альвеолита (рис. 2).
В дальнейшем повторные госпитализации каждые 3 недели в отделение нефрологии для коррекции патогенетической терапии, где проведено пульсовое введение ЦФ на фоне медленного снижения дозы преднизолона и введения человеческого иммуноглобулина. Суммарная кумулятивная доза ЦФ в период индукционной терапии в течение 6 месяцев составила 4,8 г.
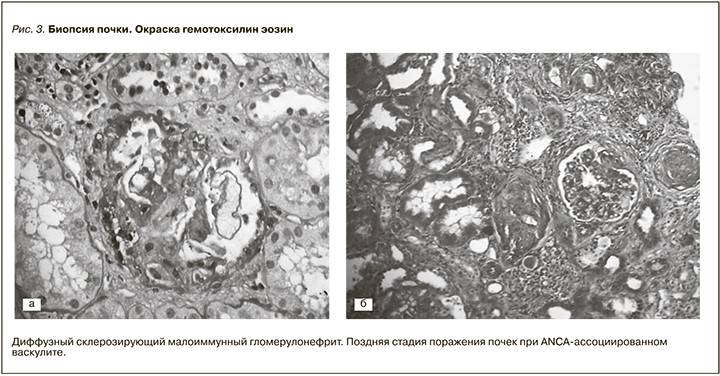
В августе 2017 г. (через 4 месяца от начала индукционной терапии) для определения объема и длительности патогенетической терапии выполнена пункционная биопсия почек. Проведены окраски: гематоксилин-эозин, ШИК-реакция, трихром по Массону. В препарате почечного биоптата получено 14 клубочков, 11 из которых полностью склерозированы. В большинстве из склерозированных клубочков определены фрагменты фиброзных полулуний. В двух клубочках определены крупные участки сегментарного склероза капиллярных петель по типу постнекротического рубцевания с образованием сегментарных фиброзных полулуний. Оставшийся клубочек немного увеличен в размерах, выглядел малоизмененным. Диффузно-очаговый фиброз интерстиция и атрофия канальцев, занимающие около 50% площади почечной паренхимы. Сохранные канальцы гипертрофированы. Диффузно-очаговая неспецифическая интерстициальная инфильтрация мононуклеарами в зонах склероза. Артерии и артериолы без особенностей. Для верификации данного поражения выполнена иммунофлуоресценция (БП 56235–42): IgG, IgM, IgA – негативно; С3 – негативно; С1q – негативно; Каппа, Лямбда, Фибрин – негативно. Заключение: диффузный склерозирующий малоиммунный гломерулонефрит. Данная морфологическая картина наиболее характерна для поздней стадии поражения почек при ANCA-ассоциированном васкулите (рис. 3).
Через 6 месяцев патогенетической иммуносупрессивной терапии, в декабре 2017 г., наступила неожиданная беременность, на 3-й неделе гестации появились кровянистые выделения. С учетом длительной цитостатической терапии, уровня СКФ (35 мл/мин/1,73 м2 по CKD-EPI), усиления артериальной гипертензии принято решение о прерывании беременности вакуум-аспирацией.
В дальнейшем в целях предупреждения рецидивов ANCA васкулита в качестве противорецидивного лечения и минимизации терапии кортикостероидами начато введение моноклональных антител к CD20-антигену лимфоцитов (ритуксимаб) в дозе 500 мг однократно с интервалом 6 месяцев под контролем уровня CD19 с анализом полноты деплеции В лимфоцитов.
Заключение
Таким образом, данное клиническое наблюдение продемонстрировало важность своевременной диагностики такого жизнеугрожающего заболевания, как ANCA-ассоциированный МПА с развитием двустороннего геморрагического альвеолита, осложненного кровохарканьем и тяжелой ОДН, цереброваскулитом с геморрагическим инсультом в правом полушарии головного мозга, тетрапарезом и комой, малоиммунного быстропрогрессирующего гломерулонефрита с острым почечным повреждением.
Васкулит, осложненный диффузным альвеолярным кровоизлиянием, может сопровождаться угрожающей жизни ОДН. Несомненно, что уменьшение действия таких повреждающих факторов, как высокая концентрация кислорода и повышенное давление в дыхательных путях, способствовало обратному развитию патологических процессов в легких при ЭКМО [27, 28]. ЭКМО не является лечением непосредственно патологического процесса, приведшего к ОДН, а представляет собой симптоматическую терапию, обеспечивающую возможность расширить временной интервал для пациентов, в течение которого восстанавливается газообменная функция легких, что позволяет увеличить выживаемость до появления эффекта патогенетической иммуносупрессивной терапии глюкокортикоидами в сочетании с ЦФ, плазменным обменом, введением иммуноглобулина и параллельно продолжающейся заместительной почечной терапии.
В литературе представлено несколько сообщений о случаях применения ЭКMO в отношении пациентов с острой рефрактерной респираторной недостаточностью, связанной с тяжелым легочным кровотечением, вторичным к системным аутоиммунным, включая ANCA-ассоциированный, васкулитам [29–33].
Насколько нам известно, мы представили первый в России случай успешного применения метода ЭКМО в отношении пациентки с МПА и крайне тяжелой формой ОДН на фоне диффузного геморрагического альвеолита в ходе межбольничной авиационной медицинской эвакуации и дальнейшего применения ВВ ЭКМО в течение 17 суток. В представленном наблюдении указанный срок применения ЭКМО оказался достаточным для значительного улучшения респираторной функции легких и получение эффекта патогенетической терапии МПА. С учетом молодого возраста и сохранного репродуктивного потенциала пациентки в качестве последующей поддерживающей патогенетической терапии выбран анти-В-клеточный препарат ритуксимаб, что согласуется с клиническими рекомендациями EULAR/ERA-EDTA и преследует цель предупреждения рецидивов МПА и снижения дозы глюкокортикоидов [34].



