Введение
У пациентов со спондилоартритами (СпА) почечная дисфункция встречается чаще, чем в общей популяции, что определяет актуальность изучения состояния почек у пациентов этой категории. В Российских и Европейских рекомендациях по оценке сердечно-сосудистого риска хроническая болезнь почек (ХБП) рассматривается как независимый предиктор фатальных и нефатальных сердечно-сосудистых событий [1–3]. Более высокий риск возникновения ХБП у этих пациентов обусловлен как длительно персистирующим воспалением, так и, возможно, длительным приемом некоторых лекарственных препаратов. Большое значение придают воздействию нестероидных противовоспалительных средств (НВПС), рекомендованных для лечения СпА в качестве препаратов первой линии. Однако не в полной мере изучено соотношение влияния на состояние почек самих лекарственных препаратов и подавление активности заболевания теми же препаратами. При этом треть пациентов с СпА вынуждены в силу особенностей и тяжести течения заболевания получать комбинированную терапию, включавшую глюкокортикостероиды (ГКС) в различных режимах, особенно в условиях невозможности или отсроченности (по различным причинам) получения пациентами генно-инженерных биологических препаратов (ГИБП). Однако данных об особенностях состояния клубочкового и канальцевого аппаратов почек у пациентов с СпА на фоне различных режимов длительной противовоспалительной терапии недостаточно.
Целью настоящего исследования стало изучение особенностей состояния почек у пациентов с СпА на фоне различных режимов комбинированной длительной противовоспалительной терапии.
Материал и методы
В исследование были включены 200 пациентов с СпА, которым проводилась противовоспалительная терапия в различных режимах. В зависимости от характера лечения пациенты были разделены на подгруппы: 130 пациентов, получавших комбинированную терапию, включившую НВПС и ГКС, и 70 пациентов с СпА, принимавших только НВПС.
Критерии включения в исследование:
- возраст от 18 до 65 лет;
- подписанное информированное согласие больного на участие в исследовании;
- аксиальный СпА, соответствовавший критериям ASAS для аксиального СпА (2009) [4–6];
- периферический СпА, соответствовавший критериям ASAS для периферического СпА (2011) [6–8];
- постоянная доза в течение 4 недель до включения в исследование НВПС;
- постоянная доза в течение 2 месяцев до включения в исследование болезнь-модифицирующих препаратов;
- для пациентов с аксиальным СпА – высокая активность заболевания (индекс BASDAI≥4 и/или индекс DAS4≥3,1), на фоне непереносимости/неэффективности/противопоказаний к 2 и более НВПС [9];
- для пациентов с периферическим СпА – высокая активность СпА на фоне непереносимости/неэффективности приема как минимум двух НВПС и/или одного болезнь-модифицирующего препарата в полной дозе.
Критерии исключения:
- наличие заболеваний, способных вызывать развитие вторичной нефропатии (системная склеродермия, подагра, амилоидоз, множественная миелома и др.);
- наличие заболеваний сердечно-сосудистой системы (за исключением артериальной гипертензии I–II стадий и малых пороков развития в рамках синдрома дисплазии соединительной ткани);
- наличие урологических заболеваний (мочекаменная болезнь, хронический пиелонефрит, аденома предстательной железы, поликистоз почек, аномалии развития и расположения почек, рефлюкс-нефропатии);
- наличие тяжелой артериальной гипертензии (артериальная гипертензия III стадии);
- наличие анамнестических указаний или наличие на момент исследования: ВИЧ, гепатит В, С, сепсис, инфекционный эндокардит, туберкулез;
- наличие иных хронических заболеваний в фазе обострения (язвенная болезнь, холецистит и т.п.);
- наличие сахарного диабета или нарушения толерантности к глюкозе;
- наличие состояний, являющихся противопоказанием к приему ГКС (эрозивные и/или язвенное поражение желудочно-кишечного тракта, неконтролируемая артериальная гипертензия и др.);
- наличие лимфопролиферативных и онкологических заболеваний;
- прием наркотических и ненаркотических аналгетиков.
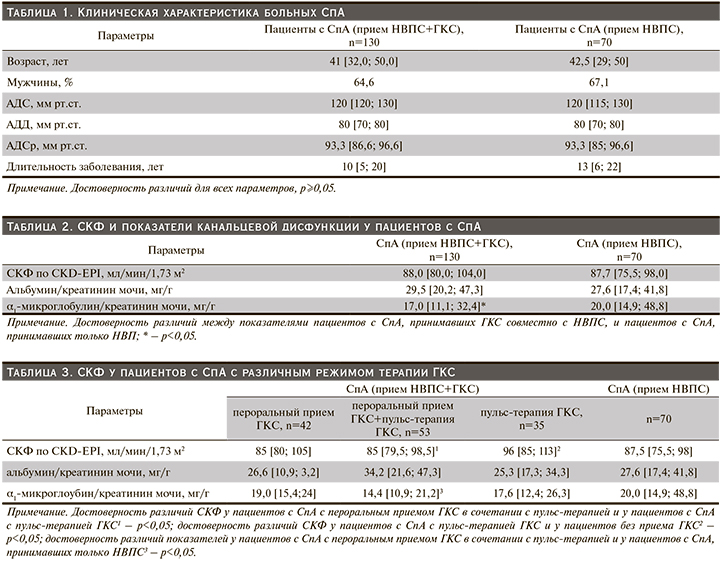
Клиническая характеристика пациентов представлена в табл.1.
Для всех участников исследования определяли уровень креатинина сыворотки крови (мкмоль/л), оценивали клубочковую функцию почек при помощи расчета СКФ по формуле CKD-EPI (мл/мин/1,73 м2), канальцевую дисфункцию оценивали посредством определения экскреции альбумина, α1-микроглобулина с мочой с перерасчетом на 1 г креатинина мочи (Ал/Кр и α1-Мг/Кр, мг/г) [10]. Период наблюдения составил 12 месяцев, по истечении которого была проведена оценка показателей клубочковой и канальцевой дисфункций почек в динамике.
Статистический анализ выполнен с применением пакетов прикладных программ Microsoft Office Excel 2010 (Microsoft Corp., США) и Statistica 8.0 (Stat Soft Ins., США). Для оценки характера распределения данных применяли графический метод, использовали критерии Колмогорова–Смирнова и Шапиро–Уилка. При значениях «p» более 0,05 распределение считалось нормальным. Для описания признаков при нормальном распределении данные представляли в виде M±SD, где M – среднее арифметическое, SD – стандартное отклонение; если распределение было отличным от нормального, результаты представлены в виде Me [Q1; Q3], где Me – медиана, Q1 и Q3 – соответственно первый и третий квартили.
При обработке данных с нормальным типом распределения использовали t-тест для независимых группировок; парный t-тест для сравнения данных пациентов после первоначального и повторного осмотров и исследований. При характере распределения данных, отличных от нормального, использовали непараметрические статистические методы, такие как критерий Манна–Уитни, χ2-критерий. При проведении сравнения более двух независимых групп применяли методы дисперсионного анализа: при нормальном типе распределения данных использовали параметрический дисперсионный анализ; при распределении показателей, отличном от нормального, применяли ранговый анализ вариаций по Краскелу–Уоллису. Различия между показателями групп считали значимыми при значениях p<0,05 [11].
Протокол исследования одобрен этическим комитетом ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России.
Результаты
Длительность приема НВПС составила 1,0 [0,5;1,0] год, ГКС – 0,75 [0,3; 2,0] года.
СКФ более 90 мл/мин/1,73 м2 отмечена у 66 (50,7%) пациентов с СпА, принимавших НВПС и ГКС совместно, у 33 (47,1%) пациентов, принимавших только НВПС (χ2=0,02, p=0,43). Снижение СКФ менее 90 мл/мин/1,73 м2 выявлено у 64 (49,2%) пациентов, принимавших НВПС и ГКС совместно, у 37 (52,8%) пациентов, принимавших только НВПС (χ2=0,01, p=0,44).
У 86,9% пациентов, принимавших только НВПС, выявлены канальцевая дисфункция и повышение экскреции альбумина с мочой, что существенно чаще, чем у пациентов, принимавших НВПС и ГКС (36,2%).
СКФ и показатели канальцевой дисфункции у пациентов с СпА представлены в табл. 2. У пациентов, получавших комбинированную терапию, СКФ была сопоставимой с таковой пациентов, принимавших только НВПС (p≥0,5). Значение α1-Мг/Кр было ниже у пациентов, получавших комбинированную терапию, чем у пациентов, принимавших только НВПС (р=0,02).
Проведен анализ канальцевой дисфункции и экскреции альбумина с мочой у пациентов, получавших комбинированную терапию НВПС и ГКС, и у пациентов, принимавших только НВПС. У пациентов на фоне терапии ГКС мочевая экскреция альбумина более 30 мг/г наблюдалась достоверно реже, чем у пациентов, принимавших только НВПС: 36,2 и 86,9% соответственно (χ2=4,93; p=0,01).
В зависимости от способа (режима) приема ГКС пациенты были разделены на 3 подгруппы: 1-я – пероральный прием ГКС в дозе 5–20 мг/сут, 2-я подгруппа – пероральный прием ГКС в дозе 5–20 мг/сут в сочетании с пульс-терапией ГКС, 3-я – пульс-терапия ГКС. Проведен анализ клубочковой и канальцевой дисфункции у пациентов с СпА. Пациенты были сопоставимыми по полу, возрасту, уровню артериального давления, длительности заболевания. Результаты представлены в табл. 3.
У пациентов с СпА, находившихся на пульс-терапии ГКС, СКФ была больше, чем у пациентов, принимавших ГКС перорально совместно с пульс-терапией (р=0,03). Достоверных различий СКФ у пациентов с различными способами приема ГКС не выявлено (n=130, h=4,68; p=0,096). У пациентов, находившихся на пульс-терапии ГКС, СКФ была выше, чем у пациентов, принимавших только НВПС (р=0,02).
Значимых различий значений маркеров канальцевой дисфункции у пациентов с различным режимом приема ГКС не отмечено (для Ал/Кр n=130, h=1,41; p=0,49; для α1-Мг/Кр n=130, h=2,50; p=0,28). У пациентов на фоне перорального приема ГКС совместно с пульс-терапией ГКС значение α1-Мг/Кр было существенно меньше, чем у пациентов, принимавших только НВПС без ГКС (р=0,01).
В динамике была исследована СКФ у 74 пациентов с СпА, принимавших НВПС и ГКС совместно, и у 34 пациентов, принимавших только НВПС. Через 12 месяцев наблюдения у пациентов, принимавших НВПС и ГКС, СКФ стала выше, чем исходная: 96 [89; 109] и 88 [80; 104] мл/мин соответственно (p=0,04). У пациентов, принимавших только НВПС, СКФ через 12 месяцев наблюдения составила 85,5 [77; 104] мл/мин, исходно – 87,5 [75,5; 98] мл/мин (p≥0,05). Данные о частоте встречаемости различной СКФ у пациентов через 12 месяцев наблюдения представлены в табл. 4.

Через 12 месяцев наблюдения пациентов с нормальной СКФ (более 90 мл/мин/1,73 м2) было больше среди пациентов, принимавших НВПС и ГКС, чем среди пациентов, принимавших только НВПС (52,7 и 38,2% соответственно, χ2 с поправкой Йетса=3,4; p=0,032). Снижение СКФ через 12 месяцев наблюдения чаще выявлялось у пациентов, принимавших только НВПС, чем у пациентов, принимавших НВПС и ГКС (61,7 и 47,3% соответственно, χ2 с поправкой Йетса=3,4; p=0,03).
При динамическом наблюдении пациентов с СпА в течение года значимого изменения (ухудшения) канальцевой дисфункции не выявлено (р≥0,5).
Обсуждение
К наиболее изученным и часто встречающимся формам поражения почек при СпА относятся гломерулонефриты, вторичный АА-амилоидоз, НВПС-нефропатия [12, 13]. В последние годы с учетом данных современных рекомендаций по лечению пациентов с СпА [14, 15], в которых НВПС считаются препаратои выбора за счет способности не только тормозить воспалительный процесс, но и замедлять прогрессирование костной пролиферации при СпА, особое внимание отводится изучению НВПС-нефропатии. Сама НВПС-нефропатия проявляется несколькими клинико-морфологическими вариантами: интерстициальный, тубулоинтерстициальный нефрит, хронический интерстициальный нефрит с папиллярным некрозом, тубулоинтерстициальный нефрит с нефротическим синдромом, иногда с развитием почечной недостаточности, а также гломерулярная патология – мембранозный гломерулонефрит, фокальный гломерулосклероз. Многие исследователи указывают, что развитие данных патологических изменений может происходить как одновременно, так и последовательно у одного и того же пациента. Подтверждением служит обнаружение у одного пациента нарушений, характерных для тубулярного, интерстициального нефритов и гломерулонефритов [16]. Показано, что тяжелая почечная недостаточность возникает редко, чаще НВПС-нефропатия протекает относительно доброкачественно. Есть предположение, что это связано с подавлением посредством НВПС различных медиаторов воспаления, что приводит к некоторому торможению негативных эффектов от воздействия тех же препаратов. Кроме того, около трети пациентов с СпА принимают ГКС в малых дозах, которые, вероятно, за счет своего мощного противовоспалительного действия приводят к «нивелированию» отрицательного воздействия НВПС на почки, что в итоге приводит к более доброкачественному течению НВПС-нефропатии. Необходимо учитывать, что ГКС совместно с НВПС вынуждены принимать пациенты с высокой активностью, в условиях которой риск поражения почек увеличивается, особенно на фоне приема пациентами НВПС. В ходе проведенного нами исследования выявлено, что у пациентов, получавших терапию НВПС, канальцевая дисфункция более выражена, чем у пациентов, получавших НВПС совместно с ГКС, несмотря на более тяжелое течение заболевания у последних. Это может свидетельствовать о роли ГКС в нефропротекции за счет снижения активности воспаления.
В нашем исследовании отмечено, что клубочковая дисфункция у пациентов с СпА исходно уже на фоне различной проводимой длительной противовоспалительной терапии была сопоставимой с таковой у пациентов, принимавших только НВПС, и у пациентов, принимавших НВПС и ГКС, что может свидетельствовать о важности контроля активности заболевания для поддержания нормальной функции почек. Подтверждением может послужить то, что в нашем исследовании СКФ у пациентов, принимавшющих ГКС перорально совместно с пульс-терапией, была меньше, чем у пациентов, получавших только пульс-терапию ГКС. Возможно, это связано с тем, что пациенты с пероральным приемом ГКС совместно с пульс-терапией изначально имеют более тяжелое течение заболевания, и, вероятно, более скомпрометированные почки. В пользу необходимости контроля активности, а вследствие этого и «вторичной» нефропротекции может также свидетельствовать улучшение функции почек через 12 месяцев наблюдения за пациентми, получавшими комбинированную терапию НВПС и ГКС, что отсутствовало у пациентов, получавших только НВПС. Это может косвенно свидетельствовать о том, что ГКС способны уменьшать выраженность почечного повреждения в условиях длительного воспаления.
Таким образом, в ходе выполненного исследования установлено поражение клубочкового и канальцевого аппаратов почек у пациентов с СпА на фоне длительной противовоспалительной терапии, однако их выраженность существенно меньше у пациентов, получавших комбинированную терапию НВПС и ГКС, чем у пациентов на фоне терапии только НВПС.
Заключение
Пациенты с СпА страдают различной степени выраженности почечной дисфункцией вследствие нескольких патогенетических механизмов, в т.ч. длительного воспаления и приема лекарственных препаратов. При этом у пациентов, получавших комбинированную терапию, включившую НВПС и ГКС, почечная дисфункция выражена в меньшей степени, что может свидетельствовать о лучшем контроле активности заболевания и, соответственно, замедлении прогрессирования почечного повреждения. Полученные данные нуждаются в дальнейшем более длительном и детальном изучении.



