Введение
Саркопения – одно из грозных осложнений длительной терапии хроническим гемодиализом (ГД) [1]. По данным малочисленных зарубежных исследований, распространенность саркопении среди гемодиализных пациентов в общей группе колеблется в пределах 15–30% [2, 3]. Наличие саркопении у гемодиализного пациента относится к независимым предикторам заболеваемости и смертности среди данной когорты пациентов [4]. Пациенты с саркопенией характеризуются более низкой физической активностью, склонностью к депрессиям и плохой социальной адаптацией [5]. Своевременная диагностика саркопении у гемодиализных пациентов чрезвычайно важна в целях прогнозирования клинических исходов [5].
Согласно рекомендациям EWGSOP (European Working Group on Sarcopenia in Older People), диагностика саркопении в обязательном порядке должна включать оценку общей массы скелетной мускулатуры с последующим расчетом индекса мышечной массы (ИММ), определение мышечной силы и работоспособности скелетной мускулатуры [6]. Таким образом, методология проведения диагностики саркопении у гемодиализных пациентов весьма трудоемка и требует специализированной инструментальной диагностики, что делает маловероятной возможность рутинной диагностики саркопении всем гемодиализным пациентам. В связи с этим актуальным остается вопрос внедрения в повседневную практику метода скрининга саркопении, позволяющего простым малозатратным, а главное – высокочувствительным методом выявлять гемодиализных пациентов с риском развития саркопении, нуждающихся в проведении развернутой диагностики.
На сегодняшний день единственным методом скрининга саркопении является опросник SARC-F [7].
Цель исследования: оценка эффективности метода скрининга саркопении SARC-F у гемодиализных пациентов.
Материал и методы
Обследованы 317 пациентов, получавших лечение программным бикарбонатным ГД в 9 гемодиализных центрах 5 регионов европейкой части Российской Федерации в течение 8,2±5,1 года, среди них 171 женщина и 146 мужчин, средний возраст составил 57,1±11,3 года. Процедуры ГД проводили на аппаратах «искусственная почка» с использованием воды, подвергнутой глубокой очистке методом обратного осмоса капиллярных диализаторов площадью 1,7–2,1 м2. Сеансы ГД проводили 3 раза в неделю по 4,0–5,5 часов. Всем пациентам проведено традиционное клинико-лабораторное обследование. Диагностика саркопении проводилась согласно рекомендациям EWGSOP [6]. Для оценки общей массы скелетной мускулатуры использовали биоимпедансометрию с использованием 8-точечного тактильного тетраполярного мультичастотного биоимпедансометра (InBody, Южная Корея) с диапазоном частот 1–1000 кГц по 10 измерений для каждой из 6 частот по каждому из 5 сегментов тела (правая и левая рука, правая и левая нога, туловище). После выполнения биоимпедансометрии проведен расчет ИММ, рассчанный как отношение массы скелетной мускулатуры (кг) к квадрату роста в метрах (м2). Предельный уровень нормальности ИММ для мужчин считался более 8,87 кг/м2, для женщин – более 6,42 кг/м2.
Мышечная сила определена с помощью количественного динамометра с ручным захватом (Kern, Германия). Измерения были выполнены на доминантной руке, за результат принимали среднее значение трех последовательных измерений. Предельные значения, используемые для определения низкой мышечной силы, были <30 кг у мужчин и <20 кг у женщин [8, 9]. Оценка работоспособности скелетной мускулатуры проведена с помощью 6-минутного теста и согласно рекомендациям EWGSOP [10]. Предельным значением, используемым для определения низкой работоспособности скелетной мускулатуры, служило прохождение дистанции при выполнении 6-минутного теста более 400 м [11].
Для скрининга саркопении использовали опросник SARC-F (S – Strength – сила, A – Assistance – помощь, R – Rise – вставание, C – Climb – подъем, F – Fall – падения). Опросник SARC-F включал 5 вопросов, для каждого отдельно взятого вопроса представлено три варианта ответа, один из которых должен выбрать пациент. В зависимости от варианта ответа, выбранного пациентом, каждому ответу присваивалось определенное количество баллов – от 0 до 2. В случае если пациент набирает ответами 4 балла и более, можно говорить о возможном наличии у пациента признаков саркопении. Описание метода SARC-F представлено в табл. 1.

Статистическая обработка полученных результатов проведена с использованием общепринятых параметрических и непараметрических методов. Для анализа и оценки полученных данных применялись стандартные методы описательной статистики: вычисление средних значений, медиан, стандартных отклонений и построение таблиц сопряженности. Статистическую значимость межгрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA) с предварительным log-преобразованием исходных данных. Для оценки взаимосвязи переменных использовали корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена (Rs). Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05. Построение ROC-кривых с расчетом 95% доверительных интервалов, вычисленных процедурой бутстрепа, производили с использованием библиотеки pROC для R [10]. Расчеты выполнены в пакете PAST v. 3.14 и IDE для R – RStudio v. 3.3.2.
Результаты
По результатам лабораторного обследования группа в целом характеризовалась наличием анемии легкой степени тяжести (гемоглобин – 110,0±13,9 г/л), нормальным уровнем лимфоцитов крови (лимфоциты крови – 1,86±0,47×109/л), предельно допустимым уровнем показателей белкового обмена (общий белок в сыворотке крови – 67,8±4,7 г/л, альбумин в сыворотке крови – 37,7±3,9 г/л, преальбумин – 32,2±1,3 мг/дл), нормальным уровнем общего холестерина крови (общий холестерин в сыворотке крови – 4,68±1,12 ммоль/л) и трансферрина крови (трансферрин в сыворотке крови – 1,94±0,45 г/л). Уровень азотемии соответствовал терминальной почечной недостаточности (креатинин сыворотки крови до ГД – 850,8±203,5 мкмоль/л, мочевина сыворотки крови до ГД – 22,2±6,3 ммоль/л). Величина показателя Kt/V (1,57±0,14 у.е.) соответствовала представлению об адекватности дозы ГД.
Частота встречаемости дефицита массы скелетной мускулатуры, по данным ИММ, составила 30,3% (95 пациентов), снижение мышечной силы, по данным динамометрии, отмечено у 153 (48,7%) пациентов, низкая работоспособность скелетной мускулатуры по результатам 6-минутного теста определена у 134 (42,8%) пациентов. Распространенность саркопении составила 29,6% (93 пациента).
После диагностики саркопении, согласно рекомендациям EWGSOP, проведена оценка информативности метода скрининга саркопении SARC-F у гемодиализных пациентов, полученные результаты представлены в табл. 2.
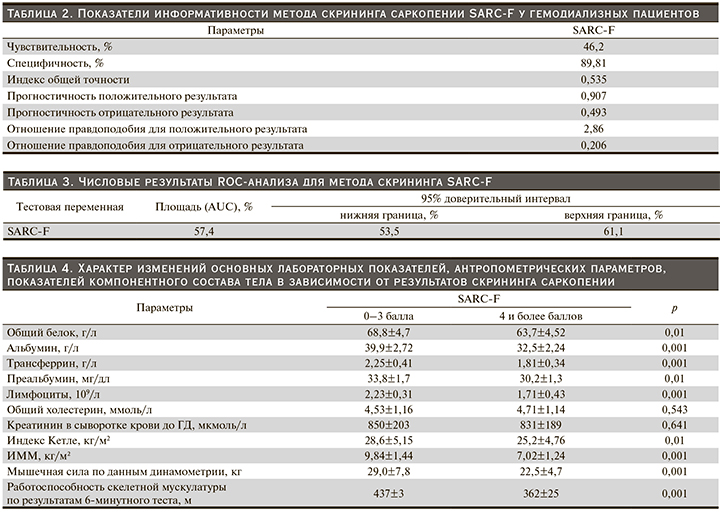
При диагностике саркопении, согласно рекомендациям EWGSOP, методика скрининга SARC-F показала индекс точности диагноза саркопения на уровне 53%, т.е. вероятность ошибки практически равнялась вероятности установки правильного диагноза. При построении ROC-кривой для метода скрининга саркопении SARC-F получены результаты, представленные в табл. 3.
Для метода скрининга SARC-F площадь под ROC-кривой (AUC) не превышала 0,57, что свидетельствует о низкой предсказательной ценности данного метода как метода скрининга саркопении.
Характер изменений основных лабораторных показателей, антропометрических параметров, показателей компонентного состава тела в зависимости от результатов скрининга саркопении представлен в табл. 4.
При наличии риска развития саркопении, по данным метода скрининга SARC-F, отмечается достоверное снижение основных лабораторных показателей, антропометрических параметров, показателей компонентного состава тела по сравнению с таковыми пациентов с отрицательным результатом скрининга саркопении.
Обсуждение
По нашим данным, метод скрининга саркопении SARC-F не показал приемлемой для метода скрининга величины индекса точности диагноза саркопении у гемодиализных пациентов. Таким образом, при использовании метода скрининга SARC-F вероятность ошибки практически равнялась таковой установки правильного диагноза. Также о низкой предсказательной ценности данного метода как метода скрининга саркопении свидетельствуют данные ROC-анализа: для метода скрининга SARC-F площадь под ROC-кривой (AUC) не превышала 57%. При этом мы обратили внимание на высокую специфичность метода скрининга SARC-F в отношении предсказания саркопении у гемодиализных пациентов, что нашло свое отражение в статистически значимой отрицательной динамике лабораторных показателей, антропометрических параметров, показателей компонентного состава тела в зависимости от результатов скрининга саркопении. Таким образом, метод скрининга SARC-F способен улавливать признаки наличия саркопении у гемодиализных пациентов на этапе клинически значимой саркопении, но не на ранних этапах развития данного состояния.
Заключение
Для проведения скрининга саркопении гемодиализным пациентам использование метода скрининга SARC-F нецелесообразно ввиду ее низкой предсказательной ценности.
В случае выявления риска наличия саркопении методом SARC-F пациент в обязательном порядке нуждается в развернутой диагностике саркопении. Разработка высокочувствительного и специфичного метода скрининга саркопении для пациентов данной когорты остается актуальной проблемой практического здравоохранения.

