Введение
Стеноз почечной артерии (СПА) развивается при ее атеросклерозе, фибромускулярной дисплазии, неспецифическом аортоартериите, а также при ряде других заболеваний. СПА приводит к неблагоприятным клиническим исходам, таким как реноваскулярная гипертензия, ишемическая нефропатия, почечная недостаточность, синдром сердечного повреждения, проявляющийся рецидивирующим отеком легких, неконтролируемой сердечной недостаточностью и нестабильной стенокардией. При этом увеличиваются риски развития сердечно-сосудистых событий и смерти [1, 2]. Хотя и показано, что применение эндоваскулярного метода (баллонная ангиопластика и стентирование почечной артерии для устранения стеноза) снижает риск развития сердечно-сосудистых событий и смерти, проблема коррекции СПА в практике отечественной и мировой медицины до настоящего времени считается недостаточно успешно решенной [3, 4].
Цель исследования: оценить ближайшие клинические результаты эндоваскулярной коррекции стеноза почечной артерии (ЭКСПА).
Материал и методы
Ближайшие результаты ЭКСПА проанализированы на 121 пациенте нефрологического отделения ГБУЗ СО «Свердловская областная клиническая больница № 1», которому в период с апреля 2011 по апрель 2018 г. было выполнено 147 вмешательств.
Проведено когортное проспективное исследования, проведение которого было одобрено локальным этическим комитетом больницы.
В рамках данного исследования каждое вмешательство ЭКСПА рассматривалось как отдельный клинический случай. Операция выполнялась методом баллонной ангиопластики или стентирования почечной артерии. Всего выполнено 139 (94,6%) стентирований и 8 (5,4%) баллонных ангиопластик (рис. 1). В случаях двустороннего стенозирования почечных артерий ЭКСПА выполнялась последовательно на каждой почечной артерии с временны'м интервалом не менее 1 месяца с целью снижения риска осложнений. При этом 19 пациентам по показаниям (рестеноз почечной артерии или контрлатеральный СПА) ЭКСПА выполнялась 2 раза, двоим – 3, одному пациенту – 4 раза.
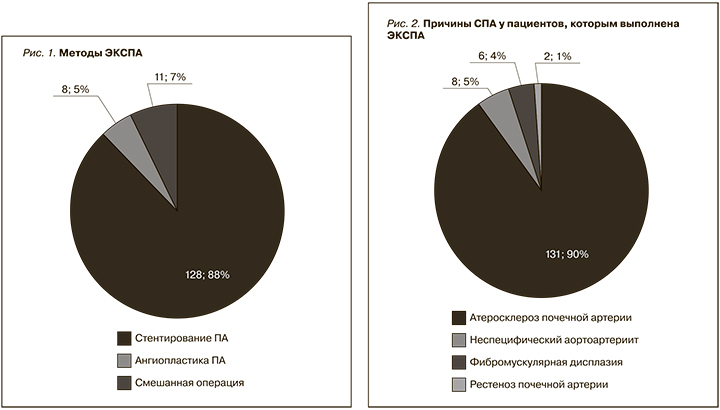
ЭКСПА была выполнена 63 (42,9%) мужчинам и 84 (57,1%) женщинам в возрасте от 25 до 82 лет. Средний возраст больных составил 62,66±9,98 года. Причиной СПА в 132 (89,8%) случаях стал атеросклероз почечной артерии, в 4 (2,7%) – неспецифический аортоартериит, в 3 (2,1%) – фибромускулярная дисплазия, в 8 (5,4%) случаях – рестеноз почечной артерии после предыдущей ЭКСПА (рис. 2).
 Все пациенты имели артериальную гипертензию (АГ), констатированнаую в соответствии с рекомендациями ВОЗ и распределенную по степени контроля АД на 3 группы: 1-я группа – АГ контролируется на уровне АД≤140/90 мм рт.ст., 2-я – АГ контролируется на уровне АД≤160/100 мм рт.ст., 3-я группа – АГ не контролируется, уровень АД>160/100 мм рт.ст. на фоне антигипертензивной терапии [5].
Все пациенты имели артериальную гипертензию (АГ), констатированнаую в соответствии с рекомендациями ВОЗ и распределенную по степени контроля АД на 3 группы: 1-я группа – АГ контролируется на уровне АД≤140/90 мм рт.ст., 2-я – АГ контролируется на уровне АД≤160/100 мм рт.ст., 3-я группа – АГ не контролируется, уровень АД>160/100 мм рт.ст. на фоне антигипертензивной терапии [5].
До ЭКСПА 19 (12,9%) пациентов по степени контроля АД относились к 1-й группе, 85 (57,8%) – ко 2-й, 43 (29,3%) пациента – к 3-й группе (рис. 3).
Уровень креатинина (Кр) сыворотки крови определялся по стандартной методике [6]. Средний уровень Кр в исследуемой когорте до ЭКСПА составил 112,18±31,00 мкмоль/л (min – 58; max – 226).
 Пациенты до выполнения ЭКСПА принимали антигипертензивные препараты следующих групп: агонисты I1-имидазолиновых рецепторов, α-адреноблокаторы, β-адреноблокаторы, блокаторы рецепторов ангиотензина, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (иАПФ) в количестве минимум 1 и максимум 4, в среднем 2 препарата этих групп в разных режимах применения и дозирования для коррекции уровня АД. При подтверждении наличия СПА препараты групп иАПФ и блокаторы рецепторов ангиотензина отменялись в соответствии с клиническими рекомендациями по АГ [7].
Пациенты до выполнения ЭКСПА принимали антигипертензивные препараты следующих групп: агонисты I1-имидазолиновых рецепторов, α-адреноблокаторы, β-адреноблокаторы, блокаторы рецепторов ангиотензина, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента (иАПФ) в количестве минимум 1 и максимум 4, в среднем 2 препарата этих групп в разных режимах применения и дозирования для коррекции уровня АД. При подтверждении наличия СПА препараты групп иАПФ и блокаторы рецепторов ангиотензина отменялись в соответствии с клиническими рекомендациями по АГ [7].
С учетом современного определения хронической болезни почек (ХБП) [8] все пациенты рассматривались как имеющие ХБП и распределились по стадиям ХБП следующим образом: стадия 1 – 10 (6,8%) пациентов, стадия 2 – 50 (34,0%), стадия 3А – 40 (27,2%), стадия 3Б – 39 (26,5%), стадия 4 – 8 (5,5%) пациентов (рис. 4).
Оценка стадии ХБП проводилась по скорости клубочковой фильтрации (СКФ) с использованием формулы CKD-EPI [8, 9].
В 24 (16,3%) случаях на момент ЭКСПА у пациентов имелась единственная функционирующая почка, в связи с чем данное вмешательство им выполнялось практически по жизненным показаниям [7].
В данной когорте коморбидную патологию удалось установить у 120 (81,6%) пациентов. Структура коморбидных состояний у наблюдаемых больных была следующей: в 28 (19,0%) случаях был сахарный диабет 2 типа, в 47 (32,0%) – ишемическая болезнь сердца, в 12 (8,2%) в анамнезе было острое нарушение мозгового кровообращения, в 7 (4,8%) – онкологический процесс в анамнезе, в 2 (1,4%) случаях – системная красная волчанка с поражением почек. При этом у 109 (74,1%) пациентов встречалась сочетанная патология (рис. 5).
Наличие СПА устанавливалось по данным ультразвуковой допплерографии (УЗДГ) почечных артерий (как правило, использовался как скрининговый метод для первичного выявления СПА) и/или КТ-ангиографии. Выполнение ЭКСПА планировалось при обнаружении вышеперечисленными методами гемодинамически значимого СПА. За гемодинамически значимый считали стеноз более 70% [10]. При обнаружении стеноза >60% проводилась брюшная аортография с использованием контрастного вещества для определения более точной степени стеноза почечной артерии. Если во время брюшной аортографии подтверждался гемодинамически значимый СПА, проводили ЭКСПА. В случае выполнения вмешательства методом стентирования пациентам устанавливали баллонорасширяемые стенты.
Всем пациентам назначали антикоагулянтную и дезагрегантную терапию: ацетилсалициловая кислота 75–100 мг и клопидогрел 75 мг/сут за 3 дня до вмешательства. Данная терапия пролонгировалась после ЭКСПА с целью профилактики тромботических осложнений не менее 6 месяцев [11].
В качестве ближайшего послеоперационного периода был выбран период продолжительностью 30 дней. Результаты ЭКСПА оценивали в срок 3 и 30 суток после вмешательства. При этом анализировали эффективность функционирования стента либо проходимость почечной артерии после ангиопластики. Кроме того, проводили сравнение уровней Кр и степени контроля АД до ЭКСПА с данными показателями после ЭКСПА. Оценка функционального состояния (проходимости) стента после вмешательства осуществляли методом УЗДГ. При обнаружении гемодинамически значимого рестеноза почечной артерии степень его значимости подтверждалась методом КТ-ангиографии и/или брюшной аортографии.
При проведении клинико-демографической характеристики пациентов использовали методы описательной статистики. Для данных в интервальной шкале приводили описательные статистики: число наблюдений, среднее, стандартная ошибка средней, медиана, стандартное отклонение, минимум, максимум. Для проведения парных сравнений групп (до и после ЭКСПА) использовали непараметрический критерий Вилкоксона для связных выборок и критерий знаков.
Минимальный требуемый объем выборки составил 129 вмешательств ЭКСПА. Расчет размера выборки осуществляли по стандартной методике [12, 13]. Уровень значимости принимали равным 0,05, мощность критерия – равной 0,9, величину эффекта принимали равной 50% от стандартного квадратичного отклонения исследуемой величины (Кр) в группе пациентов до проведения ЭКСПА. Статистический анализ проводили с использованием программного пакета SPSS версии 16.
Результаты
А. Результаты ЭКСПА через 3 суток после вмешательства:
Летальных исходов и послеоперационных осложнений не зарегистрировано.
Все ЭКСПА были эффективными: 100% стентов либо ангиопластических вмешательств были состоятельными.
Средний уровень Кр в исследуемой группе пациенток достоверно снизился на 7,48 мкмоль/л (критерий Вилкоксона; p<0,001): до ЭКСПА – 111,98±31,02 (min – 58; max – 226), после ЭКСПА – 104,50±33,86 мкмоль/л (min – 47; max – 250).
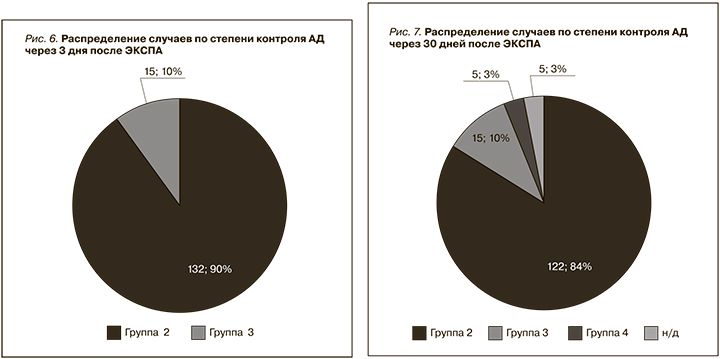
По степени контроля АД после ЭКСПА пациенты распределились следующим образом: 137 (93,2%) пациентов относились к 1-й группе, 10 (6,8%) – ко 2-й (рис. 6). Данное распределение по группам по сравнению с распределением по группам до ЭКСПА показывает, что АД статистически значимо уменьшилось (критерий Вилкоксона; p<0,001; критерий знаков, p<0,001).
Б. Результаты ЭКСПА через 30 суток после вмешательства.
Летальных исходов не зарегистрировано (100%-ная выживаемость пациентов в течение 30 дней после ЭКСПА), послеоперационных осложнений не зарегистрировано.
Все ЭКСПА были эффективными (100%-ная выживаемость стента либо ангиопластического вмешательства в течение 30 дней после ЭКСПА).
Средний уровень Кр в исследуемой группе достоверно снизился на 10,84 мкмоль/л (p<0,001): до ЭКСПА 111,95±31,14 мкмоль/л (min – 58; max – 226), после ЭКСПА 101,11±29,75 мкмоль/л (min – 50; max – 213) (критерий Вилкоксона, p<0,001), а также на 3,08 мкмоль/л (p<0,001) по сравнению с результатом через 3 дня после ЭКСПА 104,19±33,6 мкмоль/л (min – 47; max – 250) (критерий Вилкоксона, p<0,001).
По степени контроля АД после ЭКСПА пациенты распределились следующим образом: 133 (90,5%) пациента относились к 1-й группе, 9 (6,1%) – ко 2-й, 5 (3,4%) пациентов – к 3-й (рис. 7). Данное распределение по группам по сравнению с распределением по группам до ЭКСПА показывает, что АД статистически значимо уменьшилось (критерий Вилкоксона, p<0,001; критерий знаков, p<0,001).
Обсуждение
По мнению ряда авторов, ЭКСПА является эффективным вмешательством.
Так, А.С. Вради и соавт. сообщают, что в группе из 76 пациентов, перенесших 87 стентирований, оптимальный ангиографический результат был получен в 98,7% [14]. А.Н. Самко и соавт. показали, что в группе из 38 больных у всех пациентов процедура стентирования прошла успешно, остаточный стеноз в месте имплантации стента не превышал 5%, а каких-либо осложнений отмечено не было [15]. G. Geary et al. отметили, что в группе из 31 больного стенты были успешно развернуты 30 (97%) лицам. Серьезных процедурных или внутрибольничных осложнений не было [16]. M. Sapoval et al. показали, что в группе из 251 (276 вмешательств) пациента непосредственный успех вмешательства, определяемый как остаточный стеноз <30% после размещения стента, составил 100% [17]. Полученные нами данные также свидетельствуют о 100%-ной выживаемости пациентов и 100%-ной эффективности ЭКСПА в течение 30 дней после вмешательства.
Также во многих исследованиях продемонстрирована высокая эффективность ЭКСПА в отношении коррекции уровня артериального давления (АД) в ближайшем послеоперационном периоде.
А.З. Шарафеев и соавт. отметили, что в группе из 33 пациентов непосредственно после стентирования гипотензивный эффект отмечен в 100% случаев. В результате эндоваскулярного вмешательства при СПА произошло перераспределение больных по выраженности АГ в сторону более низких степеней (преимущественно 1-й степени). Наиболее выраженный гипотензивный эффект был получен от больных со 2-й и 3-й степенями АГ (p<0,05) [18]. В.В. Плечев и соавт. отметили стойкое снижение АД в раннем послеоперационном периоде и повышение чувствительности к антигипертензивной терапии большинства пациентов (83% лиц в группе из 18 больных) [19].
О.В. Галимов и соавт. показали, что в группе из 32 пациентов после процедуры ЭКСПА гипотензивный эффект отмечен во всех случаях. При этом наблюдалось также достоверное снижение максимальных подъемов систолического АД до 28%, диастолического – на 21%. После эндоваскулярного вмешательства произошло перераспределение больных по степени выраженности АГ в сторону 1-й степени. Наиболее ощутимый гипотензивный эффект получен от больных со 2-й и 3-й степенями АГ [20]. G. Geary et al. продемонстрировали, что в группе из 31 пациента после стентирования число принимаемых одним пациентом антигипертензивных препаратов снизилось в среднем от 3 наименований до вмешательства до 0,7 после него [16].
В соответствии с результатами нашего исследования в группе из 121 (147 вмешательств) пациента летальных исходов и послеоперационных осложнений не зарегистрировано (100%-ная выживаемость пациентов в течение 3 и 30 дней после ЭКСПА). Показатели АД после ЭКСПА статистически значимо уменьшились (p<0,001), о чем свидетельствовало перераспределение пациентов в группах по степени контроля АД в сторону 2-й группы.
В литературе встречается мало данных о непосредственном влиянии ЭКСПА на функцию почек. Так, в работе, выполненной А.С. Вради et al., у 76 (87 стентирований) пациентов после эндоваскулярного вмешательства осуществлялся контроль функции почек. При этом временное ухудшение почечной функции, расцененное как контраст-индуцированная нефропатия, отмечено у 16 (21%) пациентов непосредственно после ЭКСПА [14]. A. Holden, A. Hill показали, что у 95% из 37 (46 стентирований) пациентов после реваскуляризации функция почек стабилизировалась или улучшилась, у 5% пациентов функция почек не изменилась. Причем резкого ухудшения функции почек после стентирования ни у одного из пациентов отмечено не было [21]. По данным Z. Arthurs et al., в группе из 18 пациентов, которым выполнено 29 стентирований почечных артерий, после вмешательства наблюдалось статистически значимое (p<0,05) плато в динамике функции почек (изменение Кр) по сравнению с состоянием до вмешательства [22].
Нами установлено, что выполнение ЭКСПА достоверно улучшает почечную функцию как непосредственно после вмешательства (на 3-и сутки), так и в ближайшем послеоперационном периоде (30-е сутки). В проведенном нами исследовании средний уровень Кр у пациентов достоверно снизился на 3-й и 30-й дни после вмешательства по сравнению с Кр до ЭКСПА (p<0,001).
Выводы
- ЭКСПА является безопасным вмешательством для жизни пациентов в ближайшем послеоперационном периоде.
- Метод ЭКСПА обладает высокой результативностью в отношении восстановления и сохранения проходимости почечных артерий.
- Клиническая эффективность ЭКСПА заключается как в сохранении и улучшении почечной функции, так и в коррекции степени выраженности АГ.

