С момента идентификации рецептора подоцитарной фосфолипазы А2М-типа (PLA2R) в качестве эндогенного антигена, участвующего в развитии идиопатической (первичной) формы мембранозной нефропатии (ИМН) достигнут существенный прогресс в понимании патогенетических механизмов развития данной гломерулопатии. До 70–80% случаев ИМН ассоциированы с образованием в почках иммунных комплексов, состоящих из антигена PLA2R и комплиментарных антител (АТ) класса IgG4 [1–6]. Благодаря возможности обнаружения в нефробиоптатах антигена PLA2R и определения в крови уровня АТ к нему значительно улучшилась дифференциальная диагностика первичной и вторичной форм ИМН, а мониторирование уровня сывороточных АТ к PLA2R позволяет прогнозировать течение ИМН и своевременно проводить коррекцию терапии [7–17].
Однако факторы, определяющие выработку антител к собственным антигенам подоцитов, в частности к PLA2R, до сих пор не установлены. Обсуждается роль определенных вариантов генов, ответственных за синтез специфического подоцитарного антигена и аутоантител к нему: рецептора фосфолипазы А2М-типа (PLA2R1) и генов главного комплекса гистосовместимости человека (HLA) класса II, носительство которых, по данным ряда исследований [10, 18–29], ассоциировано с риском развития ИМН.
Цель – изучить особенности клинической картины ИМН в зависимости от серопозитивности по АТ к PLA2R, а также ассоциацию между АТ к PLA2R и полиморфными маркерами rs4664308 гена PLA2R1 и rs2187668 гена HLA-DQA1.
Материал и методы
В исследование были включены пациенты с морфологически подтвержденной ИМН, соответствовавшие следующим критериям: 1) исключен вторичный характер нефропатии; 2) уровень АТ к PLA2R определен на момент проведения биопсии почки и до начала иммуносупрессивной терапии; 3) доступны данные последующего наблюдения в течение как минимум 12 месяцев. Всем соответствовавшим критериям включения пациентам проведено генотипирование по полиморфным маркерам rs4664308 гена PLA2R1 и rs2187668 гена HLA-DQA1.
Критериям включения в исследование соответствовали 34 пациента с ИМН (средний возраст – 48,7±14,7 года, 67,6% мужчин). У 26 (76,5%) из 34 пациентов выявлены положительные титры антител, распределенные следующим образом: 1:10 (n=1), 1:40 (n=7), 1:80 (n=8), 1:160 (n=3), 1:320 (n=6) и 1:640 (n=1). В зависимости от наличия или отсутствия АТ к PLA2R пациенты были разделены на две группы: анти-PLA2R«+» и анти-PLA2R«-».
Анализировали демографические характеристики всех включенных в исследование пациентов, клинико-лабораторные показатели на момент нефробиопсии, выраженность морфологических изменений и ответ на иммуносупрессивную терапию (ИСТ) в зависимости от наличия АТ к PLA2R.
Эффективность ИСТ оценивали через 6 месяцев после начала лечения по следующим критериям:
- полная ремиссия — снижение протеинурии (ПУ) до <0,3 г/сут при уровне альбумина >35 г/л и полном восстановлении или сохранении функции почек;
- частичная ремиссия — уменьшение признаков НС или купирование НС с персистированием ПУ>0,3 г/сут с улучшением или сохранением функции почек (для пациентов с НС) и снижение ПУ не менее чем на 50% с сохранением или восстановлением функции почек (для больных с активным хроническим гломерулонефритом без НС);
- отсутствие ответа на ИСТ – сохранение или нарастание выраженности НС и/или нарушения функции почек, персистирование ПУ>0,5 г/сут, несмотря на проведенную в течение 6 месяцев адекватную ИСТ.
Уровни АТ к PLA2R определяли иммуноферментным методом с помощью коммерческой тест-системы компании Euroimmum (Германия); титры АТ к PLA2R<1:10 рассматривали как референсные значения.
Синтез праймеров, выделение ДНК из лейкоцитов венозной крови и идентификацию аллелей и генотипов полиморфных маркеров rs4664308 гена PLA2R1 и rs2187668 гена HLA-DQA1 методом полимеразной цепной реакции в режиме реального времени проводили в сотрудничестве с компанией «Синтол». В результате идентифицированы аллели А и G (минорный) и генотипы А/А, А/G и G/G для полиморфного маркера rs4664308 гена PLA2R1 и аллели G и A (минорный) и генотипы G/G, G/A и A/A для полиморфного маркера rs2187668 гена HLA-DQA1. В качестве контроля для оценки генетического риска развития ИМН использовали выборку из 100 здоровых доноров крови.
Для непрерывных переменных рассчитывали среднее значение и стандартное отклонение или медиану в межквартильный размах (в зависимости от соответствия данных нормальному распределению), для качественных – частоты. Межгрупповые различия оценивали с помощью t-критерия Стьюдента или U-критерия Манна–Уитни в зависимости от характера распределения. Для проверки статистической значимости различий частотных показателей использовали χ2-критерий Пирсона, при ожидаемой частоте явлений менее 5 применяли точный критерий Фишера. При значении р<0,05 различия считали статистически значимыми; р в пределах от 0,05 до <0,1 рассматривали как тенденцию к различию.
Результаты
Демографические и клинико-лабораторные характеристики пациентов представлены в табл. 1.
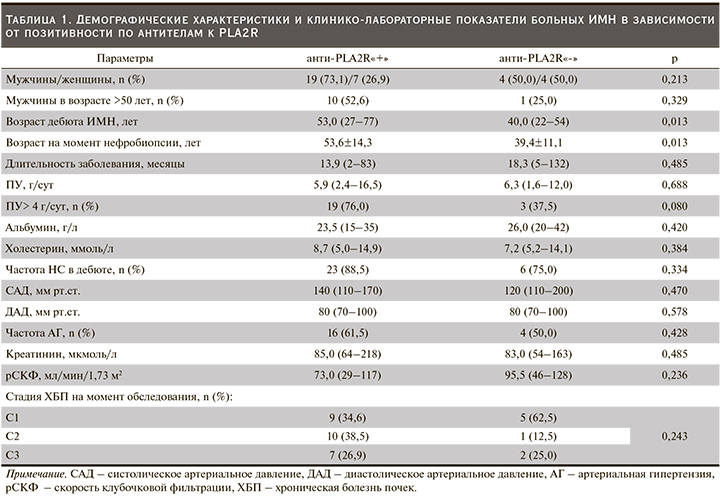
Среди пациентов с положительными АТ к PLA2R преобладали мужчины, половина из которых были старше 50 лет. Кроме того, анти-PLA2R-позитивность ассоциировалась с более поздним возрастом манифестации заболевания, при этом длительность ИМН до нефробиопсии в обеих группах была сопоставимой. При оценке активности ИМН в зависимости от наличия АТ к PLA2R статистически значимых различий между группами по уровням АД, состоянию функции почек, частоте НС не выявлено, однако у пациентов с положительными АТ к PLA2R по сравнению с пациентами без данных АТ наблюдалась тенденция к более частому выявлению ПУ>4 г/сут (критерий ИМН среднего и высокого рисков прогрессирования).
Морфологические стадии в группах анти-PLA2R«+» и анти-PLA2R«-» распределялись следующим образом: 1-я стадия – 16,7 и 0% пациентов, 2-я – 77,8 и 33,3% и 3-я – 5,6 и 66,7% пациентов соответственно. Таким образом, у пациентов с отрицательными АТ к PLA2R чаще выявляли продвинутую стадию ИМН по сравнению с анти-PLA2R-позитивными пациентами (хотя различия не достигали статистической значимости в связи с малым числом больных в группе анти-PLA2R«-»).
Ответ на ИСТ удалось проследить у 19 пациентов (у 16 в группе анти-PLA2R«+» и у 3 в группе анти-PLA2R«-»). В группе анти-PLA2R«+» длительность терапии до наступления ремиссии была выше по сравнению с группой анти-PLA2R«-», однако данные различия не достигли уровня статистической значимости: 13,2 (6–33) и 10,0 (8–12) месяцев соответственно (р=0,513). Полный ответ был достигнут от 4 (25%) и 1 (33,3%) пациента, частичный – от 7 (43,8%) и 1 (33,3%) пациента; от 5 (31,3%) и 1 (33,4%) пациента соответственно ответ на ИСТ отсутствовал. Частота развития ремиссии в целом (полной или частичной) в группах анти-PLA2R«+» и анти-PLA2R«-» оказалась сопоставимой и составила 68,8 и 66,7% соответственно. Однако пациенты с отрицательными АТ к PLA2R достигли ответа уже после первого курса ИСТ (1 пациент получал циклоспорин А и 1 – сочетанную «пульс»-терапию циклофосфамидом и преднизолоном), тогда как в группе анти-PLA2R«+» 6 (54,4%) пациентами ремиссия была достигнута только после применения нескольких режимов ИСТ.
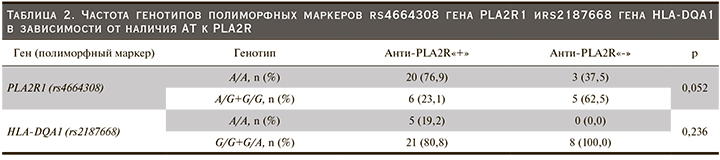
Генотипы исследуемых полиморфных маркеров генов у 34 включенных в исследование больных распределялись следующим образом: частота генотипа А/А полиморфного маркера rs4664308 гена PLA2R1 составила 69,7%, генотипа A/G – 24,2%, генотипа G/G – 6,1%. Генотип GG полиморфного маркера rs2187668 гена HLA-DQA1 выявлен у 72,7% больных, генотип G/A – у 12,1% и генотип A/A – у 15,2%. В контрольной группе распределение генотипов было следующим: полиморфный маркер rs4664308 гена PLA2R1 (А/А – 34%, A/G – 51%, G/G – 15%), полиморфный маркер rs2187668 гена HLA-DQA1 (G/G – 91%, G/A – 7%, A/A – 2%).
В связи с малым количеством гомозигот G/G по обоим исследуемым полиморфным маркерам для дальнейшего анализа их объединили с соответствовавшими гетерозиготами.
При сравнительном анализе распределения генотипов полиморфного маркера rs4664308 гена PLA2R1 выявлено статистически значимое увеличение частоты генотипа А/А у больных ИМН по сравнению со здоровым контролем, что ассоциировалось почти с 4-кратным повышением риска развития ИМН у носителей данного генотипа (отношение шансов [ОШ]=3,88; 95% доверительный интервал [ДИ] –1,69–8,94; р<0,001). Статистически значимые различия частоты генотипов у больных ИМН и здоровых лиц наблюдались и в отношении полиморфного маркера rs2187668 гена HLA-DQA1: в группе ИМН процент носителей генотипа А/А оказался выше, а носительство данного генетического варианта увеличивало риск развития ИМН почти в 9 раз (ОШ=8,75, 95% ДИ – 1,61–47,55; р=0,010).
При сравнительной оценке распределения генотипов исследуемых генов в зависимости от наличия АТ к PLA2R выявлено, что у пациентов группы анти-PLA2R«+» наблюдалась тенденция к более частому носительству генотипа A/A полиморфного маркера rs4664308 гена PLA2R1, ассоциированного с повышенным риском развития ИМН (табл. 2).
Обсуждение
Патогенетическая роль подоцитарного антигена (PLA2R) и антител к нему в развитии ИМН, впервые установленная L.H. Beck et al. [1] в 2009 г., к настоящему времени доказана в многочисленных исследованиях [2–6] и не вызывает сомнений. Мы изучили ассоциацию выявления АТ к PLA2R с особенностями клинической картины ИМН. По нашим данным, положительные титры АТ к PLA2R определялись у 76,5% больных ИМН, что согласуется с результатами других исследований, в которых этот показатель варьировался от 44 до 89% [1, 7–17, 30]. При анализе зависимости возраста дебюта заболевания от наличия АТ к PLA2R оказалось, что анти-PLA2R-позитивность ассоциирована с более поздним возрастом начала заболевания и возрастом проведения нефробиопсии. Сходную зависимость выявили и В.А. Добронравов c соавт. [31], в работе которых пациенты с положительными АТ к PLA2R были статистически значимо старше: 66 (59–72) лет по сравнению с 51 (45–57) годом; р=0,005). В то же время в исследовании R. Ramachandran et al. [24] возраст пациентов с АТ к PLA2R и без них не различался.
В ряде работ описана корреляция между наличием АТ к PLA2R и активностью заболевания, в частности с более высоким уровнем протеинурии и низким – альбумина в крови [9, 13, 14, 32]. В нашей выборке у анти-PLA2R-позитивных пациентов с ИМН наблюдалась тенденция к повышению частоты ПУ>4 г/сут – значимого фактора прогрессирования ИМН, тогда как другие показатели, отражающие активность ИМН (альбуминемия, степень АГ, рСКФ и сывороточный креатинин), не отличались от таковых у пациентов с отрицательными антителами.
Обращала на себя внимание более высокая частота выявления продвинутых стадий ИМН у пациентов с отрицательными АТ к PLA2R по сравнению с анти-PLA2R-позитивными пациентами. В качестве возможной причины может обсуждаться более стертое течение ИМН в отсутствие АТ к PLA2R с более поздней манифестацией клинических проявлений, однако это предположение еще нуждается в подтверждении на более крупной популяции больных. Также можно предположить потребление в почках циркулирующих АТ к PLA2R с последующим развитием продвинутых стадий ИМН (несмотря на отрицательный уровень сывороточных АТ к PLA2R, иммунологическая активность заболевания выявляется примерно у 15% больных ИМН) [33].
Статистически значимых различий в частоте получения ответа на ИСТ в зависимости от наличия АТ к PLA2R не выявлено (возможно, ввиду небольшого размера исследуемой выборки), однако серопозитивным пациентам для достижения ремиссии ИМН потребовалось применение нескольких режимов иммуносупрессии, необходимых для снижения образования аутоантител и контроля аутоиммунной реакции в почке. Наши данные согласуются с результатами других исследований, продемонстрировавших зависимость ответа на ИСТ не только от наличия, но и от титра выявляемых АТ к PLA2R. В частности, показано, что пациентам с более высоким уровнем АТ к PLA2R требуется более длительная и объемная иммуносупрессия для достижения сопоставимых показателей ремиссии у пациентов с более низкими уровнями этих антител [33].
Мы подтвердили вклад вариантов полиморфных маркеров rs4664308 гена PLA2R1 и rs2187668 гена HLA-DQA1 в развитие ИМН, выявив генотипы, ассоциированные с повышенным риском развития заболевания: генотип А/А полиморфного маркера rs4664308 гена PLA2R1 и генотип А/А полиморфного маркера rs2187668 гена HLA-DQA1. Причем для последнего маркера ассоциация с генетической предрасположенностью к ИМН в российской популяции описана впервые.
При анализе взаимосвязи уровней АТ к PLA2R с исследуемыми полиморфными маркерами обнаружена тенденция к повышению частоты встречаемости генотипа А/А полиморфного маркера rs4664308 гена PLA2R1, ассоциированного с повышенным риском развития ИМН, у больных в группе анти-PLA2R«+» (р=0,052). Полученные нами данные согласуются с результатами более ранних исследований [10], в которых положительные антитела чаще обнаруживали у пациентов с генотипом А/А полиморфного маркера rs4664308 гена PLA2R1 (р=0,08). Это позволяет обсуждать возможную связь данного полиморфного маркера с продукцией АТ к PLA2R и требует уточнения в последующих исследованиях.
В нашей группе больных связь между наличием АТ к PLA2R и полиморфным маркером rs2187668 гена HLA-DQA1 (генотип А/А которого ассоциирован с риском развития ИМН), а также сочетанием неблагоприятных генотипов обоих генов не обнаружена, что, по-видимому, обусловлено малым размером выборки. Тем не менее в нескольких работах подобная взаимосвязь описана. Так, J. Lv et al. [21] показали, что АТ к PLA2R присутствовали у 40% пациентов с генотипом G/G (низкий риск) и у 65% пациентов с генотипами G/A или A/A (высокий риск) полиморфного маркера rs2187668 гена HLA-DQA1. Более того, у носителей «протективных» генотипов обоих генов (HLA-DQA1 и HLA-DQA1) АТ к PLA2R в сыворотке крови отсутствовали, тогда как у пациентов с сочетанием генотипов «высокого риска» частота выявления данных антител составила 73%. Позднее индийские авторы [24] также обнаружили ассоциацию между аллелем А полиморфного маркера rs2187668 гена HLA-DQA1 и наличием АТ к PLA2R (114 пациентов с ИМН; р=0,0006), однако в их работе ассоциация между полиморфными маркерами гена PLA2R1 и частотой выявления АТ к PLA2R отсутствовала.
Несмотря на неоднозначность данных относительно вклада генетических факторов в выработку АТ к PLA2R, накопленные к настоящему времени результаты позволяют обсуждать гипотезу, согласно которой изменения последовательности аминокислот в рецепторе PLA2R, обусловленные носительством определенных вариантов гена PLA2R1, могут приводить к изменению его конформации и иммуногенности, превратив его в мишень для аутоантител (АТ к PLA2R), выработка которых будет определяться носительством определенного варианта гена HLA и которые будут играть ведущую роль в патогенезе ИМН, определив также особенности ее клинического течения и ответа на ИСТ.
Полученные нами результаты в целом согласуются с этой гипотезой: мы подтвердили ассоциацию АТ к PLA2R с рядом клинико-лабораторных показателей, а также выявили тенденцию к взаимосвязи анти-PLA2R-позитивности с носительством определенного генотипа гена PLA2R1, одновременно идентифицировав его как ассоциированного с риском развития ИМН. В то же время отсутствие ассоциации между АТ к PLA2R и полиморфным маркером rs2187668 гена HLA-DQA1 в нашем исследовании может быть связано с малым размером выборки, что диктует необходимость продолжения исследований в этом направлении с включением большего числа пациентов, а также изучения совместного вклада полиморфных маркеров генов PLA2R1 и HLA в развитие и течение ИМН.



