Введение
С 2019 г. мир столкнулся с новой инфекцией, названной тяжелым острым респираторным синдромом (SARS-CoV-2), таким образом, к уже обычным проблемам хронических неинфекционных заболеваний, с которыми боролись врачи различных специальностей, добавилось воздействие инфекции SARS-CoV-2.
Особый интерес врачей терапевтических специальностей вызывает влияние коморбидной патологии на риск как заражения SARS-CoV-2, так и неблагоприятных исходов в этой когорте пациентов, у которых и без инфекционного поражения он достаточно высок.
Сердечно-сосудистые заболевания и их классические факторы риска являются частой сопутствующей патологией у пациентов с COVID-19 и связаны с плохим прогнозом [1]. Ранее проведенные исследования показали, что острые респираторные инфекции, например, такие как грипп, увеличивают частоту/риск декомпенсации у пациентов с ХСН [2]. В этом аспекте особый интерес приставляет именно группа пациентов с ХСН и ХБП, т.к. риск декомпенсации у них максимально выражен.
Таким образом, целью нашего исследования было изучить влияние наличия у пациентов с ХСН и/или ХБП или их симптомов на частоту заболеваемости и/или смертности от SARS-CoV-2.
Материалы и методы
Дизайн исследования и участники
В 2020 г. проведено ретроспективное исследование случай–контроль. В него были включены пациенты из регистра пациентов, наблюдавшихся в трех учреждениях Москвы (ГП-6, -64, ГКБ 4). Наблюдение за когортами пациентов осуществляется с 2017 г.
Методика отбора группы
Всего в исследование включен 251 пациент; из анализа были исключены 32 пациента, умершие до начала эпидемии COVID-19, и выбрана когорта пациентов, имевших подтвержденный диагноз ХСН, что составило 167 пациентов, у двух из них не удалось определить статус заболевания COVID-19 на момент проведения анализа. Таким образом, в окончательный анализ была включена группа пациентов из 165 человек, из которых 18 переболели COVID-19.
Методика оценки частоты заболеваемости, симптомов и основных клинических показателей пациентов
Эпидемиологические, демографические, клинические, лабораторные показатели, данные об исходах были извлечены из электронных медицинских карт пациентов, для их включения в анализ требовалась полнота данных в размере не менее 70% от всех изучаемых параметров. В связи с этим в таблицах частот представлены максимально собранные данные о пациентах, за исключением пропущенных параметров, которые не удалось извлечь из медицинской документации на момент сбора данных.
Определение пропущенных данных
Все данные были тщательно изучены командой из четырех кардиологов. Любые разногласия относительно классификации симптома и/или заболевания рассматривались всей командой, и окончательные решения принимались консенсусом. Особое внимание уделялось определению изучаемых параметров, на основе которых предполагалось делать статистические выводы, если, по мнению исследователей, данных было недостаточно или они по каким-либо причинам могли быть недостоверными, эти результаты не включались в анализ. В отношении некоторых частотных параметров допускалось сохранение наблюдения для дальнейшего описания группы, если изучение частоты данного параметра не входило в основную гипотезу исследования.
Определения исследования
Хроническая сердечная недостаточность (ХСН) определялась в соответствии с рекомендациями. Решения о наличии симптомов и/или заболеваний были основаны на всей клинической информации, доступной каждому пациенту, и включали кодифицированный диагноз СН, ХБП и т.п.; описание серии медицинских осмотров в электронной медицинской карте; рентгенологические исследования (рентгенография грудной клетки и компьютерная томография); эхокардиографические исследования.
Классификация параметров систолической функции ЛЖ была основана на опубликованных рекомендациях Европейской ассоциации сердечно-сосудистой визуализации и Американского общества эхокардиографии. Классификация ХБП была основана на рекомендациях KDIGO.
Методы статистической обработки данных
Для статистической обработки полученных данных использовали язык R, программная среда – RStudio (пакеты tidyverse, ggplot2, ggpubr, PCAtools, ggfortify, googlesheets4). Нормальность распределения определялась с помощью критерия Шапиро–Уилка и Колмогорова–Смирнова, анализа значений асимметрии и экспресса, построением графиков qqplot и гистограмм распределения. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднего значения (M)±стандартное отклонение (S) или медианой, 25-м и 75-м перцентилями. При сравнении более двух категориальных переменных с непрерывными значениями использовался многофакторный дисперсионный анализ (ANOVA), при распределении непрерывных переменных приближавшийся к нормальному, в противном случае использовался его непараметрический аналог – тест Краскела–Уоллиса. Для сравнения двух групп применялся робастный тест при правильном распределении. Для сравнения результатов между независимыми неправильно распределенными выборками применяли критерий Манна–Уитни. Для сравнения категориальных переменных строились таблицы частот, впоследствии проверенные с помощью теста χ2. Для проведения кластерного анализа использовался анализ иерархической кластеризации с последующим построением тепловых карт. При проверке статистических гипотез нулевую гипотезу отвергали при уровне значимости менее 0,05.
Результаты
Клиническая характеристика групп, описание симптомов и наличие сопутствовавших заболеваний представлены в табл. 1 и 2. Каких-либо значимых различий в группах не наблюдалось, за исключением уровня СКФ на момент включения пациентов в исследование (в группе, перенесшей COVID-19, – 71,5±19,7 и 58,4±18,6 в группе без COVID-19; p=0,037), при этом в последующие годы данные различия исчезают. Группы были сопоставимыми по возрасту, полу, сопутствовавшим заболеваниям. При изучении симптомов были найдены значимые различия только в наличии симптома бендопноэ (p-value=0,015) и шанс заболевания COVID-19 был выше в группе пациентов с симптомом бендопноэ (ОШ=5,8 [1,2; 26,7]).
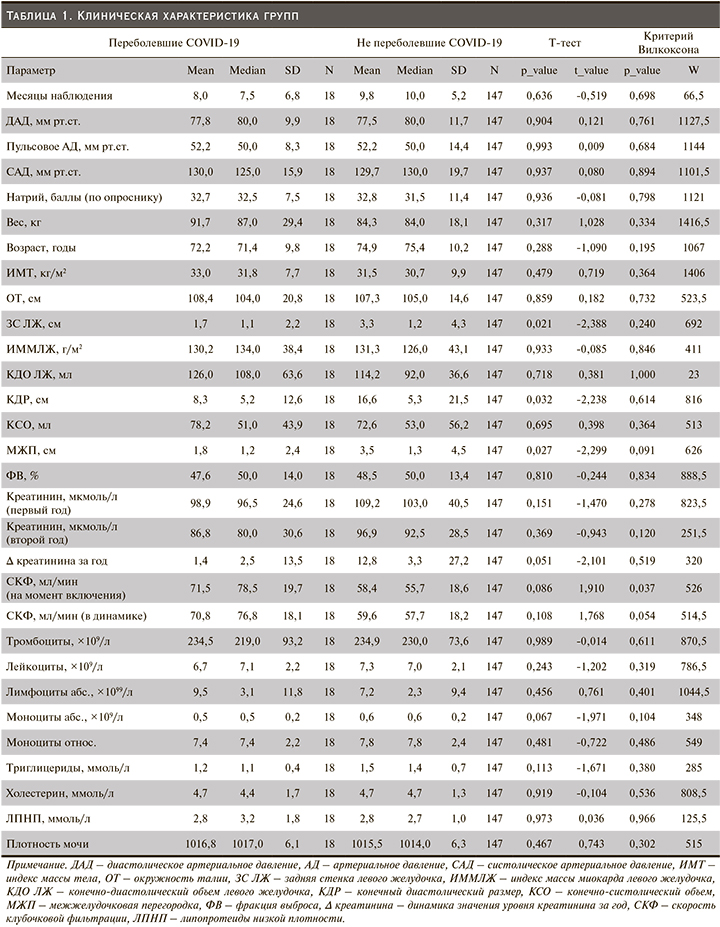
На первом этапе анализа был проведен кластерный анализ для лучшего понимания внутригрупповой структуры пациентов и изученных у них предикторов.
Методика проведения кластерного анализа
На первом этапе были оценены все числовые предикторы, которые могли быть включены в проведение кластерного анализа на предмет пропущенных значений, все предикторы, которые имели более 70% пропущенных значений по всей выборке, были исключены из анализа данных. После проведения первого этапа анализа были исключены дублирующиеся предикторы, по мнению исследователей, указывавшие на одни и те же признаки (например, моноциты, измеренные в абсолютной и относительной шкале). В дальнейшем все числовые предикторы были нормированы в одну шкалу, оставшиеся пропущенные значения были заменены медианными по данному показателю. Методом к-средних были выделены три основных кластера. Результаты представлены на тепловой карте (рис. 1) в шкале от -3 (крайне низкие значения) и 3 (крайне высокие значения), также выделены пациенты с положительным статусом COVID-19.
В первый кластер были включены 89 (53,9%) пациентов, во второй и третий – 35 (21,2%) и 41 (24,8%) соответственно. В основном пациенты, перенесшие COVID, попали в первый кластер (12 пациентов), во втором кластере оказался всего 1 пациент, в третьем – 5, однако различий по данному показателю выявлено не было (X-squared=3,1, df=2, p-value=0,22).
Характеристика кластеров
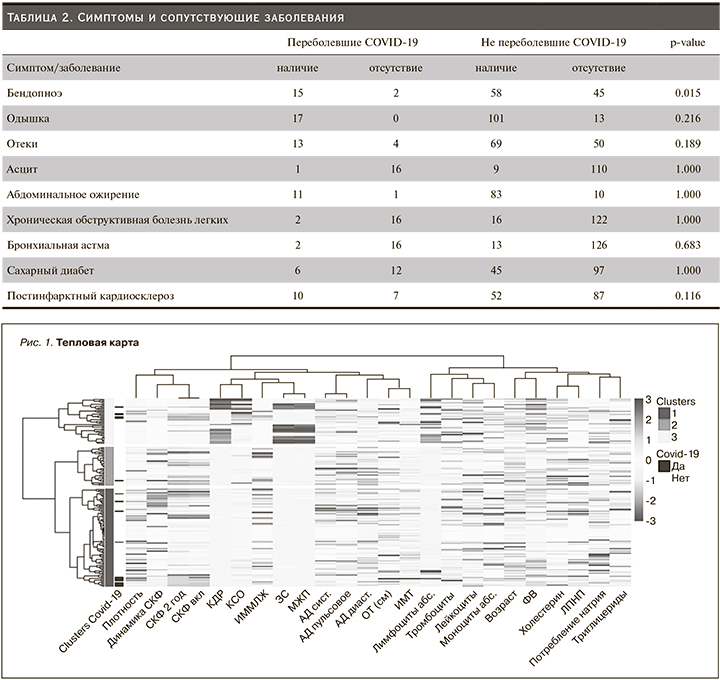
Основные описательные статистики представлены в табл. 3. Анализ характеристики сформированных кластеров по тепловой карте может привести к выводу, согласно которому для кластера 2 характерна более низкая СКФ на протяжении всего периода наблюдения, а также отрицательная динамика показателей СКФ (45 [38,35;57,65] мин/мин) в течение года, что позволило выделить пациентов с ХБП в отдельный кластер (рис. 2).
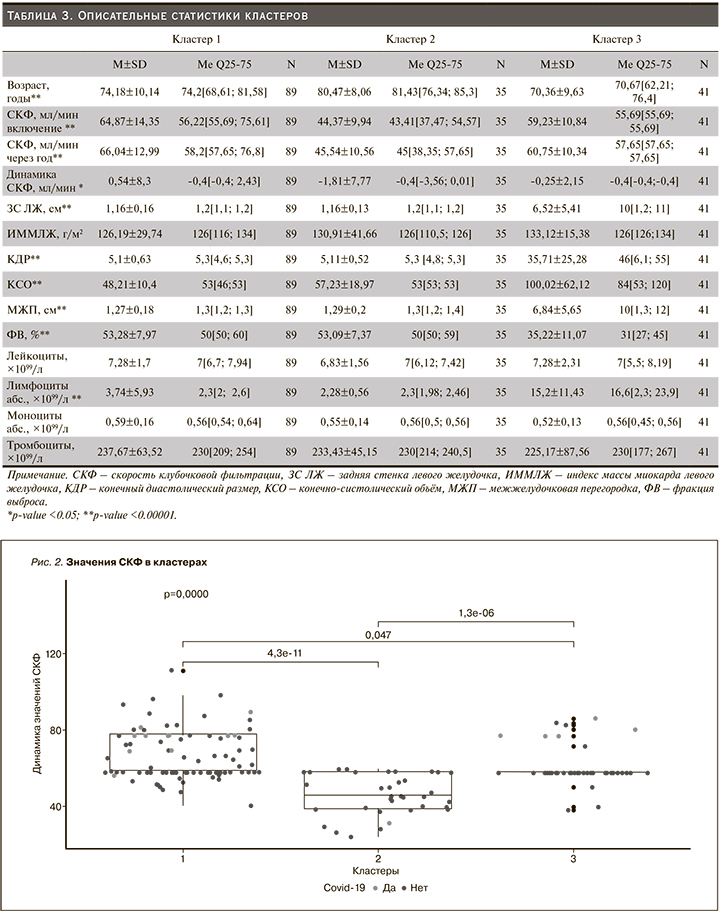
И такой показатель, как динамика снижения СКФ -0,4[-3,56; 0,01] (медианная разность между СКФ на момент включения и через год), наибольшим образом отличается от такового кластера 1, где наблюдается положительная динамика СКФ. Для кластера 3 характерны изменения показателей Эхо-КГ сердца, демонстрировавшие более высокие значения КСО, КДР, ЗС, МЖП и более низкую ФВ (рис. 3), чем в других кластерах, что позволило сделать акцент на пациентах с тяжелой ХСН в этом кластере. Первый кластер представлен остальными пациентами.
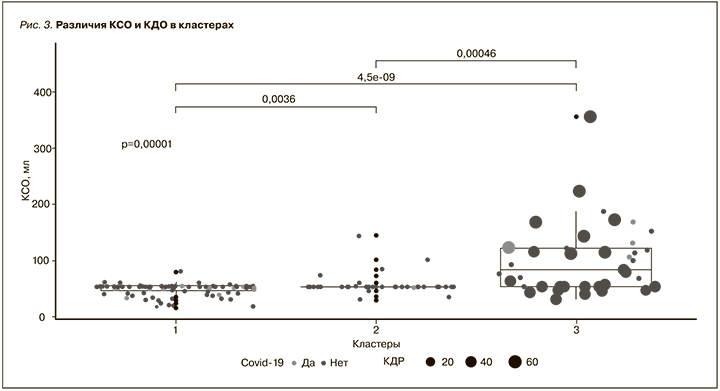
Особого внимания заслуживают пациенты, отнесенные к 3-му кластеру, где выявлено превалирование мужского пола над женским, тогда как в других кластерах наблюдается обратная тенденция (p<0,0001), где пациентов более молодого возраста (70,36±9,63 года), но с наиболее значимыми отличиями показателей Эхо-КГ (p<0,0001), при этом с большей частотой встречаемости ПИКС в данном кластере выявлено не было. А также интересной находкой при анализе этого кластера было выявление более высоких значений уровня лимфоцитов 15,2±11,43 (p-value<0,00001).
Таким образом, несмотря на высокий потенциальный риск заболевания и/или смерти от COVID-19, в кластерах 3 и 2 (т.е. в группах тяжелых пациентов с выраженной сердечной недостаточность и ХБП соответственно) увеличения заболеваемости и/или смертности от COVID-19 выявлено не было. Напротив, частота заболеваемости в кластере 1, который по основным показателям включил пациентов с более благоприятными клиническими показателями, была выше, однако она не достигла статистической значимости p=0.222. По-видимому, это связано с большей мобильностью пациентов данной категории пациентов по сравнению с пациентами кластеров 2 и 3.
Обсуждение
Ранее проведенные исследования показали, что в период вирусных эпидемий возрастает количество вновь выявленных миокардитов, кардиомиопатий и случаев ХСН [3]. Таким образом, вполне естественно увеличение сердечно-сосудистых событий и в период эпидемии COVID -19. Так, в проспективном когортном исследовании, выполненном на 179 пациентах с пневмонией COVID-19, обнаружено, что уровень сердечного тропонина I ≥ 0,05 нг/мл был связан с повышенной смертностью (HR=4,077, 95% ДИ: 1,166 14,253; p<0,001) [4]. При этом важно отметить, что уровень тропонина может быть повышен и у пациентов с COVID и почечной недостаточностью [5]. Таким образом, присутствует связь между риском повреждения миокарда, почечной недостаточностью и COVID-19. В нашем исследовании первоначальной также была гипотеза о более высоком риске заражения и смертности от COVID среди пациентов с ХСН и высокими стадиями ХБП. С этой целью нами был проведен кластерный анализ для выявления основных паттернов в общей группе исследования, по результатам которого были выделены пациенты с более выраженным поражением в первую очередь сердца и почек, а также выделена общая группа, по сравнению с двумя другими кластерами имевшая более легкое течение ХСН и ХБП. Но, несмотря на это, количество зараженных в кластерах 2 и 3 статистически значимо не отличалось от такового кластера 1.
По-видимому, это было прежде всего связано с меньшей мобильностью пациентов этой группы пациентов по сравнению с кластером 1, в котором оказались пациенты с относительно легким течением как ХСН, так и ХБП. В исследовании Rey et al. (2020) [6], проведенном на когорте пациентов с подтвержденной инфекцией COVID-19 и ХСН (n=3080), было выявлено, что эти пациенты имеют больший риск декомпенсации ХСН, чем таковые контрольной группы. В нашем исследовании группы пациентов с COVID-19 и ХСН отличались от контрольной группы наличием симптома бендопноэ (ОШ=5,8 [1,2; 26,7]), p-value=0,015), наличие которого ассоциировано с большим риском декомпенсации ХСН и госпитализаций, что сопоставимо с результатами ранее проведенных исследований [7, 8].
Таким образом, несмотря на высокий риск, присутствовавший в кластерах 3 и 2, т.е. у пациентов с выраженной сердечной недостаточностью и выраженной ХБП, они не имели значимого увеличения риска заболевания и/или смерти от COVID-19, тогда как наличие симптома бендопноэ у этой когорты пациентов оказалось предиктором декомпенсации сердечной недостаточности.
Ограничение исследования
Исследование относится к категории ретроспективных, таким образом, несмотря на случайное включение пациентов в первичную базу данных, возможно было смешение первично исследуемой выборки. Также следует отметить небольшое число пациентов с COVID-19.

