Введение
Коронавирусная инфекция является чрезвычайно актуальной проблемой здравоохранения в силу высокого уровня заболеваемости, превосходящего уровень других инфекционных патологий [1, 2]. Практически каждый человек подвергается риску COVID-19 (Cоrona Virus Disease 2019) и его осложнениям [3–5]. Хотя анализ летальных случаев среди госпитализированных больных с лабораторно подтвержденным диагнозом COVID-19 показал, что в структуре осложнений превалируют поражения легких, печени и почек [6], тем не менее встречаются также поражения сердечно-сосудистой системы, головного мозга, желудочно-кишечного тракта, кожи и других органов [7, 8]. Накопленные данные свидетельствуют, что прогрессирующее системное воспаление при COVID-19 приводит к развитию синдрома множественной дисфункции органов, в т.ч. артериальной гипотензии, связанной с расширением сосудов и гиповолемическим шоком [9]. В результате либо возникает дисфункция почек, либо усугубляется течение хронической болезни почек (ХБП).
Цель исследования. Оценить функциональное состояние почек, уровни Д-димера и прокальцитонина у больных новой коронавирусной болезнью (COVID-19).
Материал и методы
Исследование имело одномоментный (поперечный) сравнительный дизайн и выполнялось на базе Национального госпиталя (НГ) при МЗ КР. В анализ включали клинико-лабораторные данные 123 больных, находившихся в Карантинно-казарменном стационаре инвалидов отечественной войны НГ МЗ КР с 9 по 23 октября 2020 г. Средний возраст обследованных больных составил 59,2±11,0 лет (мужчин 59, женщин 64). Во всех случаях верификация диагноза COVID-19 осуществлялась на основе теста полимеразной цепной реакции (ПЦР) на коронавирус, сбора эпидемиологических и клинических данных. Общеклиническое обследование больных включило измерение систолического и диастолического артериального давления, частоты сердечных сокращений (ЧСС), роста, массы тела и определение индекса массы тела (ИМТ). Инструментальная часть исследования включила определение степени сатурации крови кислородом (SрO2), проведение компьютерной томографии и/или рентгенографии легких. Лабораторная часть исследования включила оценку концентрации гемоглобина (Hb, г/л), гематокрита (Ht,%), числа эритроцитов (×1012/л) и тромбоцитов (×109/л). Анализировали содержание Д-димера, прокальцитонина, мочевины, остаточного азота, С-реактивного белка (СРБ) и глюкозы крови. Верхние границы нормы для Д-димера и прокальцитонина составили 0,5 мг/л и 0,5 нг/мл соответственно. У всех больных оценивали скорость клубочковой фильтрации (СКФ) на основе уровня креатинина крови по формулам CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [10] и MDRD (Modification of Diet in Renal Disease) [11]. Дополнительно изучали клиренс креатинина по методике Cockcroft-Gault [12]. Наличие протеинурии оценивали в разовой порции утренней мочи.
Статистическую обработку полученных данных осуществили с помощью пакета прикладных программ Statistica, версия 10.0, и EXCEL 2013. Данные представлены в виде М±SD, где М – среднее арифметическое, SD – стандартное отклонение. При установлении непараметрического распределения показателей данные представлены как медиана, 25–75-й процентили. Корреляционную зависимость рассчитывали по методу Спирмена. Различия считались статистически достоверными при р<0,05.
Результаты
В проведенном исследовании превалировали лица среднего и пожилого возраста (26,8 и 51,2% соответственно). Как показано в табл. 1, доля больных молодого и старческого возраста была малочисленной.

Среднее значение SрO2, в покое на атмосферном воздухе свидетельствовало о наличии дыхательной недостаточности, что сопровожадалось ростом ЧСС (91,39±6,57 в минуту).
В 29,2% случаев, что составило 36 человек, отмечалось снижение SрO2,<90%. Средняя величина ИМТ у участников исследования равнялась 27,8±5,2 кг/м2. В момент поступления в стационар у 63 (51,2%) больных ПЦР-тест на коронавирус дал отрицательные результаты. Средние показатели гемодинамики, периферической крови, остаточного азота, мочевины и креатинина крови не превышали референсных значений.
У 109 (88,6%) больных COVID-19 концентрация СРБ была повышенной (>6 мг/л). Высокие уровни Д-димера и прокальцитонина крови выявлялись у 59 (47,9%) и 61 (49,5%) больных соответственно. Как видно из рис. 1, в нозологической структуре больных COVID-19 сопутствующими заболеваниями были артериальная гипертензия (АГ), сахарный диабет (СД) 2 типа, стабильные формы коронарной болезни сердца (КБС) и коморбидная патология. При лабораторном обследовании в момент госпитализации больных COVID-19 часто выявлялись анемический синдром (Hb<130 г/л, Ht<39%, эритроциты <4,0 млн/мкл у мужчин; Hb<120 г/л, Ht<36%, эритроциты <3,8 млн/мкл у женщин), гипергликемия (гликемия ≥5,6 ммоль/л) и протеинурия (концентрация белка в разовой порции утренней мочи >0,1 г/л).
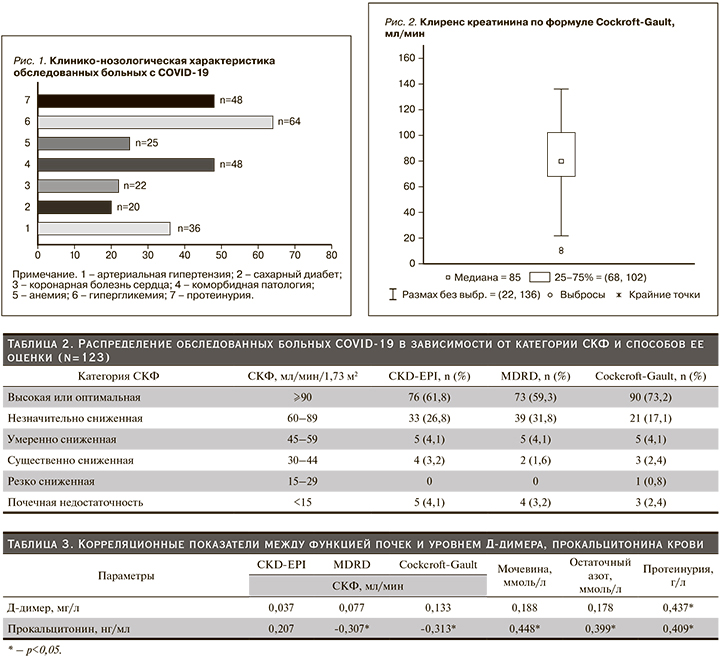
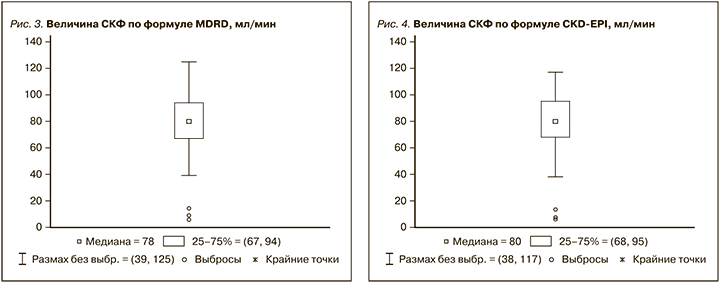
Анализ выделительной функции почек показал следующее (рис. 2–4): клиренс креатинина по методике Cockcroft-Gault – 85 (68,0–102) мл/мин, по формуле MDRD – 78 (67,0–94,0) мл/мин и 80 (68,0–95,0) мл/мин – по формуле CKD-EPI. Как и следовало ожидать, численность больных COVID-19, имевших оптимальную функцию почек, была больше при расчете СКФ по методике Cockcroft-Gault (табл. 2).
Наоборот, формула MDRD показала заниженное число больных COVID-19, имевших оптимальную функцию почек. Примечательно, что доля больных COVID-19 и начальным снижением СКФ в трех подгруппах была схожей. Интересно отметить, что среди лиц с COVID-19 резко сниженная функция почек практически не выявлялась по формулам CKD-EPI и MDRD. В целом замедление СКФ<60 мл/мин по методикам CKD-EPI, MDRD и Cockcroft-Gault обнаружено соответственно у 14, 11 и 12 больных COVID-19.
При корреляционном анализе больных COVID-19 были обнаружены статистически значимые отрицательные связи между уровнями прокальцитонина крови и СКФ, рассчитанннными по формуле MDRD (r=-0,307; p<0,05) и Cockcroft-Gault (r=-0,313; p<0,05). Вместе с тем получена положительная зависимость протеинурии от концентрации Д-димера (r=0,437; p<0,05) и прокальцитонина (r=0,409; p<0,05) крови. Нужно подчеркнуть, что была обнаружена достоверная прямая взаимосвязь концентрации прокальцитонина с мочевиной (r=0,448; p<0,05) и остаточным азотом крови (r=0,399; p<0,05). Каких-либо тесных связей концентрации Д-димера с уровнями СКФ, рассчитанными по CKD-EPI, MDRD, Cockcroft-Gault, а также мочевины и остаточного азота крови выявлены не были (табл. 3).
Обсуждение
Распространение инфекции, вызванное коронавирусом, быстро приобрело характер пандемии. На текущий момент число зараженных в мире превысило 55,6 млн человек. Клинические варианты и проявления COVID-19 варьируются от острой респираторной вирусной инфекции до сепсиса и инфекционно-токсического шока. Клетками-мишенями для коронавируса являются клетки эндотелия сосудов различных органов [2, 4, 5, 8]. Поражению почек при COVID-19 способствуют уровень вирусной нагрузки, системное воспаление, гипоксия, артериальная гипотензия, нерациональное использование фармакологических препаратов и сопутствующие заболевания. В ходе проведенного нами исследования (рис. 1) у больных COVID-19 сопутствующими заболеваниями оказались АГ, СД 2 типа, КБС, анемия и коморбидная патология. Согласно результатам клинических работ, среди больных COVID-19 чаще всего встречались АГ, КБС и СД 2 типа [9]. Именно сопутствующие заболевания и возраст больных вносят наибольший вклад в увеличение смертности от COVID-19. В многочисленных клинических исследованиях установлено, что СД 2 типа и увеличение массы тела относятся к факторам риска тяжелого течения COVID-19 [13, 14]. Как показано (табл. 1), среди участников нашей работы превалировали лица пожилого (51,2%) и старческого (12,2%) возраста. Общеизвестно, что распространенность АГ, СД и КБС увеличивается с возрастом. В упомянутом исследовании подчеркнуто, что риск развития острого респираторного дистресс-синдрома при COVID-19 выше у людей старше 40 лет [9].
Гипоксия. SрO2<90%, по данным пульсоксиметрии, на атмосферном воздухе считается признаком дыхательной недостаточности, и она имела место у 36 (29,2%) обследованных нами больных COVID-19 (табл. 1). Гипоксию можно рассматривать как фактор, вызывающий нарушение упруго-эластических свойств сосудов и начало эндотелиальной дисфункции.
В условиях гипоксии содержание эндотелиальной NO-синтазы в сосудах легких снижается, развивается дефицит эндотелиального оксида азота, что способствует вазоконстрикции и возникновению микроциркуляторных расстройств [15].
У больных COVID-19 гипоксия активирует гиперпродукцию провоспалительных цитокинов, тем самым усиливая системное воспаление [16]. Со стороны почек при гипоксии наблюдается увеличение резистентности ренальных (долевых, сегментарных) артерий. В результате гипоксемии в почках происходит локальное увеличение синтеза эндотелина-1, который, являясь вазоконстриктором, вызывает повышение периферического сосудистого сопротивления, снижение ренального кровотока и уменьшение СКФ. В рамках нашего исследования был проведен сравнительный анализ показателей СКФ, рассчитанных по разным методикам (рис. 2–4). Так, численность больных по категориям снижения СКФ, рассчитанным по формулам CKD-EPI и MDRD, существенно не различалась (табл. 2). Между тем клиренс креатинина по методике Cockcroft-Gault показал, что численность больных COVID-19, имеющих оптимальную функцию почек, была больше. Данные литературы по оценкам функции почек с использованием расчетных методов неоднозначны. Ухудшение ренальной функции при COVID-19 и риски хронизации патологического процесса в почках становятся объектом изучения исследователей и клиницистов. С позиции патофизиологии COVID-19, хотя она до конца еще не изучена, можно отметить, что на суммарную азотовыделительную функцию почек оказывают влияние множество факторов. Среди них важная роль отводится персистенции гипоксемии. Так, спазм интерстициальных капилляров способствует развитию эндотелиальной дисфункции. Во многих исследованиях установлено, что гипоксия ткани почек инициирует избыточную (локальную) активность ренин-ангиотензин-альдостероновой системы (РААС). В свою очередь гиперактивация РААС замедляет доставку кислорода в ткань почки из-за своего выраженного сосудосуживающего действия, а также способствует развитию в клетках канальцев окислительного стресса, повышающего потребление кислорода клеточными митохондриями. Механизмы развития и прогрессирования гипоксического гломерулосклероза и тубулоинтерстициального фиброза детально изложены в обзорном исследовании О.Б. Кузьмина [17].
Д-димер. В наши дни наиболее специфичным маркером деградации фибриновых сгустков любой локализации является Д-димер. В норме эндотелиальные клетки сосудов обладают высокой антикоагулянтной, антиагрегационной и фибринолитической активностью. У больных COVID-19 регистрируется снижение антитромбогенной активности сосудистой стенки, в результате чего риск развития венозной тромбоэмболии возрастает. В частности, повышение концентрации Д-димера и СРБ сопровождается повышением риска тромбоэмболических событий. Роль СРБ как неспецифического маркера воспаления и риска атеротромботических осложнений известна давно. Многими исследователями установлено, что у больных, умерших от COVID-19, при аутопсии выявлялись тромбы в крупных сосудах легких, а также тромбы с большим количеством тромбоцитов в микроциркуляторном русле легких и других органов [18–20]. У больных COVID-19 часто повышен уровень Д-димера, высокая концентрация которого является предиктором смерти [21–23]. Так, по данным когортных исследований из Китая, установлено, что у больных COVID-19, нуждающихся в госпитализации, повышение концентрации Д-димера >1 мг/л была связана с многократным увеличением риска смерти [24]. С практической точки зрения нужно сказать, что повышение уровня Д-димера в 3–4 раза у больного COVID-19 служит показанием к госпитализации [21–23]. По данным отдельных исследований, повышение концентрации Д-димера было обнаружено у 46% больных COVID-19 [25]. Нарастание концентрации Д-димера в плазме крови во время госпитализации может предсказать возникновение полиорганной дисфункции, в т.ч. развитие острого повреждения почек. С другой стороны, повышение концентрации Д-димера на момент поступления в стационар может указывать на повышенный риск смерти больного COVID-19. Стоит отметить, что в нашем исследовании не удалось установить связь между концентрацией Д-димера и величиной расчетной СКФ.
В проведенном нами исследовании повышение концентрации Д-димера выявлялось у 47,9% больных COVID-19 (табл. 1). Вместе с тем отмечалась прямая связь между ростом уровня Д-димера и риском развития протеинурии (r=0,437; p<0,05, табл. 3). Возможно, что тромбоз микроциркуляторного русла почек, системное воспаление и гипоксия провоцируют протеинурию у больных COVID-19. Хотя считается, что при осложненном течении COVID-19 наблюдается инвазия вируса в эпителий канальцев почек. Кроме того, протеинурия связана с выраженной эндотелиальной дисфункцией сосудов почек и индукцией агрегации тромбоцитов, т.к. эндотелий несет на себе рецепторы ангиотензинпревращающего фермента и служит мишенью для вируса. Немаловажно отметить, что лица с ХБП склонны к развитию частых инфекций и тромбообразованию, которые создают дополнительные источники воспалительного процесса.
Прокальцитонин. По рекомендации ВОЗ от 2019 г., прокальцитонин признан единственным маркером, рекомендованным в качестве вспомогательного теста для решения вопроса о необходимости назначения антибактериальной терапии и контроля ее эффективности [26]. Как отмечено в публикации А.М. Чомахидзе и соавт., у здоровых людей прокальцитонин в плазме либо не определяется, либо его концентрация составляет 0,05–0,1 нг/мл [27]. Следует помнить, что у больных COVID-19 и системным воспалением часто наблюдается повышение концентрации прокальцитонина крови. Здесь уместно будет отметить, что при COVID-19 повышение уровня прокальцитонина предшествует гиперпродукции провоспалительных цитокинов, таких как интерлейкин-6 и фактор некроза опухоли α (ФНО-α) [28]. В предыдущих исследованиях мы сообщали, что фактор ФНО-α является значимым цитокином, оказывающим влияние на показатели фильтрационной функции почек и протеинурии [29, 30]. Как продемонстрировано в табл. 1, повышение концентрации прокальцитонина в нашей работе обнаружено у 61 (49,5%) человека. Важно помнить, что при вирусных инфекциях и в составе воспалительного ответа уровень прокальцитонина крови повышается слабо, редко достигая 1 нг/мл. Однако уровень прокальцитонина крови позволяет дифференцировать наличие суперинфекции при COVID-19. В отличие от других маркеров воспаления оценка уровня прокальцитонина крови более чувствительна и высокоспецифична для тяжелой бактериальной инфекции. Стоит подчеркнуть, что в нашем исследовании (табл. 3) повышение концентрации прокальцитонина крови сопровождалось замедлением расчетной СКФ только по формуле MDRD (r=-0,307; p<0,05) и клиренсу креатинина по методике Cockcroft-Gault (r=-0,313; p<0,05). У больных COVID-19 воспалительный процесс не только сопровождается повышением концентрации прокальцитонина крови, но и обусловливает развитие эндотелиальной дисфункции и увеличение проницаемости клубочкового барьера. Подтверждением могут служить результаты корреляционного анализа (табл. 3), где выявлена положительная связь между уровнем прокальцитонина крови и протеинурией (r=0,409; p<0,05). Как уже было сказано, уровень прокальцитонина повышается в ответ на провоспалительный стимул, особенно бактериального происхождения.
Интересно отметить, в связи с этим одним из факторов, влияющих на уровень прокальцитонина в крови, является функциональное состояние почек. Имеются сведения, что снижение СКФ сопровождается достоверным увеличением концентрации прокальцитонина в крови даже в отсутствие системного воспаления [31]. Связь между СКФ и уровнем маркеров воспаления является хорошо доказанным фактом. Нужно подчеркнуть, что достоверная прямая корреляция уровня прокальцитонина была зарегистрирована с концентрацией мочевины (r=0,448; p<0,05) и остаточным азотом крови (r=0,399; p<0,05). Эти данные вполне согласуются с тем, что по мере прогрессирования COVID-19 и полиорганной дисфункции концентрация прокальцитонина повышается [28]. По-видимому, различные биомаркеры воспаления при COVID-19 имеют разное прогностическое значение. Известно, что в печени аммиак, соединяясь с углекислым газом, образует мочевину. Быстрое разрушение белков и повреждение почек стремительно поднимают уровень мочевины в крови. Можно полагать, что при COVID-19 прогрессирующее системное воспаление сопровождается повышением уровня прокальцитонина крови, который является индикатором бактериальной инфекции, с одной стороны, и маркером снижения функции почек (рост концентрации мочевины), с другой. Роль повышения содержания остаточного азота мочевины в крови в качестве маркера функции почек в настоящее время хорошо изучена. Исследование той роли, которую отдельные маркеры воспаления, а также функции почек играют при COVID-19 и ХБП, продолжается.
Заключение
Таким образом, у обследованных нами больных COVID-19 незначительное снижение функции почек выявлено в 26,8% случаев, умеренное – в 4,1%, существенное – в 3,2% и почечная недостаточность – в 4,1% случаев. Признаки поражения почек (протеинурия) отмечались у 39,0% участников исследования. У 47,9% больных COVID-19 обнаружено повышение концентрации Д-димера и у 49,5% – прокальцитонина. Лабораторным предиктором ухудшения функции почек у больных COVID-19 является уровень прокальцитонина крови. У больных COVID-19 риск появления протеинурии тесно связан с концентрацией Д-димера крови.

