Введение
Совершенствование методов инсулинотерапии и внедрение современных технологий в лечение сахарного диабета 1 типа (СД1) привели к значимому сокращению частоты острых осложнений заболевания и увеличению продолжительности жизни пациентов. Тем не менее рост распространенности и сохранение прогрессирующего характера течения заболевания приводят к высокой инвалидизации и преждевременной смертности среди данной группы пациентов. Как и в общей популяции, сердечно-сосудистые заболевания (ССЗ) служат одной из лидирующих причин смерти при СД1 [1]. Суммарно хроническая сердечно-сосудистая недостаточность, нарушения мозгового кровообращения, инфаркт миокарда и острые сердечно-сосудистые нарушения стали причиной смерти 31,9% пациентов с СД1 [2]. Острые осложнения СД1, такие как диабетический кетоацидоз и гипогликемия, с большей вероятностью приводят к смерти более молодых пациентов, тогда как ССЗ начинают преобладать в структуре смертности по мере того, как пациенты становятся старше [3]. Поскольку ожидаемая продолжительность жизни при СД1 в последние десятилетия постоянно увеличивается, смертность от ССЗ при СД1 может постепенно сравняться с таковой при сахарном диабете 2 типа (СД2). Хотя существует множество исследований, описывающих связь между ССЗ при СД2, СД1 в этом плане изучен гораздо меньше, хотя существуют доказательства того, что относительный риск ССЗ у пациентов с СД1 примерно в 10 раз выше, чем в общей популяции [4]. Поэтому в настоящее время представляет интерес оценка сердечно-сосудистой системы и классических факторов риска ССЗ именно при СД1.
К моменту постановки диагноза у половины всех пациентов с СД2 обнаруживаются признаки т.н. поздних осложнений [5]. СД1, напротив, диагностируется в гораздо более молодом возрасте и практически сразу после реальной манифестации заболевания, которая чаще всего протекает клинически ярко, что дает больше возможностей для модификации факторов риска и предотвращения сердечно-сосудистых осложнений. Это особенно важно, поскольку ожидаемая продолжительность жизни пациентов с СД1 достаточно велика, при этом ССЗ развиваются на 10–15 лет раньше, чем в контрольной группе [6]. Прогнозирование риска помогает идентифицировать пациентов с высокой вероятностью развития ССЗ в будущем.
 Помимо ССЗ пациенты с СД1 подвержены высокому риску развития микрососудистых осложнений, клинически наиболее важная из которых прогрессирующая диабетическая нефропатия (ДН) с развитием терминальной стадии заболевания почек. Важно отметить, что сочетание СД и нефропатии увеличивает риск ССЗ в 20–40 раз [7]. Известно, что пациенты с ДН имеют более высокие показатели ССЗ и смертности, чем пациенты без ДН [8]. Ретроспективный анализ трех крупных клинических исследований показал, что альбуминурия определяет не только почечные, но и сердечно-сосудистые исходы [9–11].
Помимо ССЗ пациенты с СД1 подвержены высокому риску развития микрососудистых осложнений, клинически наиболее важная из которых прогрессирующая диабетическая нефропатия (ДН) с развитием терминальной стадии заболевания почек. Важно отметить, что сочетание СД и нефропатии увеличивает риск ССЗ в 20–40 раз [7]. Известно, что пациенты с ДН имеют более высокие показатели ССЗ и смертности, чем пациенты без ДН [8]. Ретроспективный анализ трех крупных клинических исследований показал, что альбуминурия определяет не только почечные, но и сердечно-сосудистые исходы [9–11].
Несмотря на то что существуют специальные методы оценки риска ССЗ у пациентов с СД2, для СД1 они до недавнего времени отсутствовали. Разработанная шкала Steno T1D Risk Engine для расчета 5- и 10-летнего риска учитывает следующие факторы риска: возраст, пол, длительность СД, систолическое артериальное давление (САД), холестерин липопротеидов низкой плотности (ЛПНП), гликированный гемоглобин (HbA1c), альбуминурия, скорость клубочковой фильтрации (СКФ), курение и регулярные физические упражнения. Другой моделью прогнозирования 5-летнего риска ССЗ у пациентов с СД1 является шкала Swedish T1D risk score, использующая следующие параметры: возраст, длительность СД, уровни общего холестерина, ЛПВП, HbA1c, САД, курение, наличие макроальбуминурии и предшествующие сердечно-сосудистые события (рис. 1) [12].
Цель: провести оценку методов прогнозирования сердечно-сосудистого риска у пациентов с СД1.
Материал и методы
В одномоментное исследование были включены 176 пациентов с СД1: 55 (31,25%) мужчин и 121 (68,75%) женщина с длительностью заболевания от 1 месяца до 43 лет.
 Критерии включения в исследование: подтвержденный диагноз СД1, возраст от 18 до 70 лет.
Критерии включения в исследование: подтвержденный диагноз СД1, возраст от 18 до 70 лет.
Критерии исключения: беременность и лактация.
Характеристика пациентов представлена в табл. 1.
В ходе исследования была проведена оценка функционального состояния почек (суточная альбуминурия; СКФ, рассчитанная по формуле CKD-EPI), выполнен расчет сердечно-сосудистого риска с использованием шкал, разработанных для пациентов с СД1 (Steno T1 Risk Engine, Swedish T1D risk score). В ходе исследования оценивали возраст, пол, стаж заболевания и HbA1c, САД, холестерин ЛПНП, холестерин липопротеидов высокой плотностти (ЛПВП), альбуминурию, СКФ, курение, регулярность физических нагрузок и анамнез предшествовавших сердечно-сосудистых событий.
 Проводилась оценка 5- и 10-летнего риска ССЗ по шкале Steno T1 Risk Engine и 5-летнего риска по шкале Swedish T1D risk score. Трактовка полученных данных представлена в табл. 2.
Проводилась оценка 5- и 10-летнего риска ССЗ по шкале Steno T1 Risk Engine и 5-летнего риска по шкале Swedish T1D risk score. Трактовка полученных данных представлена в табл. 2.
Статистическая обработка данных проводилась с использованием ПО Statistica 8.0. Для количественных признаков с нормальным распределением использовались среднее и стандартное отклонения среднего значения.
Описание количественных признаков с ненормальным распределением проводилось с указанием медианы, нижнего и верхнего квартилей. Связь между двумя показателями оценивалась с использованием корреляционного анализа методом Спирмена.
Результаты
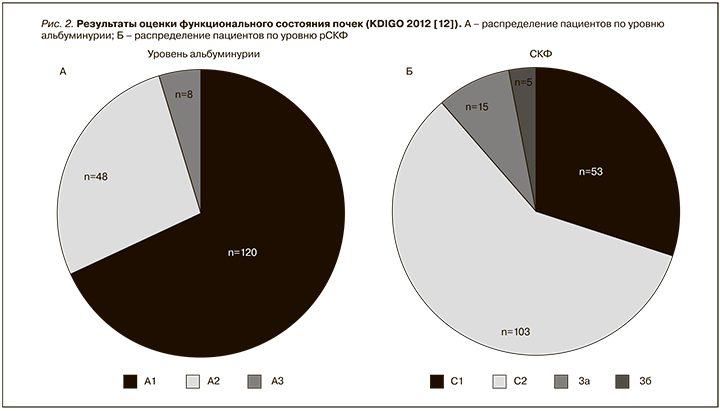
При оценке функционального состояния почек медиана альбуминурии в группе составила 25,5 мг/сут. [Q1–Q3: 15,0–36,5 мг/сут.]. При этом у большей части микро- и макроальбуминурия отсутствовала (А1) (рис. 2А). Уровень рСКФ в группе пациентов в среднем составил 80,55±18,13 мл/мин/1,73 м2 и у большинства пациентов соответствовал стадии С2 хронической болезни почек (рис. 2Б).
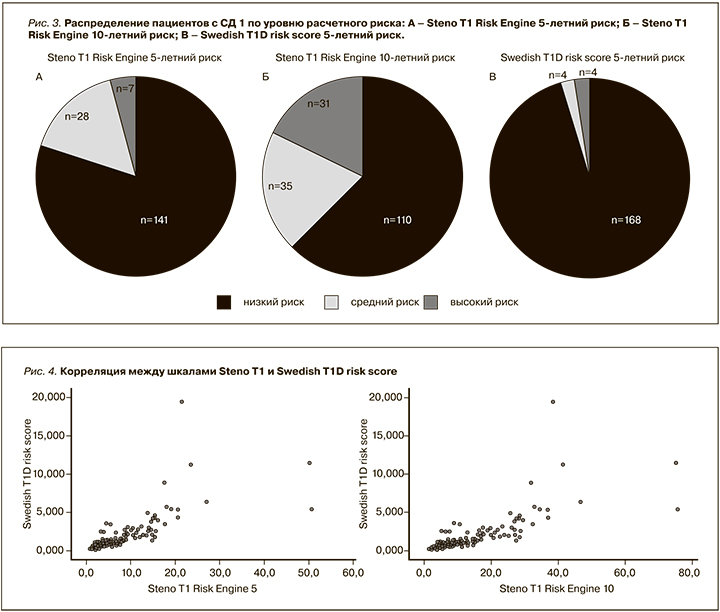
По шкале Steno T1 Risk Engine медиана риска ССЗ составила 3,7% [Q1–Q3: 2,1–8,0%] и 7,1% [Q1–Q3: 4,2–8,15%] для 5- и 10-летнего риска соответственно (рис. 3А и 3Б). При оценке по шкале, оценивающей 5-летний риск, медиана составила 0,93% [Q1–Q3: 0,50–1,79%] (рис. 3В). Таким образом, риск ССЗ в группе был оценен как низкий по обеим шкалам.
 По результатам статистического анализа установлены статистически значимые прямые корреляционные связи стадии альбуминурии и обратные корреляционные связи СКФ со шкалой Steno T1 Risk Engine при оценке 5-, 10-летнего риска развития ССЗ, а также со шкалой Swedish T1D risk. Полученные результаты представлены в табл. 3.
По результатам статистического анализа установлены статистически значимые прямые корреляционные связи стадии альбуминурии и обратные корреляционные связи СКФ со шкалой Steno T1 Risk Engine при оценке 5-, 10-летнего риска развития ССЗ, а также со шкалой Swedish T1D risk. Полученные результаты представлены в табл. 3.
Прослежена сильная положительная корреляция по шкале Чеддока между шкалами Steno T1 и Swedish T1D risk score (rxy=0,893; p<0,0001) (рис. 4).
Обсуждение
Разработанные для СД1 специфические шкалы, оценивающие сердечно-сосудистые риски, базируются помимо традиционных факторов риска ССЗ на оценке функции почек. По результатам проведенного исследования выявлена ассоциация прогрессирования альбуминурии и снижения СКФ с повышением риска развития ССЗ, рассчитанного по шкалам Steno T1 Risk Engine и Swedish T1D risk score. Поскольку наличие нефропатии у пациентов с СД – важный предиктор риска ССЗ, полученные результаты свидетельствуют о возможности использовать данные шкалы в клинической практике с целью оценки сердечно-сосудистого риска у пациентов с СД1.
Следует заметить, что корреляционная взаимосвязь сердечно сосудистого риска при СД1 значительно сильнее с уровнем СКФ по сравнению с выраженностью альбуминурии.
Набор параметров, необходимых для расчета сердечно-сосудистого риска в шкалах Steno T1 Risk Engine и Swedish T1D risk score, отличается. Учитывая выявленную по результатам проведенного исследования сильную корреляцию между шкалами, использование обоих инструментов в повседневной клинической практике равнозначно и взаимозаменяемо. Вопрос о предпочтительном использовании одной из шкал может быть решен на основании удобства применения.
В обеих шкалах расчета сердечно-сосудистого риска необходим учет возраста, пола пациента, стажа заболевания, уровня HbA1c и САД. Отличия состоят в использовании показателей липидного спектра (ЛПНП против общего холестерина и ЛПВП), а также детальности оценки функционального состояния почек. В случае Steno T1 Risk Engine необходим расчет СКФ и определение микроальбуминурии, тогда как в Swedish T1D risk score достаточно более грубой оценки поражения почек (наличие макроальбуминурии, которая может быть осуществлена с помощью рутинных методов обследования пациентов). Кроме того, при существующем ограниченном времени амбулаторного приема пациента оценка физической активности, необходимой для шкалы Steno T1 Risk Engine, потенциально более затратна, чем сбор анамнеза по предшествовавшим сердечно-сосудистым событиям для Swedish T1D risk score. Исходя из этого, использование шкалы Swedish T1D risk score представляется более рациональным, поскольку для ее расчета не требуется количественной оценки потери альбумина и расчет СКФ.
Заключение
Steno T1 Risk Engine и Swedish T1D risk score являются равнозначными шкалами для стратификации риска ССЗ у пациентов с СД1. Однако с учетом схожести параметров, необходимых для расчета риска по представленным шкалам, в реальной клинической практике целесообразным и более доступным представляется использование шкалы Swedish T1D risk score.
Несмотря на заметное увеличение ожидаемой продолжительности жизни, у пациентов с СД1 часто недооценивается повышенный риск развития ССЗ. Требуется дальнейшее изучение методов оценки сердечно-сосудистой системы для определения наиболее оптимального инструмента стратификации сердечно-сосудистого риска у пациентов с СД1.



