Введение
Белково-энергетическая недостаточность (БЭН) – состояние, неразрывно связанное с терминальной почечной дисфункцией и прогрессирующее по мере ее снижения. Распространенность БЭН при хронической болезни почек (ХБП) 4-й стадии составляет 21,3%, при ХБП 5-й стадии увеличивается до 74,5% [1] и наиболее часто встречается среди пациентов, получающих заместительную почечную терапию программным гемодиализом (ПГД), составляя 18–76% [2]. Развитие нарушений статуса питания у пациентов на ГД влияет не только на качество жизни, но и на ее продолжительность, что связано в т.ч. с потерей мышечной массы и прогрессированием сопутствующих заболеваний, в частности сердечно-сосудистой патологии [3].
Несмотря на то что применение заместительной почечной терапии уменьшает проявления уремии, системное воспаление, гормональный дисбаланс, дефицит витамина D, метаболический ацидоз, анемия и инсулинорезистентность, связанные с почечной недостаточностью, служат фактором риска развития БЭН [4]. Описанные факторы приводят к дисбалансу анаболических и катаболических внутриклеточных механизмов в пользу последних за счет активации внутриклеточных протеолитических систем. К одному из основных путей мышечного протеолиза у пациентов с почечной недостаточностью относится активация убиквитин-протеасомной системы [5], ключевыми регуляторами которой выступают миостатин (MSTN) и протеинкиназа-В (Аkt), обладающие антагонистическим действием [6]. MSTN рассматривается сегодня как естественный регулятор роста и развития мышц за счет своего ингибирующего влияния на дифференцировку сателлитных клеток и процессы синтеза мышечных белков [7]. Аkt является серин-треониновой протеинкиназой, которая выполняет интегративную роль, регулируя процессы синтеза и распада мышечных белков: ее высокие концентрации связаны с активацией транскрипционных факторов синтеза мышечных белков, таких как белки цитоскелета и миофибрилл, а также с активацией дифференцировки миобластов. При снижении Аkt наблюдается повышение экспрессии атрогенов – фактора протеолиза мышечной ткани, которые в свою очередь инициируют деградацию мышечных белков убиквитин-протеасомной системой. Ввиду того что MSTN реализует свое действие посредством подавления анаболической активности фосфорилированной Аkt [8, 9], научный интерес представляет изучение взаимосвязи обсуждаемых маркеров с развитием БЭН.
Цель. Оценить вклад MSTN и Аkt в развитие БЭН у пациентов с ХБП, получающих терапию ПГД.
Материал и методы
В исследование были включены 80 пациентов с ХБП 5-й диализной стадии, получавших заместительную почечную терапию; среди них 47 мужчин и 33 женщины, средний возраст которых составил 51,7±11,6 года, средняя продолжительность ПГД была 50,9±5,7 (0,5–236) месяца. Всем обследуемым были выполнены общеклинические и биохимические исследования, определены уровни MSTN и Аkt (ELISA Kit, США) в сыворотке крови с использованием иммуноферментного анализа. Стадия БЭН определялась с использованием комплексной методики G.L. Bilbrey и T.L. Cohen. Для оценки влияния системного воспаления на прогноз больного применялась модифицированная прогностическая шкала Глазго (mGPS).
Анализ полученных данных проходил с использованием пакета прикладных программ Statistica, 12.0 и Microsoft Office-2019. Корреляционный анализ осуществлялся с помощью коэффициента Пирсона при нормальном распределении выборки, при отличии от нормального – коэффициента Спирмена. Проводился линейный регрессионный анализ. При проведении сравнения двух независимых выборок применялся параметрический дисперсионный анализ ANOVA с проведением теста Levene и Braun–Forsite. Проводился анализ выживаемости по Kaplan–Majer. Различия считались статистически значимыми при p<0,05.
Результаты
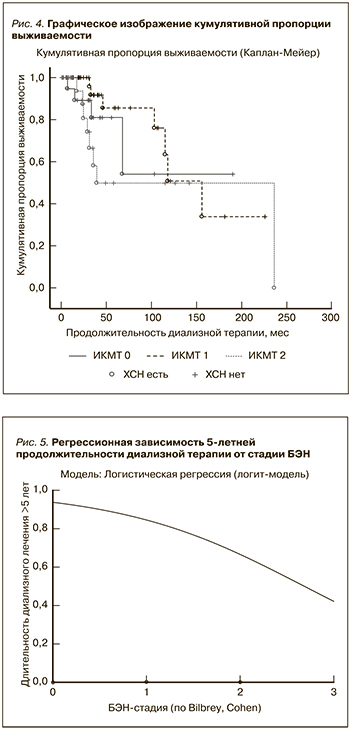
Распространенность БЭН в группе обследуемых пациентов составила 90% и была выявлена у 43 (53,75%) мужчин и 29 (36,25%) женщин. Из них у 22,5% женщин и 38,75% мужчин обнаружена I стадия, у 13,75% женщин и 13,75% мужчин – II; у 1,25% мужчин определилась III стадии БЭН. В обеих подгруппах нарушения нутритивного статуса отсутствовали в равном проценте случаев (5%).
В проведенном исследовании средний уровень MSTN составил 8,47±1,27 нг/мл: у мужчин – 8,57±1,33 (5,83–12,83), у женщин – 8,32±1,2 (5,39–10,91) , средняя концентрация Аkt – 3,15±2,15 нг/мл: у мужчин – 3,17±2,29 (0,08–11,64), у женщин – 3,13±2 (0,09–8,13).
Более высокие сывороточные концентрации MSTN имели место при труднокорригируемом железодефицитном состоянии, чаще связанном с анемическим синдромом, требующим регулярной терапии парентеральными формами препаратов железа (рис. 1).
 В то же время при анализе ANOVA в группе пациентов с более высоким уровнем Аkt отмечен более высокий уровень сывороточного железа (табл. 1), что, вероятно, подтверждает взаимосвязь регуляции мышечного метаболизма и обмена железа. Вместе с тем обнаружена обратная корреляционная связь Аkt и В2-микроглобулина, которая может косвенно свидетельствовать о влиянии системного воспаления, индуцированного уремией, на анаболические процессы в мышечной ткани (табл. 1).
В то же время при анализе ANOVA в группе пациентов с более высоким уровнем Аkt отмечен более высокий уровень сывороточного железа (табл. 1), что, вероятно, подтверждает взаимосвязь регуляции мышечного метаболизма и обмена железа. Вместе с тем обнаружена обратная корреляционная связь Аkt и В2-микроглобулина, которая может косвенно свидетельствовать о влиянии системного воспаления, индуцированного уремией, на анаболические процессы в мышечной ткани (табл. 1).
На основании известной биологической роли MSTN и Аkt в патогенезе развития БЭН, а также полученных данных нами был разработан индекс катаболизма мышечной ткани (ИКМТ), позволяющий демонстрировать взаимосвязь маркеров мышечного метаболизма с клинико-лабораторными параметрами, определяющими выраженность нутритивного дисбаланса. Предложенный нами ИКМТ представляет собой оригинальный способ прогнозирования не только БЭН, но в перспективе и саркопении у пациентов, получающих лечение ПГД. ИКМТ является инструментом качественной оценки динамики изучаемых маркеров мышечного обмена в обсуждаемой группе. Он ранжировался по выраженности и считался низким (0) при уровнях MSTN ниже медианы значений и высоких уровнях Аkt, что расценивалось нами как превалирование анаболических процессов; умеренным (1), когда уровни MSTN и Akt были сопоставимыми по значениям и соответствовали оптимальной регуляции обмена мышечной ткани; высоким (2) – при повышении уровня MSTN на фоне низкого содержания Аkt, что интерпретировалось нами как активация катаболических процессов (рис. 2).
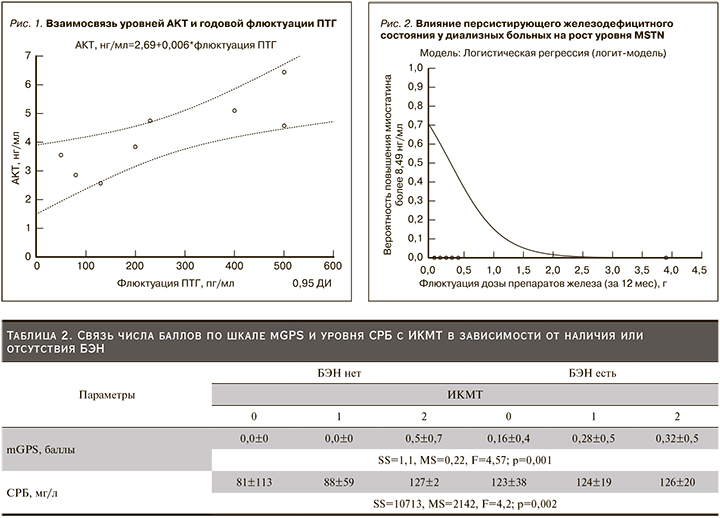
Нужно отметить, что значение ИКМТ влияло на вероятность развития БЭН: низкий ИКМТ повышал вероятность нарушений нутритивного статуса до 10% случаев, умеренный ИКМТ увеличивал риск развития БЭН до 18%, высокий ИКМТ – до 31% (χ2=3,67; р=0,048). Также на фоне прогрессирования БЭН отмечался прирост ИКМТ. Так, в отсутствие БЭН у пациента с ХБП-5Д повышение ИКМТ возникло в 21%, БЭН I стадии сопровождалась развитием метаболического дисбаланса в 62% случаев, БЭН II стадии повышала данный риск до 84%, в то время как тяжелый нутритивный дисбаланс в 93% случаев сопровождался увеличением ИКМТ (χ2=5,25; р=0,02).
Стоит отметить, что на предложенный индекс оказывал влияние уровень ферритина: его рост сопровождался увеличением ранга ИКМТ (χ2=3,8; р=0,04), что, по всей видимости, объясняется участием ферритина в воспалительном ответе. Прямая корреляционная связь ИКМТ и системного воспаления также была подтверждена увеличением уровней С-реактивного белка (СРБ) и суммы баллов по шкале mGPS (табл. 2).
В результате регрессионного анализа установлено, что вероятность повышения ИКМТ нарастает при увеличении такого расчетного показателя, как нормализованная скорость катаболизма белка (PCRn). Данный параметр характеризует недостаточное потребление белка пациентами со сбалансированным метаболическим состоянием. Однако у больных ХБП-5Д и с наличием БЭН повышение PCRn может указывать на активацию катаболизма, что представляет интерес при диагностике нарушений нутритивного статуса диализных больных и имеет большое прогностическое значение. В настоящем исследовании средние значения PCRn варьировались от 0,55 до 1,65 г/кг/сут (при рекомендованных 0,8–1,4 г/кг/сут) [2]. Кроме того, обнаружена обратная корреляционная зависимость этого показателя с уровнем Аkt. При значении PCRn в диапазоне рекомендуемых значений (0,8–1,4 г/кг/сут) уровень Аkt был 2,0–0,8 нг/мл соответственно (р=0,002).
 Необходимо подчеркнуть, что в проведенном исследовании взаимосвязи снижения MSTN с использованием высокопоточных диализных мембран, а также с параметром эффективности диализа (Kt/v) обнаружено не было. Однако расширение группы и изучение этого вопроса с оценкой влияния дополнительных факторов: характеристик диализной мембраны, метода диализа, режима, длительности процедуры, наличия сопутствующих заболеваний, представляет исследовательский интерес [10].
Необходимо подчеркнуть, что в проведенном исследовании взаимосвязи снижения MSTN с использованием высокопоточных диализных мембран, а также с параметром эффективности диализа (Kt/v) обнаружено не было. Однако расширение группы и изучение этого вопроса с оценкой влияния дополнительных факторов: характеристик диализной мембраны, метода диализа, режима, длительности процедуры, наличия сопутствующих заболеваний, представляет исследовательский интерес [10].
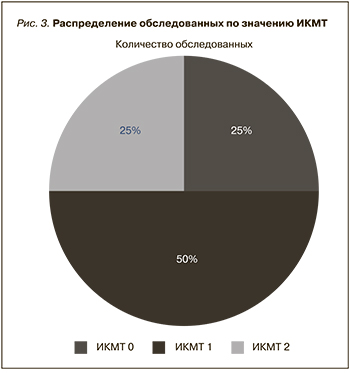
В то же время показано, что прогрессирование БЭН служит неблагоприятным предиктором в отношении длительности гемодиализной терапии: более выраженные нутритивные нарушения ассоциировались с сокращением длительности заместительной почечной терапии (χ2=4,73; p=0,03, рис. 3).
 Обсуждение
Обсуждение
Таким образом, в проведенном исследовании подчеркнуто значение в развитии БЭН у пациентов с ХБП-5Д таких маркеров-регуляторов мышечного обмена, как MSTN и Аkt. В связи с отсутствием четких количественных референсных значений концентраций MSTN и Аkt в сыворотке крови как у относительно здоровых лиц, так и у пациентов с терминальной почечной недостаточностью при расчете ИКМТ их уровни сравнивались с медианой значений данных показателей. Стоит отменить вклад обсуждаемых маркеров в развитие нарушений нутритивного статуса, что, вероятно, связано в т.ч. и с наличием системного воспалительного процесса, участвующего в активации протеолитических систем, контролируемых MSTN и Аkt. Это подтверждается литературными данными, в которых более подробно раскрывается роль провоспалительных цитокинов в патогенезе развития БЭН у пациентов с ХБП, получающих заместительную почечную терапию ПГД [3, 11, 12].
Обнаруженная связь ИКМТ и повышенных уровней воспалительных маркеров, в частности ферритина и СРБ, косвенно подтверждает теорию о влиянии системного воспаления на процессы деградации белка. X.H. Wang et al. в своей работе доказали взаимосвязь повышенного уровня СРБ у пациентов с БЭН и смертности от любых причин, при этом наиболее часто неблагоприятный исход отмечался в группе лиц с гипоальбуминемией, что, вероятно, отражало влияние воспалительного процесса на процессы синтеза белка [11].
Железодефицитные состояния, характерные для пациентов, получающих ПГД, представляют собой частое явление и в основе имеют сложный генез (нефрогенный, уремический, воспалительный). Однако если участие анемии в патогенезе мышечного катаболизма было неоднократно продемонстрировано в других работах [8], то роль дефицита железа как самостоятельного фактора, влияющего на обмен мышечной ткани через экспрессию MSTN и Аkt, изучена недостаточно, что представляет научный интерес.
Развитие синдрома гиперметаболизма-гиперкатаболизма на фоне дисбаланса молекулярных факторов мышечного обмена у пациентов с ХБП может потенцироваться воспалением, гиперпаратиреозом, дефицитом витамина D и др., приводить к развитию БЭН [13]. Вместе с тем обсуждаемые клинические состояния на фоне развития нутритивных нарушений у гемодиализных больных повышают сердечно-сосудистый риск и ухудшают прогноз основного заболевания.
Заключение
Таким образом, роль MSTN и Аkt в развитии БЭН, а также их определение в сыворотке крови пациентов с ХБП-5Д имеют важное диагностическое и прогностическое значение. Дальнейшее изучение этих маркеров в аспекте оценки тяжести БЭН и ее связи с саркопенией у пациентов, получающих ПГД, представляет научный интерес. Предложенный ИКМТ требует дополнительной проверки в большой когорте пациентов, в перспективе может быть использован для комплексной оценки нутритивного статуса и выраженности саркопении у гемодиализных больных. Вместе с тем необходимо определить референсные пределы концентраций MSTN и Аkt в сыворотке крови как для группы диализных больных, так и в популяции, и это остается перспективной задачей в изучении молекулярных основ патогенеза этого клинического состояния.

