Введение
Ситуация с разработкой способов повышения эффективности литокинетической терапии (ЛКТ) при нефролитиазе может оказаться более сложной, чем представляется в настоящее время. Это связано с тем, что отсутствует понимание, почему на фоне стандартной ЛКТ возможна разная скорость траффика конкрементов или даже отсутствует их элиминация на протяжении нескольких недель. В связи с этим следует учитывать несколько причин. Во-первых, нервная регуляция моторики мочеточника под влиянием вегетативной нервной системы характеризуется индивидуальными особенностями пациентов, которые определяются полом, возрастом, выраженностью экспрессии разных типов α-, β-адренорецепторов и М-холинорецепторов [1, 2]. В связи с этим введение α1-адреноблокаторов пациентам может оказаться малоэффективным для элиминации конкрементов: а) при низкой сенситивности α1-адренорецептора или уменьшении секреции норадреналина из пресинаптической части нейромышечного синапса; б) при повышении активности α2-адренорецепторов, провоцирующих сокращение гладкомышечных клеток (ГМК) и уменьшение просвета мочеточника, что препятствует траффику конкрементов. Во-вторых, при нефролитиазе может существенно изменяться ауторегуляция мышечного тонуса мочеточника, связанная как с растяжением ГМК при прохождении конкрементов, так и со спектром метаболитов, воздействующих на актомиозиновый комплекс [3]. В-третьих, логично предположить, что эффективность элиминации конкрементов зависит от особенностей регуляции перистальтики мочевыводящих путей (МВП) при траффике конкрементов разных размеров. Так, при наличии средних (10–20 мм) и крупных (>20 мм) конкрементов, когда воспроизводится полная обтурация просвета мочеточника, необходимо достигать максимальной релаксации мышечной оболочки мочеточника, тогда как траффик мелких конкрементов (≤6 мм) требует фазного усиления сократительной активности гладкой мышечной ткани МВП. В-четвертых, элиминация конкрементов зависит от эффективности компенсаторных механизмов, направленных на усиление сократительной активности или релаксации мышечной оболочки мочеточника [4]. Становление и модуляция компенсаторных механизмов определяются как локальной (ауто-, паракринная), так и системной гуморальной регуляцией. К наиболее значимым местным регуляторам перистальтики мочеточника следует отнести биологически активные вещества (в т.ч. АТФ, АДФ, аденозин, оксид азота), секретируемые уротелием, ГМК, тромбоцитами, лейкоцитами, поступающие интралюминально в результате секреции интерстициальными клетками мозгового вещества почки, а также при активации юкстагломерулярного аппарата почки [5, 6]. Системная гуморальная регуляция моторики мочеточника связана с активацией САС, возникающей при обструкции просвета МВП [7]. Биологическим маркером данного процесса может быть функциональная активность α2-, β2-, β3-адренорецепторов, для которых адреналин является основным агонистом. В литературе отсутствует информация, касающаяся механизмов регуляции компенсаторными реакциями мышечной оболочки мочеточника в процессе элиминации конкрементов.
Гипотеза. Если элиминация мелких конкрементов связана с нервной и миогенной регуляцией ГМК, то компенсаторные реакции гладкой мышечной ткани мочеточника контролируются сигнальными путями тех рецепторов, на которые воздействуют агонисты, представляющие регуляторные системы. В этом случае исследование активности рецепторов, участвующих в процессах сокращения и расслабления ГМК, позволит приблизиться к пониманию механизмов, обеспечивающих разную скорость траффика конкрементов в МВП при ЛКТ.
Цель исследования – установить молекулярные механизмы, модулирующие быстрый траффик мелких (≤6 мм) конкрементов в средней трети мочеточника.
Материал и методы
Исследование носило проспективный характер и включило 53 пациента с визуализационными признаками наличия мелких конкрементов в средней трети мочеточника. Всем пациентам на этапе госпитализации проведено комплексное клиническое обследование по традиционной схеме, принятой для диагностики нефролитиаза (жалобы, сбор анамнеза, физикальный осмотр, клинико-инструментальные исследования, ультразвуковое обследование и компьютерная томография почек, микробиологический посев мочи, лабораторные исследования крови и мочи). Средний размер конкремента составил 4,65±1,0 мм (min-max – 2,0–6,0 мм). Стандартная ЛКТ включала нестероидные противовоспалительные средства – НПВС (диклофенак натрия 100–150 мг/сут.), α1-адреноблокатор (тамсулозин, 0,4 мг/сут.) и антибиотики, спазмолитики (платифиллин 12 мг/сут., папаверин 120, бенциклан 200, дротаверин 150 мг/ сут.). Эффективную элиминацию конкремента признавали состоявшейся, если по данным визуализационного контроля произошло перемещение конкремента из средней трети мочеточника в его нижнюю треть, интрамуральный отдел или просвет мочевого пузыря. Когорта больных была распределена на три группы в зависимости от скорости траффика конкрементов, т.е. интервала времени, в течение которого завершалось выведение конкремента из средней трети мочеточника. В 1-й группе (21 пациент) с быстрой элиминацией конкрементов траффик занимал от 1 до 3 суток; во 2-й (12 пациентов) этот срок составил 4–6 суток (промежуточная элиминации); в 3-й группе (20 пациентов) имела место медленная элиминация – в течение 7–9 суток ЛКТ. В данное исследование включены пациенты с быстрой элиминацией мелких конкрементов.
Протокол исследования агрегационной способности тромбоцитов соответствует Европейским рекомендациям по стандартизации агрегатометрии [8]. Оценку агрегации тромбоцитов проводили турбидиметрическим методом на анализаторе ChronoLog (USA). Тромбоциты больных использовали в качестве модели для оценки функциональной активности α2-адренорецептора, пуриновых Р2Х1- и Р2Y-рецепторов, ангиотензинового АТ1-рецептора, ТхА2- и аденозинового А2-рецептора. В исследовании использовали агонисты соответствовавших рецепторов: адреналин, АТФ и АДФ, ангиотензин-2 и аденозин (Sigma-Aldrich Chemie GmbH, Германия) в концентрациях ЕС50, вызывающих амплитуду агрегации 50% у здоровых лиц. Для определения индивидуальной способности НПВС ингибировать циклооксигеназу (ЦОГ) тромбоциты предварительно инкубировали с ацетилсалциловой кислотой, после чего добавляли арахидоновую кислоту [9]. В данном тесте критерием активности ЦОГ является ТхА2-индуцированная агрегация тромбоцитов, выраженность которой зависела от степени ингибирования метаболизма арахидоновой кислоты. Все клинические исследования выполнены по согласованию с комиссией по биоэтике ГОО ВПО «Донецкий национальный медицинский университет им. М. Горького». Точечная оценка величин, подлежащих анализу, проводилась путем расчета среднего арифметического признака () или ее медианы (Me) и соответствующей стандартной погрешности (m). При анализе межгрупповых различий применяли критерий Стьюдента (в случае нормального закона распределения), критерий Вилкоксона (в случае отличия закона распределения от нормального). Для выявления связи между признаками применяли методы корреляционного анализа: рассчитывали коэффициент корреляции Пирсона или показатель ранговой корреляции Спирмена. Различие считалась статистически значимым при уровне р<0,05.
Результаты и обсуждение
При траффике мелких конкрементов проанализированы 2 волны элиминации – через 24 и 48–72 часа соответственно 10 (47,6%) и 11 (52,4%) случаев. Можно предположить, что различная скорость траффика связана с наличием индивидуальных (генетически детерминированных) особенностей формирования и регуляции компенсаторных механизмов, обеспечивающих сокращение и расслабление мышечной оболочки средней трети мочеточника в процессе нефролитиаза. Проведенное исследование на этапе госпитализации пациентов (до начала ЛКТ) выявило гиперреактивность α2-адренорецептора (64,8±0,4%; 95% ДИ 64,0–65,6%), нормореактивность (50,0±5,0%) пуриновых Р2Х1- и Р2Y-рецепторов, аденозинового А2-рецептора и ангиотензинового АТ1-рецептора, а также гипореактивность ТхА2-рецептора (32,9±0,6%; 95% ДИ: 32,2–33,6%). Приведенные данные подтверждают возможность участия САС при нефролитиазе в формировании компенсаторных механизмов, способных повышать сократительную активность ГМК мочеточника. Необходимо отметить модуляцию релаксации гладкой мышечной ткани, связанную как с влиянием аденозина, так и с ингибированием синтеза ТхА2 при применении НПВС на этапе, предшествующем госпитализации пациентов. Означает ли это, что внутриклеточная сигнализация, связанная со стимуляцией α2-адренорецептора, является определяющим фактором скорости траффика мелких конкрементов в средней трети мочеточника?
Исследовательский вопрос: отличается ли активность рецепторов при разной скорости траффика мелких конкрементов в средней трети мочеточника на фоне стандартной ЛКТ? Установлено, что через 24 часа ЛКТ ведущими индукторами сократительной активности ГМК помимо адреналина могли быть АТФ, АДФ и Ан-2 (см. таблицу).
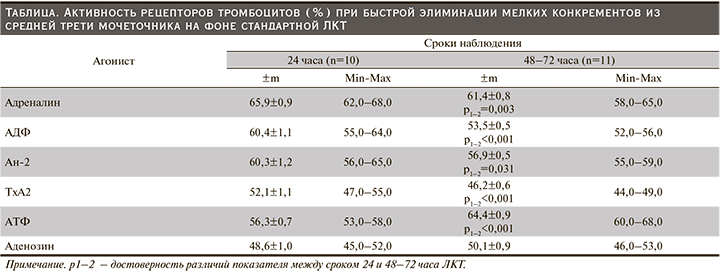
По сравнению с исходными значениями (на этапе госпитализации) активность α2-адренорецептора сохранялась в диапазоне гиперреактивности. При этом до уровня гиперреактивности повышалась сенситивность АТ1-рецептора, Р2Y-рецептора и Р2Х1-рецептора соответственно на 10,2%, 16,1 и 19,5% (р<0,001). Следует отметить, что активность α2-адренорецептора превышала таковую АТ1- и Р2Y-рецептора примерно на 9,0% (р<0,001), Р2Х1-рецептора – на 17,0% (р<0,001). Если сопоставить активность рецепторов, способных повышать моторику мышечной оболочки мочеточника, то можно получить следующую картину: активность α2-адренорецептора>активности АТ1-рецептора=активности Р2Y-рецептора>активности Р2Х1-рецептора. Активность А2А-рецепторов оставалась на уровне нормореактивности, ТхА2-рецептора повышалась от гипо- до нормореактивности (р<0,001). Следовательно, элиминация конкрементов в течение первых 24 часов ЛКТ обеспечивалась включением нескольких механизмов, направленных на компенсаторное усиление сократительной активности ГМК. Важным условием для такой элиминации было поддержание нормореактивности А2А- и ТхА2-рецептора, предусматривавшей сохранение базального уровня релаксации ГМК.
У 8 (53,3%) пациентов элиминация конкрементов завершалась на протяжении 48 и 72 часов, а следовательно, в течение первых 24 часов ЛКТ компенсаторные механизмы, модулирующие моторику мочеточника, не обеспечивали эффективного выведения конкрементов. По сравнению с исходными значениями активность α2-адренорецептора сохранялась в диапазоне гиперреактивности, хотя и снизилась на 5,3% (р<0,001). До уровня гиперреактивности повышалась активность АТ1- и Р2Х1-рецептора соответственно на 4,0 и 36,7% (р<0,001); активность пуриновых Р2Y-рецепторов сохранялась на уровне нормореактивности. Следовательно, ведущую роль в модуляции сокращения мочеточника может играть Р2Х1-рецептор, активность которого превышала таковую α2-адренорецептора на 4,9% (р=0,033), АТ1-рецептора на 13,2% (р<0,001) и Р2Y-рецептора на 20,4% (р<0,001). Кластер активности рецепторов данного контингента больных может быть представлен следующим образом: активность Р2Х1-рецептора>α2-адренорецептора>активности АТ1-рецептора>активности Р2Y-рецепторов. Активность А2А-рецепторов оставалась на уровне нормореактивности, ТхА2-рецептора возрастала до нормореактивности (р<0,001). Факт повышения активности ТхА2-рецептора при разных сроках элиминации мелких конкрементов свидетельствует о необходимости восстановления тонуса ГМК нарушенного ингибированием ЦОГ. Таким образом, когорта пациентов со сроком элиминации 48 и 72 часа отличается механизмом миогенной модуляции моторики мочеточника. Усиление стимуляции P2X1-рецептора при отсроченной элиминации может быть связано с необходимостью повышения силы сокращения ГМК [10]. Вероятно, предсуществующая на этапе госпитализации гиперреактивность α2-адренорецептора провоцирует нарушение микроциркуляции; постепенное развитие гипоксии/ишемии тканей МВП приводит к нарушению энергообразования в ГМК и повышению уровня внеклеточного АТФ. При этом включается резервный компенсаторный механизм миогенной стимуляции мочеточника, поддерживающий силу сокращения мышечной оболочки перистальтики, что обеспечивает выведение мелких конкрементов. Наличие гиперреактивности α2-адренорецептора предполагает увеличение частоты фазовых сократительных ответов в перистальтике мочеточника [11].
Можно констатировать, что в когорте пациентов с подтвержденной элиминацией конкрементов через 24 часа ЛКТ функционирует более эффективный компенсаторный механизм перистальтики мочеточника, основанный на одновременной стимуляцией α2-адренорецептора, АТ1-рецептора и Р2Y-рецепторов. Данный механизм может быть детерминирован системной активацией САС, которая сопровождается стимуляцией РАС и повышением уровня внеклеточного АДФ. Модулирующее влияние ангиотензина-2 на физиологическую и патофизиологическую регуляцию перистальтики мочеполовых путей доказано [12]. Эффект стимуляции АТ1-рецептора связывают с усилением спонтанной сократительной активности в гладкомышечной ткани [13], вероятно, вследствие усиления синтеза норадреналина в вегетативных ганглиях и стимуляцией α1-адренорецептора [14]. С нашей точки зрения, более значимой особенностью модуляции моторики мочеточника является накопление внеклеточного АДФ, который может вызывать длительное сокращение гладкой мышечной ткани посредством стимуляции P2Y12-рецепторов [15]. Причиной этого феномена служит медленная десенситизация данного рецептора [16]. Передача сигнала АДФ-P2Y12-рецептор жестко регулируется активностью эктонуклеотидаз и рецепторами аденозина [17]. Поскольку трансформация AДФ в аденозин играет важную роль в снижении АТФ-индуцированного сокращения ГМК, для траффика мелких конкрементов представляется целесообразным включение механизмов пуринергической сигнализации, направленной на лимитирование уровня внеклеточного аденозина; поддержание нормореактивности А2А-рецептора должно обеспечивать физиологический уровень релаксации ГМК. Повышение уровня внеклеточного АДФ при сохранении уровня аденозина, вероятно, обеспечивает оптимальную пуринергическую модуляцию перистальтики мочеточника при траффике мелких конкрементов в средней трети мочеточника. Следовательно, различия пуринергической сигнализации при элиминации мелких конкрементов связаны с необходимостью увеличивать силу сокращения ГМК посредством P2X1-рецептора [18] или длительность сохранения тонуса мышечной оболочки с участием P2Y-рецепторов.
Заключение
Вариабельность быстрого траффика мелких конкрементов (≤6 мм) при ЛКТ в диапазоне от 24 до 72 часов определяется индивидуальными особенностями формирования и регуляции компенсаторных механизмов при нефролитиазе, целью которых является оптимизация процессов сокращения и расслабления гладкой мышечной ткани МВП. При элиминации конкрементов в течение первых 24 часов ЛКТ сократительная активность мочеточника модулируется САС и РАС, а также внеклеточным АДФ, содержание которого определяется трансформацией пуриновых нуклеотидов при ишемии тканей МВП. Факт выведения мелких конкрементов из средней трети мочеточника позволяет считать сочетание указанных модуляторов перистальтики оптимальным, что может быть связано: а) с увеличением частоты фазовых сократительных ответов при активации α2-адренорецептора; б) с усилением спонтанной сократительной активности при стимуляции ангиотензинового АТ1-рецептора; в) с повышением длительности тонического сокращения гладкой мышечной ткани МВП при активации пуринового P2Y12-рецептора.
Отсроченная на 48–72 часа элиминация конкрементов характеризуется модуляцией перистальтики мочеточника посредством САС и локальной пуринергической сигнализации, индуцируемой внеклеточным АТФ. Гиперреактивность P2X1-рецептора может быть связана с необходимостью повышения силы сокращения мышечной оболочки в условиях ограниченной активности РАС и сохраняющейся ишемии МВП. Необходимым условием элиминации мелких конкрементов являлось поддержание базального уровня релаксации ГМК, что достигалось путем сохранения нормореактивности А2А-рецепторов. Пластичность пуринергической сигнализации, которая обеспечивает возможность селективной стимуляции P2X1-рецептора, P2Y12- и А2А-рецепторов в зависимости от ишемии тканей МВП, позволяет рассматривать данную систему внутриклеточной сигнализации как высокоэффективный механизм координации процессов сокращения и расслабления гладкой мышечной ткани мочеточника при траффике мелких конкрементов.



