«В каждом взрослом живет бывший ребенок, и в каждом ребенке находится будущий взрослый».
Джон Конноли, Книга потерянных вещей
Введение и обзор
Во всем мире 10 марта 2016 года будет отмечаться 11-й Всемирный день почки. Это ежегодное мероприятие, организуемое совместно Международным обществом нефрологов (ISN) и Международной федерацией почечных фондов (IFKF), является успешной инициативой по информированию широкой общественности и политиков о значимости и последствиях заболеваний почек. В 2016 г. Всемирный день почки будет посвящен заболеваниям почек детского возраста и начинающимся в раннем детстве болезням почек у взрослых.
У детей, перенесших острое повреждение почек (ОПП) вследствие широкого спектра состояний, могут развиваться отдаленные последствия, приводящие много лет спустя к хронической болезни почек (ХБП) [1–4]. Более того, ХБП у детей (представляющая собой преимущественно врожденную патологию, или возникающая в результате осложнений ряда внепочечных заболеваний, которые могут повреждать почки вторично) не только приводит к значительной заболеваемости и смертности в детском возрасте, но и создает комплекс медицинских проблем за пределами детского возраста. Действительно, детская смертность от ряда инфекционных заболеваний неразрывно связана с вовлечением почек. Например, дети, заболевшие холерой и другими кишечными инфекциями, часто умирают не от инфекции как таковой, а от ОПП, обусловленного дегидратацией и гиповолемическим шоком. Кроме того, существуют многочисленные данные, свидетельствующие, что артериальная гипертензия, протеинурия и ХБП у взрослых имеют предпосылки уже в детском возрасте, в т.ч. и в раннем, начиная с внутриутробного и перинатального периодов жизни (табл. 1). Всемирный день почки-2016 стремится повысить общую осведомленность о том, что многие заболевания почек у взрослых в действительности начинаются в детстве. Знание и понимание спектра заболеваний и состояний, возникающих в детстве и ассоциированных с высоким риском, дают возможность для выявления лиц, находящихся в группе повышенного риска развития ХБП в течение жизни, и для осуществления у них адекватных превентивных вмешательств.
Эпидемиологические данные о спектре как ХБП, так и ОПП у детей во всем мире в настоящее время довольно ограничены, хотя их объем постепенно увеличивается. Распространенность ХБП в детском возрасте невелика и, по имеющимся данным, варьируется с разбросом от 15 до 74,7 случая на миллион детей [3]. Такие различия объясняются влиянием на выявление ХБП ряда региональных и культурных факторов, а также используемой методологией оценки данных. Совсем недавно Всемирная организация здравоохранения (ВОЗ) впервые внесла заболевания почек и мочевых путей в список состояний, подлежащих регистрации при сборе информации о причинах смертности, прослеживаемых во всем мире. Со временем эта информация станет важным источником данных, хотя в настоящее время ВОЗ не предоставляет данных по возрастным группам [5]. Различные базы данных, такие как Северо-Американские педиатрические почечные объединенные исследования (NAPRTCS) [6], Система почечных данных США (USRDS) [7] и регистр Европейской ассоциации диализа и трансплантации (EDTA Registry) [8], включают сведения о терминальной хронической почечной недостаточности (тХПН) и частично о ХБП у детей. Такие исследовательские проекты, как ItalKid [9] и «Хроническая болезнь почек у детей» (CKiD) [10], а также Исследование глобального бремени заболеваний-2013 (Global Burden of Disease Study 2013) наряду с регистрами, существующими в настоящее время уже во многих странах, предоставляют крайне важную информацию, но еще больше информации потребуется в дальнейшем.
По данным популяционных исследований взрослых пациентов, ОПП может приводить к ХБП [12]. Частота возникновения ОПП среди детей, госпитализированных в отделения интенсивной терапии, широко варьируется – от 8 до 89%. Исходы ОПП зависят от доступности ресурсов для оказания медицинской помощи [1]. В ближайшее время ожидаются результаты такого важного исследования, как AWARE, многонационального проекта, осуществляемого в пяти странах и посвященного изучению ОПП у детей [13]. Одноцентровые исследования и данные мета-анализов показывают, что оба состояния – ОПП и ХБП, возникающие в детском возрасте, служат причиной лишь небольшого количества случаев ХБП по всему миру в целом [2, 3]. Однако становится более очевидным, что болезни почек у взрослых зачастую являются наследием детских проблем.

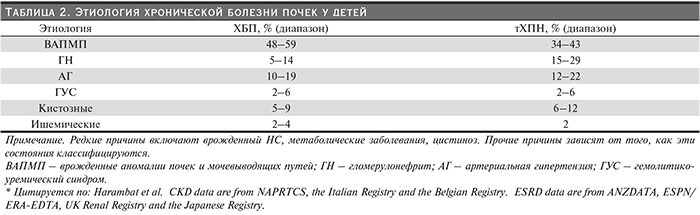
Спектр педиатрических болезней почек
Спектр состояний, ведущих к развитию ХБП в детском возрасте, с преобладанием врожденных и наследственных заболеваний, существенно отличаются от такового у взрослых. На сегодняшний день более чем в 150 генах идентифицированы мутации, ответственные за нарушения нормального развития почек или функционального состояния клубочков или канальцев [14]. Большинство из этих генетических нарушений клинически проявляется в детском возрасте, и многие из них приводят к прогрессированию ХБП. Врожденные аномалии почек и мочевыводящих путей (ВАПМП) составляют крупнейшую категорию ХБП у детей (табл. 2) и включают гипоплазию/дисплазию почек и обструктивную уропатию. Среди почечных дисплазий важную подгруппу составляют кистозные заболевания почек, развивающиеся в результате генетических дефектов клеток канальцевого эпителия – «первичных ресничек». Многие гломерулопатии у детей вызваны генетическими или приобретенными дефектами подоцитов, уникальных клеток, выстилающих капилляры клубочка. Менее распространенной, но очень важной причиной ХБП в детском возрасте являются наследственные нарушения обмена веществ, такие как первичная гипероксалурия и цистиноз; а также атипичный гемолитико-уремический синдром – тромботическая микроангиопатия, связанная с генетическими аномалиями системы комплемента, свертывающей системы и некоторых путей метаболизма.
До настоящего времени остается не ясным, каким образом классифицировать детей, перенесших ОПП и, очевидно, выздоровевших, или детей с перинатальной патологией, вероятно, обусловливающей формирование относительной олигонефронии.
Причиной тХПН (в отличие от ХБП) у детей несколько чаще выступают гломерулопатии, несколько реже – ВАПМП (табл. 2), что связано с более быстрой потерей нефронов при гломерулярных заболеваниях. Тем не менее последние данные свидетельствуют о том, что у многих пациентов с легкими формами ВАПМП возможно прогрессирование заболевания до тХПН уже во взрослом возрасте – в основном от 30 до 40 лет [15].
Имеются национальные и региональные различия в типах и течении как ОПП, так и ХБП в детском возрасте и у взрослых. Смертность от заболеваний почек выше в развивающихся странах, поэтому силы и внимание должны быть направлены на устранение существующих национальных и региональных различий в лечении и исходах этой патологии. Кроме того, в зависимости от региона, страны и ее инфраструктуры различается и доступность медицинской помощи. Сосредоточив внимание на болезнях почек в детском возрасте, можно повысить экономическую эффективность лечения, поскольку ранние превентивные вмешательства могут предотвращать прогрессирование в более поздние стадии ХБП. Ожидаемые результаты зависят от доступности медицинской помощи и ухода. У детей, в т.ч. и у младенцев, нуждающихся в заместительной почечной терапии, лечение ОПП и ХБП может быть высокоэффективным и позволит снизить бремя болезней почек в зрелом возрасте. Но чтобы осуществлять это лечение, необходимо направить ресурсы на обеспечение доступности наиболее быстрых и экономичных методов острой ЗПТ в детском возрасте.
Врожденные заболевания почек и эволюционные источники здоровья и болезни, вклад почек в состояние здоровья и клинические проявления
В регионах, где ультразвуковые исследования плода являются рутинными, многие урологические аномалии выявляются в антенатальном периоде, что позволяет обеспечить раннее вмешательство. Однако в большинстве стран мира структурные аномалии у детей идентифицируются намного позже, когда появляются клинические симптомы заболевания. Эффективность распространенного в некоторых странах и регионах скрининга на выявление протеинурии, гематурии и инфекции мочевых путей до настоящего времени остается дискутабельной. Тем не менее достигнуто общее соглашение – в обязательном порядке должны быть обследованы следующие категории детей: с аномалиями мочеполовой системы, выявленными антенатально при ультразвуковых исследованиях; с семейным анамнезом, отягощенным по заболеваниям почек; с потерей в весе и отставанием в физическом развитии; с инфекцией мочевых путей в анамнезе; с расстройствами мочеиспускания или изменением внешнего вида мочи. Первоначальный скрининг должен включать целенаправленное физикальное обследование, исследование мочи с помощью тест-полосок, общий анализ мочи и стандартный биохимический анализ крови с последующим более узконаправленным обследованием по показаниям.
В зависимости от диагноза может быть показан тот или иной вид лечения. Однако доказательств, будто терапия будет способствовать замедлению темпов прогрессирования ХБП в детском возрасте, все еще недостаточно. Ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов ангиотензина, антиоксиданты и, возможно, определенная диета могут быть показаны в зависимости от диагноза. При этом диетические ограничения не должны сказываться на адекватном росте и развитии ребенка. Исследование ESCAPE представило доказательства, согласно которым жесткий контроль артериального давления замедляет прогрессирование ХБП у детей независимо от характера основного заболевания почек [16].
Некоторым детям может потребоваться проведение ЗПТ уже в младенческом возрасте. Последние объединенные данные регистров из множества стран по всему миру свидетельствуют о хорошей выживаемости даже при начале диализа с неонатального периода [2, 17]. Трансплантация почки остается предпочтительным видом ЗПТ для детей и, как правило, применима после 12-месячного возраста с превосходной выживаемостью пациентов и трансплантата, а также нормальным ростом и развитием реципиентов.
Накапливаются доказательства, будто ХБП с манифестацией в детском возрасте приводит к повышению сердечно-сосудистой заболеваемости и сокращению ожидаемой продолжительности жизни. Текущие крупные перспективные исследования, такие как Исследование сердечно-сосудистых заболеваний у детей с ХБП (Cardiovascular Comorbidity in Children with CKD – 4C), должны предоставить новые данные о причинах и последствиях ранних сердечно-сосудистых заболеваний у детей с ХБП [18].
В настоящее время известно, что помимо врожденных заболеваний почек на состояние здоровья в течение жизни могут повлиять и некоторые перинатальные нарушения – даже в отсутствие явного заболевания почек в раннем периоде [19]. Данные когортных исследований и отдельные сообщения показывают, что недоношенные дети имеют очень высокий риск развития заболевания почек в будущем – через много лет после рождения. Выживаемость недоношенных детей неуклонно растет, в т.ч. и тех, кто рождается задолго до завершения нефрогенеза [20]. Имеющиеся немногочисленные данные показывают, что в период пребывания новорожденных в отделениях интенсивной терапии многие из них получают массу нефротоксичных лекарственных средств, а у погибших в стационаре недоношенных детей при аутопсии выявляется снижение количества и увеличение размеров клубочков [21]. Кроме того, у выживших недоношенных новорожденных нередко развивается ОПП, проявления которого могут быть стертыми [22]. Еще больше настораживают обширные эпидемиологические данные, свидетельствующие, что дети, родившиеся в срок, но с относительно низкой массой тела при рождении, могут иметь высокий риск развития гипертензии, альбуминурии и ХБП в дальнейшей жизни [23]. У таких лиц при проведении прямых морфометрических измерений во взрослом возрасте может выявляться уменьшенное количество нефронов, что рассматривается в качестве дополнительного вклада в формирование кардиоренальной патологии.
Сосредоточив внимание на детях в рамках Всемирного дня почки, мы хотели бы подчеркнуть необходимость контроля функции почек и артериального давления на протяжении всей жизни пациентов, родившихся преждевременно или с малой для соответствующего гестационного возраста массой тела. Если это будет осуществлено и если в течение жизни этим лицам можно будет избежать применения нефротоксических препаратов, окажется возможным предотвратить развитие ХБП у многих людей.
Доступные ресурсы и лечение детей – отличия от лечения взрослых
Существуют различия в доступности ресурсов для лечения ОПП у детей и молодых людей, поэтому многие дети и подростки в развивающихся странах могут погибнуть от ОПП. Для решения этой проблемы Международное общество нефрологов (ISN) инициировало проект под названием «Спасем Молодые Жизни». Целью проекта стало предотвращение ОПП за счет своевременного лечения инфекционных заболеваний и/или адекватного восполнения жидкости и электролитов, а также лечение ОПП, если оно все-таки развивается. Этот проект, в котором четыре почечных фонда участвуют в равной степени (Международная ассоциация детских нефрологов – IPNA, ISN, Международное общество перитонеального диализа – ISPD, и Фонд постоянной почечной помощи – SKCF), реализуется в настоящее время в ряде стран Африки, находящихся к югу от Сахары, и в некоторых странах Юго-Восточной Азии. Основные усилия сосредоточены на организации и поддержании активной деятельности центров для лечения пациентов с ОПП, в т.ч. с применением острого перитонеального диализа. Данный проект тесно связан с другим проектом ISN – «0 к 25», который имеет целью обеспечить к 2025 г. нулевую смертность от потенциально предотвратимого ОПП.
В связи с преобладанием врожденных и наследственных заболеваний почек возможности лечения детей с ХБП исторически были ограничены несколькими иммунопатологическими состояниями. Достижения последних лет в области фармакологии и молекулярной генетики наряду с расширением диагностических возможностей позволили постепенно преодолеть длительно существовавший в педиатрической практике «терапевтический нигилизм» в отношении заболеваний почек. Атипичный ГУС, долгое время считавшийся жизнеугрожающим заболеванием с высокой вероятностью прогрессирования в тХПН и рецидивов после трансплантации, в настоящее время с появлением моноклональных антител, специфически блокирующих активацию С5-комплемента, рассматривается в качестве излечимого состояния [24]. Другим примером служит использование антагонистов рецепторов вазопрессина – ваптанов – с целью замедления роста кист и сохранения функций почек при поликистозной болезни почек [25]. Впервые эффективность терапии ваптанами была показана взрослым с аутосомно-доминантной поликистозной болезнью почек, однако она рассматривается и в качестве перспективной для лечения аутосомно-рецессивной формы заболевания, которая часто прогрессирует до тХПН в детском возрасте.
Вместе с тем польза, которую приносят пациентам фармакологические открытия, в глобальном масштабе может быть сведена на нет вследствие огромной стоимости некоторых новых терапевтических средств. Поиск доступных инновационных методов лечения редких заболеваний будет ключевым вопросом в педиатрической нефрологии в ближайшие годы.
Создание новых клинических регистров, аккумулирующих информацию о естественном течении заболевания, в т.ч. о генотипически фенотипических корреляциях, будет способствовать выявлению детей с ХБП, в отношении которых оправданно применение новых эффективных терапевтических подходов. Помимо баз данных по конкретным заболеваниям почек существует необходимость разработки регистров данных о специфической терапии. Такие регистры особенно важны в тех областях, где клинические исследования трудновыполнимы из-за малого числа пациентов и отсутствия интереса фармакологических компаний, а также для видов лечения, требующих глобального развития и усовершенствования. Например, в настоящее время в мире имеются большие различия в обеспечении и методиках проведения диализа, а также трансплантации почки у детей. В то время как во многих развитых странах показатели выживаемости как детей, так и методик достаточно высоки и даже превосходят таковые для взрослых, почти половине детской популяции в мире, по имеющимся оценкам, вообще не предлагается проведение хронической ЗПТ. Обеспечение доступа к ЗПТ для всех детей – наиважнейшая задача будущего. Для получения достоверной информации о демографических особенностях и исходах ЗПТ у детей Международная ассоциация детских нефрологов (International Pediatric Nephrology Association, IPNA) планирует в ближайшее время организовать глобальный регистр популяционных данных. В случае успеха регистр IPNA по ЗПТ может стать образцовой моделью для проведения сбора данных во всем мире.
Переход от педиатрической медицинской помощи к медицинской помощи для взрослых
Перевод подростков с заболеваниями почек во взрослую сеть имеет решающее значение как для пациентов, так и для лиц, обеспечивающих им медицинскую помощь и уход. Молодых пациентов с хроническими заболеваниями переход из педиатрической во взрослую сеть часто приводит к несоблюдению рекомендаций [26–28]. Поэтому для обеспечения успеха должны осуществляться продуманные шаги и выполняться методически отработанные процедуры, основанные на валидированных протоколах и заслуживающих доверия рекомендациях.
В процессе смены сети наблюдения с педиатрической на взрослую, «перевод» подростка, который должен происходить постепенно, следует отличать от «передачи», которая зачастую представляет собой просто неожиданную механическую замену медицинского учреждения или врача. Внедрение концепции «перевода» должно быть заблаговременным – за несколько месяцев или лет до целевого срока, когда дети вступают в подростковый и взрослый возраст. Конечная цель заключается в содействии установлению прочных взаимоотношений и разработке индивидуального плана в новой сети наблюдения, что позволит пациенту чувствовать себя достаточно комфортно, чтобы информировать врача о несоблюдении рекомендаций и других упущениях.
План перевода подростка во взрослую сеть должен составляться с учетом того, что эмоциональная зрелость детей с заболеваниями почек может быть очень различной. Оценка семейной ситуации и лиц, осуществляющих уход за детьми, а также культурных, социальных и финансовых факторов в момент перевода являются ключевым моментом, особенно важна реалистическая оценка бремени, лежащего на лицах, обеспечивающих уход [4]. Время и формат перевода могут существенно различаться для отдельных пациентов в зависимости от конкретной ситуации; поэтому предпочтителен гибкий перевод без заранее установленной даты и даже без четко очерченного формата.
Важно отметить, что перевод может быть замедлен или приостановлен, пациент даже может быть временно возвращен обратно в детскую сеть в критических ситуациях, например при обострении или прогрессировании заболевания или при нестабильной семейной или социальной ситуации. Консенсус, недавно разработанный общими усилиями Международного общества нефрологов (ISN) и Международной ассоциации детских нефрологов (IPNA), предлагает в соответствии с вышеизложенными положениями ряд мер, направленных на улучшение процесса перевода пациентов с заболеваниями почек во взрослую сеть медицинской помощи [29, 30].
Призыв к сбору информации и к действию
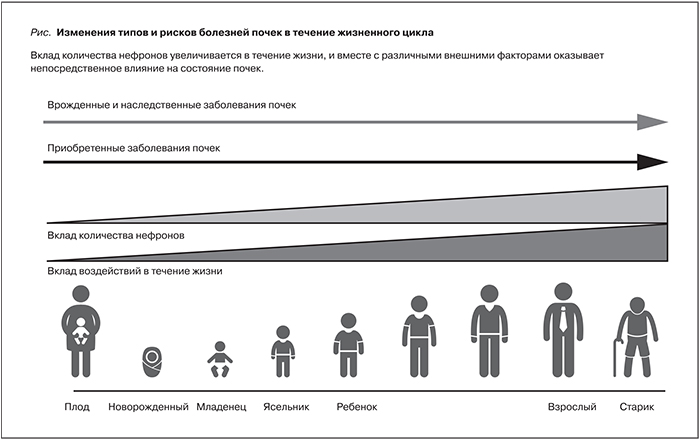
С учетом уязвимости детей с заболеваниями почек, в т.ч. влияния этих заболеваний на рост и развитие, а также на будущую взрослую жизнь (см. рисунок), и принимая во внимание, что в развивающихся странах значительная часть детей испытывают дефицит медицинской помощи, всеобщее просвещение крайне важно для переориентации существующих связей и последующих действий [31, 32]. Все усилия должны быть направлены на укрепление регионального и международного сотрудничества и обмена идеями между местными почечными фондами, профессиональными сообществами и другими некоммерческими организациями, и государствами и правительствами, с тем чтобы содействовать расширению возможностей всех заинтересованных сторон для улучшения здоровья, благополучия и качества жизни детей с заболеваниями почек, обеспечения продолжительности их жизни в зрелом возрасте.
Однако до недавнего времени консенсус ВОЗ по неинфекционным заболеваниям включал только сердечно-сосудистые заболевания, рак, диабет и хронические заболевания легких, но не болезни почек [33, 34]. К счастью, глобальная кампания под предводительством ISN увенчалась успехом – Политическая декларация по неинфекционным заболеваниям, утвержденная на саммите Организации объединенных наций в 2011 г., теперь включает заболевания почек под пунктом 19 [35].
Просвещение и повышение осведомленности о заболеваниях почек в целом и болезнях почек в детском возрасте в частности согласуются с задачами ВОЗ по снижению смертности от неинфекционных заболеваний с помощью 10-летней инициативы популяционного уровня, направленной на изменение образа жизни (включая ограничение курения и употребления алкоголя, контроль потребления соли и контроль калорийности питания), и проведение эффективных вмешательств (включая контроль артериального давления, холестерина и гликемии). Необходимы серьезные усилия для реорганизации и расширения междисциплинарных взаимодействий с акцентом на раннее выявление и лечение заболеваний почек у детей. Поскольку проблемы, связанные с заболеваниями почек, могут оказаться отодвинутыми на задний план другими неинфекционными заболеваниями, более важными для здравоохранения, такими как диабет, рак и сердечно-сосудистые заболевания, наши усилия должны быть направлены на повышение знаний и осведомленности о таких перекрестных состояниях, как кардиоренальный синдром; о глобальной природе ХБП и терминальной ХПН как основных неинфекционных заболеваниях и о роли заболеваний почек как дополнительного фактора в умножении бремени болезней при других неинфекционных заболеваниях. Достижению вышеуказанных целей могут послужить официальные документы, включая консенсусные статьи, и детальные обзоры экспертов мирового класса [36].

