Введение
Около 10% взрослого населения планеты страдают хронической болезнью почек, которая входит в список 20 основных причин смерти во всем мире [1] и ведет к пагубным последствиям как для самих пациентов, так и для членов их семей. Всемирный День почки в 2018 г. совпадает с Международным женским днем, что дает нам повод задуматься об особой важности состояния здоровья женщин, особенно о «почечном здоровье», для ныне живущей популяции и для будущих поколений. Нам представляется не только уникальная возможность узнать как можно больше об особенностях заболеваний почек у женщин, но и шире использовать полученные знания.
Женщины, девушки и девочки в целом составляют примерно 50% населения мира и вносят огромный вклад в жизнь общества, не говоря уж о важнейшей роли в семейной жизни. И дело не только в вынашивании, рождении, вскармливании и воспитании детей, но и в заботе о здоровье семьи и общества в целом. Женщины в XX в. продолжают стремиться к равенству в бизнесе, коммерции и профессиональных начинаниях, зачастую сталкиваясь с отсутствием равноправия во многих областях. В различных странах по всему миру доступ к образованию и здравоохранению не одинаков для мужчин и женщин; женщины недостаточно представлены во многих клинических исследованиях, что ограничивает доказательную базу, на основании которой формируются рекомендации по улучшению исходов (рис. 1)
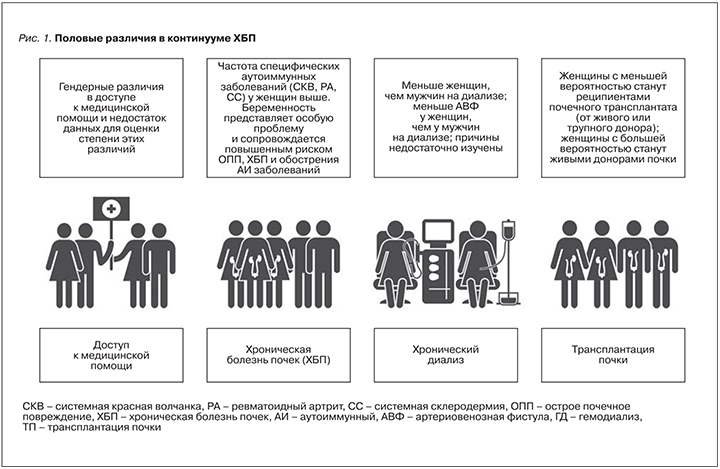
В этой передовой статье мы сконцентрировали внимание на том, что мы знаем и чего мы не знаем о «почечном здоровье» и заболеваниях почек у женщин, и на том, что мы можем и должны узнать в будущем для улучшения исходов заболеваний почек для всех людей во всем мире.
Что мы знаем и чего не знаем
Беременность создает особую нагрузку на организм женщины и является ведущей причиной острого почечного повреждения (ОПП) у женщин детородного возраста; ОПП и преэклампсия (ПЭ) могут приводить к последующему развитию ХБП, но степень реально существующего риска не вполне ясна [2–5]. В свою очередь ХБП, даже на ранних стадиях, оказывает негативное влияние на течение беременности [6–7]. Риск повышения скорости прогрессирования ХБП создает серьезные этические проблемы, касающиеся наступления и пролонгирования беременности [6–8]. Мы знаем, что ПЭ повышает вероятность развития артериальной гипертензии и ХБП в отдаленном периоде, но не знаем, могут ли наблюдение и ренопротективные методы затормозить прогрессирующую потерю функции почек, и если могут, то каким образом [9–12].
Мы знаем, что системные заболевания, такие как системная красная волчанка (СКВ), ревматоидный артрит (РА) и системная склеродермия (СС), чаще развиваются у женщин, чем у мужчин. Но мы не знаем, каков вклад этих состояний в прогрессирование до терминальной стадии хронической почечной недостаточности (тХПН) у женщин.
Мы знаем, что в когортных исследованиях распространенность ХБП у женщин всегда меньше и скорость прогрессирования в направлении тХПН ниже, чем у мужчин [13–15]. Но мы не знаем, связано ли это с различиями в выявлении поражений почек, различиями в доступе к медицинской помощи или же с истинными различиями в тяжести процесса и заболеваемости, и если связано, то в какой степени.
Риск развития сердечно-сосудистых заболеваний у женщин с ХБП выше, чем у женщин без ХБП [16], но все же ниже, чем у мужчин с такой же степенью повреждения почек. В когортах больных на гемодиализе отмечаются различия в типах сосудистого доступа у женщин и у мужчин, что может быть связано с биологическими и системными факторами. В некоторых регионах имеются различия в использовании перитонеального диализа и гемодиализа у женщин и мужчин.
Мы знаем, что женщины с большей долей вероятности отдадут почку для пересадки, чем получат ее. Но мы не знаем, связано ли это с различиями в заболеваемости ХБП у женщин по сравнению с мужчинами, с социокультурными факторами или же с другими причинами.
Мы знаем, что во многих регионах мира сохраняются гендерные различия в доступе к медицинской помощи, но у нас нет данных для непосредственной оценки этих различий, в особенности если это касается беднейших стран и регионов.
Беременность, преэклампсия, гипертензивные осложнения беременности и здоровье плода. Значение здоровья женщин для «почечного здоровья» в настоящем и в будущем
Что мы знаем
ПЭ служит основной причиной ОПП и материнской смертности в развивающихся странах [2, 17]. Беременность – самая частая причина ОПП у женщин детородного возраста [10, 18, 19]. Помимо ПЭ различные заболевания и состояния могут приводить к развитию ОПП, ассоциированного с беременностью. Причины ОПП различаются в зависимости от региона: криминальный септический аборт – главная причина ОПП в странах, где легальные аборты запрещены, тогда как ПЭ, возникшая после искусственного оплодотворения, становится ведущей причиной ОПП в развитых странах [12, 20–22].
ПЭ и гипертензивные осложнения беременности составляют 3–10% от всех случаев беременности [2–3, 18]. При этой патологии поражение почек, являющихся основной мишенью, развивается вследствие нарушения баланса между проангиогенными и антиангиогенными факторами, ведущего к массивному эндотелиальному повреждению, развитию гипертензии и протеинурии. Заболеваемость ПЭ особенно высока в странах с низким и средним доходом (что, возможно, отражает наличие нераспознанных хронических заболеваний), пик заболеваемости приходится на начало и конец репродуктивного периода [12, 20–22].
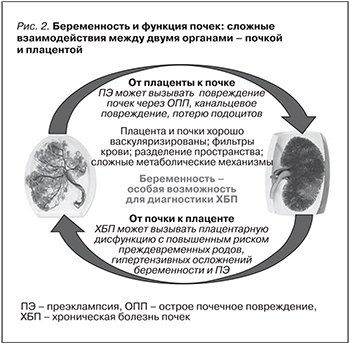 Взаимоотношения между почками и плацентой с очевидностью носят двусторонний характер. Наличие ХБП является фактором риска развития ПЭ и гипертензивных осложнений беременности (рис. 2). Кроме того, ряд других факторов риска ПЭ (диабет, иммунные заболевания, фоновая гипертензия, ожирение и метаболический синдром) являются также и факторами риска развития ХБП. Поскольку при многих из упомянутых заболеваний возникает та или иная степень нарушения функции почек, это также служит косвенным подтверждением роли почечной функции в развитии ПЭ. Современные определения ПЭ, основанные на новых ангиогенных-антиангиогенных маркерах, позволяют выявлять различия между «плацентарными» и «материнскими» причинами ПЭ [23, 24], что может играть важную роль для ведения пациенток во время беременности и после родоразрешения.
Взаимоотношения между почками и плацентой с очевидностью носят двусторонний характер. Наличие ХБП является фактором риска развития ПЭ и гипертензивных осложнений беременности (рис. 2). Кроме того, ряд других факторов риска ПЭ (диабет, иммунные заболевания, фоновая гипертензия, ожирение и метаболический синдром) являются также и факторами риска развития ХБП. Поскольку при многих из упомянутых заболеваний возникает та или иная степень нарушения функции почек, это также служит косвенным подтверждением роли почечной функции в развитии ПЭ. Современные определения ПЭ, основанные на новых ангиогенных-антиангиогенных маркерах, позволяют выявлять различия между «плацентарными» и «материнскими» причинами ПЭ [23, 24], что может играть важную роль для ведения пациенток во время беременности и после родоразрешения.
Известно, что имеются отдаленные последствия ПЭ для здоровья как матери, так и плода, они активно изучаются, но до настоящего времени многое еще остается неизвестным и неизученным.
ПЭ представляет собой фактор риска развития ХБП и тХПН у матери [3–5]. Механизмы не вполне ясны, однако, поскольку характерным признаком ПЭ является потеря подоцитов, предполагается значимая роль гломерулярного повреждения [25]. Ассоциированный с ПЭ эндотелиоз, наблюдаемый, однако, и при нормальной беременности, может предвещать гломерулосклероз; одновременно могут также присутствовать канальцевые и сосудистые повреждения [26, 27].
Помимо рисков для матери ПЭ ассоциирована с внутриутробной и перинатальной смертностью, преждевременными родами и задержкой внутриутробного развития; последние два осложнения ведут к рождению «маловесных детей» [2–3, 5]. Маловесные и недоношенные дети подвержены риску неврологического дефицита и постнатальных осложнений, в особенности сепсиса [28–32]. Эти риски могут быть особенно значимыми в странах с низким и средним доходом, поскольку выживаемость и бездефицитная выживаемость сильно зависят от возможности обеспечения интенсивной терапии и ухода в постнатальном периоде [20, 21]. Кроме того, «маловесные дети» имеют повышенный риск отдаленных последствий, таких как развитие диабета, метаболического синдрома, сердечно-сосудистых заболеваний (ССЗ) и ХБП во взрослом возрасте [33–37]. Поскольку развитие почек завершается в последнюю фазу беременности, задержка и недоразвитие почек с уменьшением количества нефронов, по-видимому, служат основой повышенного риска ХБП и гипертензии у недоношенных детей и детей с гипотрофией [33–37].
Беременность при хронической болезни почек, на диализе и после трансплантации
Что мы знаем
Хроническая болезнь почек
ХБП – фактор риска неблагоприятных исходов беременности уже на ранних стадиях (табл. 1) [6, 38, 39]. Риск последовательно повышается от ХБП 1-й стадии к ХБП 5-й стадии, к тому же относительно более высок при гломерулярных, аутоиммунных заболеваниях и диабетической нефропатии [6, 7, 38–41]. Исходы беременности у женщин, ставших донорами почки, позволяют предположить, что уменьшение массы почечной паренхимы ассоциировано с повышенным риском ПЭ и гипертензивных осложнений беременности [42, 43].
Фоновая гипертензия и протеинурия служат важным модулятором рисков, связанных с беременностью, но не всех рисков в одинаковой степени. Мы знаем, что риск возникновения пороков развития не повышен по сравнению с общей популяцией (исключая, разумеется, наследственные заболевания, такие как рефлюкс-нефропатия, поликистозная болезнь почек или врожденные аномалии почек и мочевых путей); материнская смертность низка (в странах с высоким доходом); а вот частота преждевременных родов и рождения детей с гипотрофией действительно связана уже с 1-й стадией ХБП и растет по мере ухудшения функции почек. Влияние беременности на прогрессирование ХБП не вполне ясно, поскольку дизайн, акушерская тактика и продолжительность наблюдения в проведенных исследованиях различались.
В целом известно, что непосредственное и отдаленное снижение функции почек, ассоциированное с беременностью, не свойственно ранним стадиям ХБП, но по мере усугубления тяжести ХБП риск ее прогрессирования возрастает [6, 7, 38–41, 44–48].
Беременность может оказаться поводом для выявления и установления диагноза ХБП. В странах с низкими или неравномерно распределенными ресурсами даже далеко зашедшая ХБП у женщин может оказаться выявленной лишь во время беременности. Последствия, связанные с началом диализа, могут порождать важные клинические и этические проблемы; в странах с высокими ресурсами и развитой пренатальной медицинской помощью диагностика ранних стадий ХБП дает возможность обеспечить более интенсивное лечение и наблюдение [49–51].
Диализ и трансплантация
При тХПН репродуктивная способность снижена. Данные, полученные в Европе и Австралии, указывают, что между женщинами с трансплантированной почкой и общей популяцией имеется соотношение 1:10, такое же соотношение между женщинами на диализе и женщинами с трансплантированной почкой (вероятность забеременеть у женщин на диализе составляет 1:100 по отношению к общей популяции) [52, 53]. Тем не менее первые единичные случаи успешной беременности на диализе описаны уже в 1970-е гг., а в новом тысячелетии возможность беременности на диализе стала общепризнанной [8, 54, 55].
Имеются сообщения о более чем 1000 беременностей у женщин на диализе [55]. Наиболее важным достижением стала демонстрация мощной взаимосвязи между интенсивностью (частотой и продолжительностью) диализных процедур и благополучными исходами беременности. Так, увеличение интенсивности диализа вплоть до ежедневного в настоящее время служит стандартом оказания медицинской помощи беременным на диализе [8, 54]. Знание о возможности благоприятных исходов беременности на диализе как для женщин, так и для потомства может влиять на тактику предгравидарного консультирования в случаях далеко зашедшей ХБП.
Репродуктивная способность отчасти восстанавливается после трансплантации почки [56–60]. Однако даже в идеальной ситуации (нормальная функция трансплантата, отсутствие гипертензии и протеинурии и как минимум 2 года после трансплантации без эпизодов отторжения) риск осложнений у женщин с трансплантированной почкой выше, чем в общей популяции. В целом, если исключено применение тератогенных препаратов (микофеноловой кислоты и рапамицина), исходы беременности после трансплантации почки обусловлены теми же факторами риска, что и при ХБП в целом (функция почек, гипертензия и протеинурия) [59].
Опыт ведения беременности у женщин со сниженной или почти полностью утраченной функцией трансплантата ограничен, и консультирование в таких случаях основывается преимущественно на индивидуальном опыте врача и на косвенных доказательствах [61, 62]. Технологии искусственного оплодотворения в некоторых ситуациях приобретают все большую популярность, но исследования в этой области у женщин с ХБП немногочисленны; многоплодная беременность может представлять дополнительный риск при ХБП, причем как для женщин с заболеваниями собственных почек, так и для реципиенток почечного трансплантата.
Аутоиммунные заболевания, женщины и заболевания почек
Что мы знаем
Аутоиммунные заболевания, такие как СКВ, РА и СС, поражают преимущественно женщин и характеризуются системным воспалением, приводящим к дисфункции органов-мишеней, в т.ч. и почек. Половые различия в заболеваемости и тяжести течения этих заболеваний служат следствием сложных взаимодействий множества гормональных, генетических и эпигенетических факторов (табл. 2). Аутоиммунные заболевания, в совокупности представляющие ведущую причину заболеваемости и смертности среди взрослых женщин, тяжелым бременем ложатся на систему здравоохранения [63–65].

СКВ представляет собой аутоиммунное заболевание с вовлечением многих органов и тканей, поражающее около 5 млн людей по всему миру. Среди больных СКВ преобладают женщины (соотношение женщин и мужчин – 9:1) и лица неевропейского происхождения. Особенно значимо преобладание женщин на пике репродуктивного возраста – оно достигает в этот период 15:1. Биологическая основа этой предрасположенности активно изучается: одним из объяснений являются количество Х-хромосом и генетические варианты Х-хромосом [66–68]. Другим важным этиологическим фактором, по-видимому, может служить уровень эстрогенов. Основное действие эстрогенов медиируется транскрипционной активностью рецепторов к эстрогену; тогда как у женщин с СКВ Т-клеточный рецепторный профиль этих рецепторов нарушен [69, 70]. Недавно была идентифицирована еще одна возможная причина СКВ – белок катепсин S, являющийся триггером иммунной атаки на здоровые клетки, особенно у женщин [71]. Многочисленные генетические маркеры, не относящиеся к HLA-системе, могут быть основой предрасположенности к СКВ у лиц европейского, латиноамериканского и афроамериканского происхождения [72]. Предрасположенность к СКВ в период беременности также носит многофакторный характер, одним из факторов является повышение экспрессии интерферона-α (ИФН-α). Повышенное количество ИФН-α, экспрессруемого плацентой, играет патогенетическую роль при СКВ, оказывая, с одной стороны, влияние на успешную плацентацию, с другой – увеличивая предрасположенность к СКВ [73]. Структурные и функциональные нарушения регуляторных Т-клеток (которые, по-видимому, обеспечивают модулирование толерантности материнского организма к антигенам плода) также могут вносить вклад в патологию беременности у женщин с СКВ [74]. Поражение почек при СКВ наблюдается примерно в половине случаев и включает как гломерулярные, так и интерстициальные и сосудистые повреждения. Волчаночный нефрит – основной фактор риска заболеваемости и смертности при СКВ и, несмотря на применение мощных терапевтических вмешательств, по-прежнему ведет к значительному нарушению функции почек у множества больных [75]. Поражение почек вызывает особое беспокойство при консультировании женщин с СКВ, планирующих беременность. Предсуществующая почечная патология и снижение уровня С4 представляют высокий риск развития активного нефрита в период беременности [76]. Социоэкономические различия также оказывают влияние на состояние здоровья пациентов с СКВ. Бедность ассоциирована с массой отдаленных последствий и повреждений, связанных с СКВ, и в 1,67 раза повышает вероятность развития клинически значимых последствий. Частота неблагоприятных исходов беременности при СКВ у женщин негроидной расы и у женщин латиноамериканского происхождения вдвое выше по сравнению с белыми. У женщин негроидной расы социоэкономический статус оказался определяющим для исходов беременности, внося основной вклад в развитие неблагоприятных исходов [77, 78].
РА также поражает преимущественно женщин (соотношение женщин и мужчин – 4:1) с пиком заболеваемости в возрасте 45–55 лет, что совпадает с перименопаузальным периодом. Эти данные позволяют предположить наличие взаимосвязи между дефицитом эстрогенов и началом заболевания. Соотношение женщин и мужчин в возрасте старше 60 лет составляет 1:1, что подразумевает роль изменения уровня половых гормонов в развитии РА; об том же свидетельствует и хорошо известное смягчение симптоматики и даже развитие ремиссии РА в период беременности [79–81]. Поражение почек при РА наблюдается достаточно часто, носит многофакторный характер и является предиктором смертности. Риск развития ХБП у больных РА превышает таковой в общей популяции. Развитие ХБП может быть результатом ряда длительно протекающих процессов, в т.ч. специфического поражения почек в рамках РА (гломерулонефрит, интерстициальный нефрит), хронического воспаления, нефротоксического воздействия применяемых лекарственных препаратов и наличия коморбидных состояний. Мощная ассоциация между активностью РА и АА амилоидозом повышает заболеваемость, амилоидоз служит основной причиной тХПН у пациентов с РА и поражением почек. Необходимо отметить также, что некоторые пожизненно применяемые виды комбинированной фармакотерапии сами по себе обладают различными побочными эффектами в отношении почек [82–84].
Преобладает у женщин и склеродермия (соотношение женщин и мужчин колеблется от 3:1 до 14:1) с пиком заболеваемости на пятом и шестом десятилетиях жизни. Возможная роль эстрогенов в патогенезе СС опосредованна через их стимулирующее воздействие на рецепторы трансформирующего фактора роста β1 и тромбоцитарного фактора роста [85]. Васкулопатия является одним из ведущих проявлений СС, предполагается, что гипоэстрогенемия в постменопаузальном периоде усиливает сосудистые изменения у женщин с СС [86]. При СС наблюдаются различные поражения почек, самым серьезным из которых является склеродермический почечный криз, протекающий с клиникой злокачественной артериальной гипертензии и острой почечной недостаточностью. Однако чаще наблюдается ишемическая нефропатия с альбуминурией, гипертензией и медленным прогрессированием ХБП [87]. Острая почечная недостаточность без гипертензии у пациентов с СС может быть обусловлена интерстициальным нефритом или сочетанием СС с АНЦА-ассоциированым васкулитом, в последнем случае исходы неблагоприятны [88–98].
Женщины, хроническая болезнь почек и доступ к заместительной почечной терапии
Что мы знаем
Несмотря на то что заместительная почечная терапия (ЗПТ), включая диализ и трансплантацию почки, является жизнеобеспечивающим методом лечения, не все пациенты получают ЗПТ. Доля больных тХПН, получающих ЗПТ, значительно различается между странами и регионами и сложным образом зависит от экономического состояния страны, от системы здравоохранения [90, 91]. Лишь 50% всех больных в мире, нуждающихся в ЗПТ, получают это лечение [92], а если рассматривать отдельно страны с низким и средним доходом, эта доля оказывается еще меньше; почти на всей территории субэкваториальной Африки ЗПТ получают менее 2% пациентов с тХПН [93]. Неравный доступ к ЗПТ вызывает особую озабоченность, поскольку во многих сообществах имеет место дискриминация женщин и девочек в отношении доступа к ЗПТ. Причины этой дискриминации коренятся главным образом в социокультурных факторах [94, 95].
Гендерные различия в доступе к диализу
Как минимум 2,284 млн людей могут преждевременно умереть из-за недостаточной доступности ЗПТ, причем различия в лечении особенно велики в странах с низким доходом. По самым скромным подсчетам, в Азии и Африке 1,907 млн и 432 тыс. пациентов соответственно не получают ЗПТ. К 2030 г. оценочное число больных на ЗПТ должно увеличиться более чем вдвое и достичь 5,439 млн (3,899–7,640 млн), наибольший прирост ожидается в Азии (с 0,968 млн до предполагаемых 2,162 [1,71–3,14 млн]) [92]. Эти цифры получены в результате тщательного систематического анализа.
Данные, которые позволили бы оценить гендерные различия в лечении, немногочисленны. Исследования, проведенные в Африке, показали, что мужчины с большей вероятностью будут получать ЗПТ по сравнению с женщинами [96, 97]. В Японии лечение тХПН у женщин осуществляется более чем вдвое реже, чем у мужчин (3,287 мужчин и 1,764 женщин на 1 млн популяции, получающей лечение) [91]: никаких объяснений этим данным не представлено. В одном из исследований, проведенных в США, сообщается, что у женщин отношение шансов позднего начала диализа значительно выше, чем у мужчин, – 1,7 [98]. Установлено, что осведомленность о наличии заболевания почек у женщин существенно ниже, чем у мужчин (2,9±1,6% у женщин и 17,9±5,9% у мужчин), что может быть одной из причин позднего начала ЗПТ [99].
Смертность на диализе среди мужчин и женщин одинакова, но частота некоторых осложнений диализа и заболеваемость у женщин выше. По данным американского отчета о 111,653 госпитализаций пациентов, получавших программный гемодиализ, частота госпитализаций и вероятность повторной госпитализации в течение 30 дней у женщин оказалась выше [100].
Кроме того, у женщин получающих гемодиализ, преимущественное использование артериовенозных фистул, обеспечивающее снижение смертности, частоты осложнений и стоимости лечения, менее распространено, чем у мужчин [101]. Этому можно найти ряд объяснений, включая анатомические/хирургические проблемы, обусловленные диаметром сосудов, временем обращения за медицинской помощью и разногласиями в позициях. Систематически этот вопрос не изучался.
Оценка дозы диализа по Kt/V может приводить к «недодиализу» у женщин, поскольку у них в среднем ниже объем распределения мочевины и общее количество воды в организме по сравнению с мужчинами [102]. Имеются данные о худших клинических показателях, в том числе более выраженной анемии, худшем питании и качестве жизни у женщин, получающих диализ [103]. Причины этого остаются неясными.
Гендерные различия в доступе к трансплантации почки
Трансплантация – оптимальный метод ЗПТ для пациентов, не имеющих противопоказаний. Данные, полученные во всем мире, свидетельствуют, что женщины с меньшей вероятностью окажутся реципиентами почечного трансплантата, будь то трансплантация от трупного или от живого донора. Вместе с тем женщины с большей вероятностью станут живыми донорами для трансплантации почки [104]. Данные из различных стран, в т.ч. из США, Франции, Китая и Индии, подтверждают различия в частоте трансплантации почек (у женщин ниже, чем у мужчин), а также меньшую вероятность попасть в лист ожидания и большую длительность пребывания на диализе до включения в лист ожидания для женщин. Матери и жены с большей вероятностью окажутся донорами почки [91,105–108]. Гендерное неравенство существует и в педиатрической популяции. Опрос, проведенный в 35 странах, участвующих в Регистре Европейского общества педиатрической нефрологии/Европейской почечной ассоциации/Европейской ассоциации диализа и трансплантации, показал, что девочки имеют худший доступ к трансплантации почки по сравнению с мальчиками [109].
Социоэкономические факторы, несомненно, играют роль в неравенстве между полами в отношении трансплантации, особенно в странах и регионах с низким и средним доходом. Как правило, именно мужчины обеспечивают основной доход семьи, и это может быть для них препятствием к донорству почки. Гендерные различия в служебном положении и доходах могут вносить вклад в различия доступности трансплантации, поскольку занятость и более высокий доход обычно связаны с лучшей страховкой, покрывающей стоимость трансплантации.
Психологические факторы и образование также влияют на гендерное неравенство. Данные, полученные в США, свидетельствуют, что женщины негроидной расы с меньшей вероятностью захотят трансплантацию от живого донора – невостребованные предложения трансплантации почки у них случаются в 2 раза чаще, чем у мужчин. В то же время они с меньшей долей вероятности будут рассматриваться как кандидаты на трансплантацию [110]. В других сообщениях описывают возрастное и гендерное неравенство в доступе к трансплантации почки, причиной которого служит более позднее информирование о трансплантации почки; причем даже независимо от возраста женщины скорее всего не будут иметь возможность обсудить перспективы трансплантации с представителями профессионального сообщества. Эти данные свидетельствуют о потребности в клинических рекомендациях и в образовании для женщин, социальных служб и для медицинских работников [111].
Настоящее и будущее – чего мы не знаем
Представленные выше данные, касающиеся беременности, ОПП, аутоиммунных заболеваний, ХБП, диализа и трансплантации, свидетельствуют о том, что остается еще много нерешенных вопросов. В странах с высоким доходом, в которых растут материнский возраст и частота искусственного оплодотворения, возможен рост ПЭ, что в свою очередь в случаях неблагоприятных исходов для плода может сказаться на будущих поколениях. Рост частоты применения методов экстракорпорального оплодотворения женщинами старшего материнского возраста может приводить к возникновению многоплодных беременностей, предрасполагающих к ПЭ, внутриутробной задержке развития или и к тому и другому. Означает ли это вероятный рост ХБП и ССЗ у женщин в будущем?
Из-за значительной гетерогенности ХБП мы не знаем, сказываются ли различия в характере нефропатий на исходах беременности и если сказываются, то каким образом? Доказательства помимо касающихся наиболее распространенных нефропатий, таких как IgA-нефропатия, волчаночный нефрит, диабетическая нефропатия и рефлюкс-нефропатия, крайне скудны [44,45,112–114]. Как следует определять предгравидарные риски беременности в свете пороговых значений протеинурии? Показания в отношении времени начала диализа в период беременности не установлены, как не установлена роль частоты и длительности диализа в таких случаях. Для реципиенток почечного трансплантата (особенно с учетом таких факторов, как политика расширенного донорства, старший возраст на момент трансплантации и возрастное снижение репродуктивной функции), возможен пересмотр взглядов на беременность при субоптимальной функции трансплантата [56, 60]. Однако неясно, как это может влиять на непосредственные и отдаленные исходы для матери и плода.
Беременность у девочек-подростков весьма распространена в некоторых регионах и часто ассоциирована с низкими доходами и низким уровнем культуры. Неустоявшиеся правовые нормы для искусственного оплодотворения и недостаток систематической оценки функции почек в таких ситуациях указывают на необходимость дальнейших исследований.
Несмотря на убедительные доказательства роли половых гормонов для здоровья сосудов и иммунорегуляции, остается неясным столь значимое преобладание женщин среди больных СКВ, РА и СС по сравнению с другими системными заболеваниями, такими, например, как АНЦА-ассоциированные васкулиты и гемолитико-уремический синдром. При этом следует отметить, что тромботическая тромбоцитопеническая пурпура также чаще встречается у женщин, хотя это, вероятно, обусловлено связью этой патологии с другими заболеваниями, более распространенными среди женщин. Частота вовлечения почек у женщин с СКВ во время беременности и сходства/различия с теми, у кого развивается ПЭ, еще недостаточно изучены. Роль различных лекарственных препаратов и ответ на терапию при атуоиммунных заболеваниях в зависимости от пола пациентов также остаются неизученными.
Особое внимание к сходству между различными состояниями, роли половых гормонов в воспалении, иммуномодуляции и сосудистому здоровью со временем может привести к важным выводам и клиническим открытиям. Если женщины разного возраста с большей вероятностью становятся живыми донорами, влияет ли это на риск ССЗ и тХПН? Достаточно ли изучен этот вопрос в настоящее время, когда имеется возможность применения современных диагностических критериев ХБП и сложных инструментов оценки почечного резерва? Осложняются ли дополнительные воздействия, которые испытывают женщины, ставшие донорами почки, гормональными изменениями сосудов при старении? И повышен ли риск ХБП и ПЭ у молодых женщин, ставших донорами почки?
В контексте специфических видов терапии, направленных на лечение и замедление прогрессирования ХБП, знаем ли мы о гендерных различиях в ответе на терапию иАПФ/БРА? Должны ли мы корректировать дозы в зависимости от пола больных? Если биология сосудов иммунной системы подвержена, как это указано выше, влиянию половых гормонов, то что мы знаем о влиянии различных видов терапии на уровень и соотношение половых гормонов? Как сказываются изменения экономической, социальной и культурной ситуации на здоровье женщин в странах с низким и средним доходом и каково влияние нутриционного статуса на ХБП в свете роста частоты таких заболеваний, как ожирение, диабет и гипертензия?
Заключение
У женщин имеются специфические риски заболеваний почек; заболевания почек, так же как и проблемы, связанные с доступом к лечению, оказывают серьезное влияние на здоровье ныне живущих и будущих поколений. Чтобы поддерживать здоровье семей, общества и популяции в целом, необходимо активно выступать за повышение доступности медицинской помощи для женщин.
Исследования, направленные на изучение уникальной роли половых гормонов и взаимодействия половых гормонов с другими физиологическими механизмами, чрезвычайно важны для лучшего понимания особенностей прогрессирования заболеваний почек. Дальнейшие исследования специфических иммунологических состояний, таких как беременность (рассматриваемая как состояние иммунной толерантности к «не-своему»), а также СКВ и другие аутоиммунные и системные заболевания, могут приводить к открытиям в понимании их сути и к изменениям парадигмы лечения.
Имеется отчетливая необходимость в повышении осведомленности, своевременной диагностике и адекватном наблюдении женщин с ХБП в период беременности. В свою очередь беременность может оказаться поводом для обследования и ранней диагностики ХБП, что позволит планировать ранние терапевтические вмешательства.
Всемирный День почки-2018 и Международный женский день отмечаются одновременно, что дает нам повод привлечь внимание общественности к важности состояния здоровья женщин, особенно их «почечного здоровья».
13-й Всемирный День почки пропагандирует приемлемый по уровню затрат и равный доступ к образованию по вопросам здоровья, медицинской помощи и мерам профилактики для женщин, девушек и девочек во всем мире.
Совпадение Всемирного Дня почки и Международного женского дня дает нам также возможность разработать и предложить наилучшую практику и спланировать будущие исследования, чтобы в конченом итоге оптимизировать исходы для всех людей с заболеваниями почек или с риском этих заболеваний.

