Введение
Сердечно-сосудистые заболевания остаются основной причиной смерти больных, получающих лечение гемодиализом (ГД) [1, 2], при этом хроническая сердечная недостаточность (ХСН) рассматривается в рамках кардио- и ренокардиального синдромов [3]. Ремоделирование сердца и ХСН развиваются у многих больных задолго до начала заместительной почечной терапии [4].
ГД существенно меняет клиническое течение ХСН. Ликвидация гипергидратации и гиперволемии, коррекция артериальной гипертензии (АГ), электролитных нарушений приводят к клиническому улучшению и расширяют возможности лечения больных ХСН. Тем не менее проблема ХСН для больных на ГД остается крайне актуальной, в т.ч. в связи с тем, что ХСН – одна из важнейших причин развития жизнеугрожающих нарушений ритма сердца [5], которые служат основной непосредственной причиной смерти больных на ГД [2].
CRIC Study [6] показало, что пульсовое артериальное давление (ПАД) связано с ХСН у больных хронической болезнью почек (ХБП) 4–5-й стадий, не получающих заместительной почечной терапии. В отличие от додиализных стадий ХБП на ГД большое значение в коррекции АГ отводится адекватному ГД, который также влияет на клинические проявления ХСН. В связи с этим нельзя переносить данные, полученные на начальных стадиях ХБП, на больных на ГД.
Помимо офисного измерения артериального давления (АД) в последние годы для диагностики и оценки АГ широко применяется суточное мониторирование АД (СМАД) и самостоятельное измерение АД больным в домашних условиях (Home Blood Pressure Measurements). В ряде работ показано преимущество СМАД над офисным АД [7–9], широко обсуждаются возможности домашнего измерения АД [10].
Целью задачи стало исследование взаимоотношения между параметрами АД при разных методах измерения и ХСН у больных, получающих лечение ГД.
Материал и методы
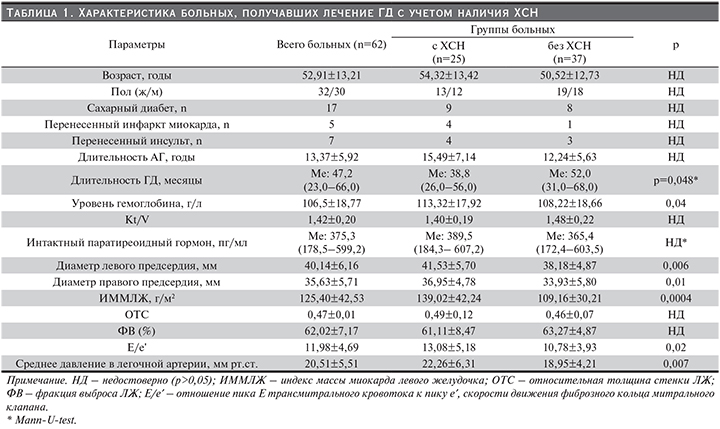
Обследованы 62 (32 женщины, 30 мужчин, средний возраст – 52,9±13,2 года) пациента, находившихся на лечении ГД не менее 1 года. Причиной ХБП служили гломерулонефрит (29), поликистоз почек (12), сахарный диабет (10), мочекаменная болезнь (9), пиелонефрит (1), амилоидоз почек (1). Тридцать шесть больных имели АГ, 25 – ХСН I–IIБ стадий, I–III функциональных классов, которую диагностировали и оценивали в соответствии с Национальными рекомендациями ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Характеристика больных представлена в табл. 1.
ГД проведено на аппаратах Nipro Surdial X и Nipro Surdial TM-55 Plus в среднем по 4 часа 3 раза в неделю с использованием бикарбонатного диализирующего раствора и диализаторов Elisio-17H, Elisio-21H с мембраной Polynephron. Kt/V составлял от 1,2 до 1,8.
Офисное измерение АД проведено до и после ГД, анализировали САД, ДАД, ПАД.
СМАД выполняли на протяжении 24 часов на следующие после ГД сутки аппаратом CardioTens Meditech Ltd. (Венгрия). Анализировали следующие параметры: средние величины САД, ДАД и ПАД, индексы «нагрузки давлением», а также степень ночного снижения (СНС) АД. Суточный профиль АД оценивали по СНС САД и ДАД с использованием общепринятых критериев определения двухфазного ритма [11].
Кроме того, больные самостоятельно определяли АД в домашних условиях автоматическими приборами дважды в день (утром и вечером), заполняя дневник наблюдения на протяжении 30 дней, включая и дни проведения ГД. Анализировали САД в утренние часы (САДсамУ), ДАД (ДАДсамУ), ПАД (ПАДсамУ) в вечерние часы (САДсамВ, ДАДсамВ, ПАДсамВ).
Больным выполнены эхокардиография и допплерэхокардиография. Эхокардиографическое исследование проведено на аппарате GEVividE9 в М-режиме импульсным датчиком 3,5 МГц в положении больного на левом боку; измерения проведены согласно рекомендациям Американского эхокардиографического общества. Фракцию выброса (ФВ) считали сохранной при ФВ≥50%, определенной по методу Симпсона. Масса миокарда левого желудочка (ММЛЖ) рассчитана по формуле Devereux. Определен индекс массы миокарда левого желудочка (ИММЛЖ) как отношение ММЛЖ к площади поверхности тела.
Гипертрофия миокарда левого желудочка (ЛЖ) диагностирована при ИММЛЖ 115 г/м2 и более у мужчин и 95 г/м2 и более у женщин. Относительную толщину стенки (ОТС) ЛЖ рассчитали по формуле: ОТС=2×ЗСЛЖ (задняя стенка ЛЖ)/КДР (конечно-диастолический размер). Нормальной геометрией ЛЖ считали ОТС≥0,42 при нормальном ИММЛЖ, концентрическое ремоделирование диагностировали при ОТС>0,42 и нормальном ИММЛЖ, концентрическую гипертрофию ЛЖ (ГЛЖ) диагностировали при ОТС>0,42 и увеличенном ИММЛЖ, эксцентрическую ГЛЖ – при ОТС≤0,42 и увеличенном ИММЛЖ [12]. Диастолическую функцию оценивали с использованием тканевого допплера. Отношение пика Е трансмитрального кровотока к пику e′ скорости движения фиброзного кольца митрального клапана (E/e′)≥13 считали признаком диастолической дисфункции.
Результаты обработаны с применением программы Statistica for Windows 7.0. Характер распределения данных вариационного ряда оценивали с помощью Shapiro-Wilk W-test. Статистическую достоверность различий определяли при нормальном распределении параметров по t-критерию Стьюдента для связанных или несвязанных переменных, в случае если распределение отличалось от нормального, использовали Mann–Whitney U-тест или Wilcoxon Wilcoxon при сравнении бинарных переменных χ2. Проведены корреляционный анализ (в зависимости от вида распределения – Pearson или Spearman), одно- и многофакторный регрессионные анализы. При распределении данных, близких к нормальному, показатели представлены как M±SD, где M – среднее арифметическое, SD – стандартное отклонение. В противном случае данные представлены в виде Me (ИКР), где Me – медиана, ИКР – интерквартильный размах: 25-й–75-й процентиль. Различие считали достоверным при р<0,05.
Результаты исследования
АГ, по данным преддиализного офисного измерения АД, наблюдалась у 36 (58%) больных: по результатам 24-часового СМАД – у 25 (40,3%), при самостоятельном измерении АД в домашних условиях – у 40 (64,5%) больных. ГЛЖ диагностирована у 41 (66,1%) больного. ХСН диагностирована у 25 пациентов, у всех больных с сохраненной ФВ ЛЖ (ФВ ЛЖ≥50%).
Длительность лечения ГД была больше у больных ХСН. Больные ХСН имели больше ИММЛЖ, относительная толщина стенки ЛЖ существенно не различалась (табл. 1).
Параметры офисного, домашнего измерений АД и СМАД у больных ХСН и без ХСН представлены в табл. 2.

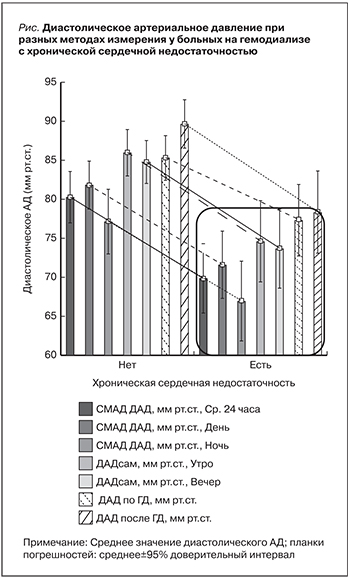
У больных ХСН было ниже среднесуточное ДАД (р<0,001), выше ПАД (р=0,007), но они не различались по уровню САД (р=0,5). Среднее ДАД, по результатам самостоятельного измерения АД, было значительно ниже у пациентов с ХСН (утреннее ДАД – 75,0±9,1 против 86,0±11,3 мм рт.ст.; р<0,001, и вечернее ДАД – 73,8±10,9 против 84,4±8,4 мм рт.ст. соответственно; р<0,001; см. рисунок).
 В группах пациентов с ДАД по результатам самостоятельного измерения АД меньше 80 мм рт.ст. и больше либо равно 80 мм рт.ст., статистически значимо не различались объем левого предсердия (40,50±4,65 и 38,50±5,89 мм соответственно; р=0,2) и отношение E/e′ (12,89±4,47 и 11,37±5,03; р=0,2). Не обнаружено связи между уровнем паратиреоидного гормона и САД (R=0,02; р=0,9), ДАД (R=0,05; р=0,7), ПАД (R=0,06; р=0,6).
В группах пациентов с ДАД по результатам самостоятельного измерения АД меньше 80 мм рт.ст. и больше либо равно 80 мм рт.ст., статистически значимо не различались объем левого предсердия (40,50±4,65 и 38,50±5,89 мм соответственно; р=0,2) и отношение E/e′ (12,89±4,47 и 11,37±5,03; р=0,2). Не обнаружено связи между уровнем паратиреоидного гормона и САД (R=0,02; р=0,9), ДАД (R=0,05; р=0,7), ПАД (R=0,06; р=0,6).
Многофакторный регрессионный анализ, в который в качестве независимых переменных включены пол, возраст и параметры, связанные с ХСН, при однофакторном корреляционном анализе (при р<0,05) показал, что средние утреннее и вечернее ДАД были обратно независимо ассоциированы с ХСН (Beta=-0,62; р=0,001 и Bet=-0,56; р=0,003 соответственно). Относительный риск ХСН при ДАД<80 мм рт.ст. составил 1,16 (95% доверительный интервал [ДИ] – 1,06–1,27) для среднего утреннего ДАД и 1,16 (95% ДИ 1,05–1,28) для среднего вечернего ДАД, рассчитанных по результатам самостоятельного измерения АД. Статистически достоверной связи между офисным ДАД и ХСН не наблюдалось. Индекс времени гипотонии и индекс площади гипотонии под кривой САД, ДАД, степень ночного снижения САД и ДАД в междиализный день были связаны с ХСН только при простом (однофакторном) анализе.
Обсуждение
ГЛЖ диагностирована нами у 66,1%, ХСН – у 40,3% пациентов. ГЛЖ развивается у большинства больных до начала заместительной почечной терапии и ее основной причиной служит АГ [9, 13]. Больные были обследованы нами спустя как минимум год лечения ГД в стабильном состоянии для того, чтобы уменьшить влияние перегрузки объемом на уровень АД и клинические проявления ХСН.
По данным биоимпедансометрии, гипергидратация наблюдается у четверти больных, получающих лечение ГД, и является важным фактором в патогенезе АГ, ГЛЖ и сердечной недостаточности [14]. Динамика междиализного САД связана с выживаемостью больных на ГД в отличие от пред- и интрадиализного САД [15]. Вероятно, это связано с тем, что АГ в междиализные дни прямо связана с задержкой жидкости [16]. Домашнее, но не пред- и постдиализное АД связано с ГЛЖ у больных на ГД [17, 18]. Утреннее, а не преддиализное измерение АД чаще позволяет выявлять АГ [19].
Наличие АГ в начале лечения ГД служит благоприятным признаком для больных ХСН пожилого возраста [20]. В то же время низкое додиализное САД (<100 мм рт.ст.) является неблагоприятным признаком, в т.ч. за счет высокого риска развития интрадиализной гипотензии [21]. Низкое САД (<90 мм рт.ст.) считается неблагоприятным прогностическим фактором для больных ХСН [22], причем прогноз больных ХСН зависит от уровня АД независимо от ФВ ЛЖ [23]. Полученные нами данные свидетельствуют: низкое диастолическое АД у больных на ГД ассоциировано с наличием у них ХСН. Особенно эта закономерность четко прослеживается при самостоятельном измерении ДАД и при СМАД в дневные часы.
С одной стороны, это неудивительно, т.к. снижение ДАД и повышение ПАД характерны для больных пожилого и старческого возраста, что связывают с повышением жесткости артерий [12]. Наши данные свидетельствуют о том, что низкое ДАД ассоциировано с ХСН у больных на ГД независимо от возраста и пола. Высокое пульсовое АД служит предиктором развития сердечно-сосудистых событий и сердечно-сосудистой смертности как в общей популяции [24, 25], так и у больных на ГД [26, 27]. Более того, у больных на ГД ПАД выше, чем в общей популяции, сопоставимой по полу и возрасту [28]. Значительные изменения ПАД в сторону как повышения (>5 мм рт.ст.), так и понижения (≥25 мм рт.ст.) в процессе длительного лечения ГД прогностически неблагоприятны [1]. Вместе с тем необходимо учитывать, что не только АД влияет на сердце и сосуды, но и патология сердца и сосудов влияет на уровень АД. Так, САД до ГД более тесно связано с летальностью в группе с менее тяжелой патологией сердца (оценивали по уровням тропонина и концевого фрагмента предсердного натрийуретического пептида) [29].
Наряду с диастолическими параметрами размер левого предсердия является интегральным показателем, характеризующим давление заполнения ЛЖ. Даже при нетяжелой ХСН, которая выявляется только в тесте с физической нагрузкой, увеличение объема левого предсердия служит маркером повышенного давления заполнения ЛЖ [30]. У обследованных нами больных диаметр левого предсердия был больше при наличии ХСН.
Повышение жесткости артерий – важный независимый фактор увеличения давления заполнения ЛЖ у больных ХСН с сохранной ФВ [31]. Ранее нами было показано, что такой параметр сосудистой податливости, как отношение ПАД к ударному объему сердца, ассоциирован с ГЛЖ у больных додиализной ХБП [32]. Вместе с тем нами не установлена связь между уровнем паратиреоидного гормона и параметрами САД, ДАД, ПАД.
Помимо объема левого предсердия такой параметр диастолической дисфункции, как отношение E/e′, был больше у больных ХСН, при этом в группах пациентов с ДАД меньше или больше 80 мм рт.ст. как объем левого предсердия, так и отношение E/e′ не различались. С одной стороны, это можно объяснить недостаточной информативностью представленных показателей [33], различием между центральным АД и АД на периферии [34], с другой – тем, что диастолическая функция не является определяющей детерминантой уровня диастолического АД.
До настоящего времени нет единого мнения, на какие параметры при оценке АД следует ориентироваться у больных на ГД. В определенной степени к унификации должно приводить использование согласительного документа ERA-EDTA и ESH по АГ у больных на заместительной почечной терапии [35], хотя доказательная база остается недостаточной, а многие выводы основаны на мнении экспертов. В отношении больных, получающих лечение ГД, следует обратить внимание на то, что низкий уровень ДАД при самостоятельном измерении АД в утренние часы и при СМАД в дневные ассоциирован с ХСН с сохранной ФВ.
Заключение
ХСН наблюдается у 40% больных, получающих лечение ГД, и в большинстве случаев характеризуется сохранной ФВ. Средние утреннее и вечернее ДАД, рассчитанные по результатам самостоятельного измерения АД в домашних условиях в течение 30 суток, имеют более сильную независимую обратную связь с ХСН, чем параметры СМАД, проведенного на следующий день после ГД. Низкое ДАД (менее 80 мм рт.ст.) у больных на ГД ассоциировано с наличием ХСН.

