Введение
Хронический гломерулонефрит (ХГН) принадлежит к числу наиболее часто встречающихся первичных заболеваний почек [1, 2]. Практически все пациенты с ХГН на разных этапах его течения нуждаются в тех или иных видах коррекции метаболического статуса [2, 3]. Разработка целенаправленных подходов к нормализации метаболических нарушений у пациентов ХГН – одна из важных задач клинической нефрологии. Таким образом, среди неиммунных факторов прогрессирования почечной дисфункции и присоединения сердечно-сосудистых осложнений (ССО) при ХГН важная роль отводится содержанию мочевой кислоты сыворотки крови (МКСК). Если распространенность гиперурикемии в общей популяции достигает до 25%, то у лиц, страдающих почечной дисфункцией, этот показатель возрастает до 80% [4]. Результаты эпидемиологического исследования ЭССЕ-РФ показали, что увеличение содержания МКСК достоверно чаще регистрируется у лиц мужского пола и ассоциируется с артериальной гипертензией, ожирением, приемом диуретиков [5]. Следует отметить, что тесная связь между повышением артериального давления (АД) и нарушением пуринового обмена отмечены еще в исследованиях видных советских терапевтов Г.Ф. Ланга [6] и Е.М. Тареева [7]. Дальнейшие исследования показали, что исходный уровень МКСК предсказывал возникновение в будущем почечной дисфункции [8], и этот факт нашел подтверждение в недавно проведенном исследовании W. Wang и соавт. [9]. В результате ряда исследований установлен факт повреждения ткани почек повышенным уровнем МКСК, что приводит к активации локальной ренин-ангиотензин-альдостероновой системы (РААС). В свою очередь замедление скорости клубочковой фильтрации (СКФ) ассоциируется со снижением клиренса МКСК [10,4]. В последние годы активно изучается самостоятельная роль гиперурикемии в возникновении и прогрессировании почечной дисфункции [11,12–18].
Цель исследования. Изучить клинико-функциональные проявления и половые особенности хронических гломерулонефритов в ассоциации с гиперурикемией.
Объект и методы исследования
Обследованы 163 пациента ХГН (102 мужчины и 41 женщина; средний возраст – 42,6±13,0 года) в возрасте 17–71 года. Клинический диагноз ХГН был установлен на основании критериев предложенных И.Е. Тареевой [19]. Анамнестически средняя длительность заболевания у обследованных пациентов составляла от 5 до 16 лет. Обследование пациентов было комплексным с применением клинических, лабораторных и инструментальных методов. Тип исследования аналитическое (одномоментное). В зависимости от пола общая выборка была подразделена на 2 группы: в 1-ю группу вошли 102 мужчины, во 2-ю – 41 женщина, сопоставимые по возрасту. Критерием включения в исследование были пациенты с ХГН на разных стадиях хронической болезни почек (ХБП). Из исследования исключались лица с ХБП, находившиеся на этапе диализной терапии, принимавшие диуретики, циклоспорин, аллопуринол и лозартан. Согласно имеющимся рекомендациям, критерием гиперурикемии для лиц мужского пола принимали содержание МКСК >0,42 ммоль/л, для женщин >0,36 ммоль/л [20].
Лабораторные исследования включали определение уровня гемоглобина (Hb), количества эритроцитов и тромбоцитов в периферической крови, мочевой кислоты, фибриногена, общего белка, электролитов, липидного профиля, креатинина крови и суточной протеинурии. Функциональное состояние почек оценивалось на основании обследования пациентов с определением скорости клубочковой фильтрации (СКФ), рассчитанной по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [21].
Структурные изменения сердца выявлены с помощью неинвазивного ультразвукового эхокардиографического (ЭхоКГ) исследования на ультразвуковом аппарате «Sequoia-512» корпорации «Siemens-Acuson» (Германия, США) по общепринятой методике. Диаметр восходящей аорты (см), продольный размер левого предсердия (см), толщину стенок (см), размеры полости левого желудочка (ЛЖ) оценивали из парастернального доступа по длинной оси ЛЖ. Измеряли толщину межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ЗСЛЖ) в диастолу, определяли конечный диастолический (КДР) и конечный систолический размеры (КСР) ЛЖ. Исследовали также фракцию выброса (ФВ, %) ЛЖ по Simpson. Массу миокарда ЛЖ (ММЛЖ) рассчитывали по формуле R.B. Devereux et al. (1986): ММЛЖ (г)=0,8 – {1,04 – (КДР+МЖП+ЗСЛЖ)3 – КДР3}+0,6 [22].
Индекс массы миокарда ЛЖ (ИММЛЖ) определен как отношение ММЛЖ к площади поверхности тела. Критерии гипертрофии левого желудочка (ГЛЖ) и типов структурных изменений миокарда определены в соответствии с рекомендациями ЕОК от 2016 г. [23]. Для оценки ГЛЖ рассчитан ИММЛЖ, верхнее значение нормы которого составило для женщин 95, для мужчин – 115 г/м2. Относительную толщину стенок (ОТС) ЛЖ рассчитывали для каждого больного как (МЖП+ЗСЛЖ)/КДР ЛЖ. За увеличение ОТС принимали величину более 0,42 единицы [23]. В зависимости от величины ИММЛЖ и ОТС были выделены следующие типы структурного состояния геометрии ЛЖ: нормальная геометрия ЛЖ (ОТС<0,42; нормальный ИММЛЖ), концентрическое ремоделирование (ОТС>0,42; нормальный ИММЛЖ), концентрическая гипертрофия (ОТС>0,42; ИММЛЖ больше нормы), эксцентрическая гипертрофия (ОТС<0,42; ИММЛЖ больше нормы).
Статистическая обработка материала проведена с помощью лицензированного пакета программ «Statistica 6.0». Значимость различий между группами оценена с помощью t-критерия Стьюдента (для переменных с нормальным распределением) и теста Манна–Уитни (для переменных с непараметрическим распределением). Данные представлены как среднее±стандартное отклонение для переменных с нормальным распределением, медиана (25–75%) – для переменных с непараметрическим распределением [24]. Для оценки корреляционной взаимосвязи применен способ Пирсона. Уровнем статистической достоверности считалось значение p<0,05.
Результаты исследования
Проведенное нами исследование было нацелено прежде всего на изучение клинико-функциональных проявлений гломерулонефритов в ассоциации с гиперурикемией в зависимости от половых особенностей.
В табл. 1 представлено распределение обследованных пациентов по клиническим типам ХГН. Из нее следует, что доля лиц с нефротическим и смешанным типами гломерулонефритов в обеих группах были схожими. Однако в группе лиц мужского пола существенно преобладал гипертонический тип ХГН по сравнению с женщинами; правда, показатель не достигал статистически значимого порога. Тогда как во 2-й группе, т.е. у женщин, число пациентов с латентным типом ХГН было достоверно выше (табл. 1).
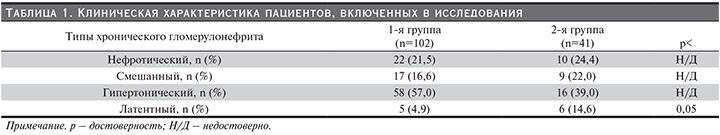
Из табл. 2 видно, что каких-либо межгрупповых различий по возрасту, длительности ХГН и параметрам гемодинамики получено не было. Важно подчеркнуть, что индексы периферической крови достоверно различались между группами (табл. 2). В частности, статистически значимое снижение содержания гемоглобина (114,9±22,3 против 140,2±24,5 г/л; р<0,05), числа эритроцитов (3,99±0,52×1012/л против 4,54±0,54 ×1012/л; р<0,05) и тромбоцитов (230,6±28,4×109/л против 246,1±28,3×109/л; р<0,05) отмечались в группе лиц женского пола. Уровень гиперурикемии у мужчины и женщин различался: так, у женщин средний уровень МКСК был существенно ниже, чем у мужчин (табл. 2).
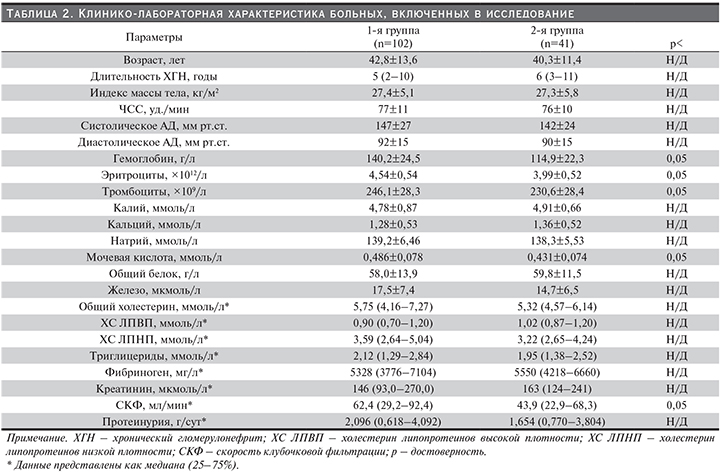
Концентрация железа, креатинина и показатели липидного спектра в обследованных группах достоверно не различались. Обращают на себя также внимание и показатели азотовыделительной функции почек в исследуемых когортах. Так, в группе лиц женского пола отмечено статистически значимое снижение СКФ (43,9 [22,9–68,3] против 62,4 [29,2–92,4] мл/мин; р<0,05). Полученная разница в параметрах фибриногена и суточной протеинурии в исследуемой выборке не достигла статистически значимого уровня.
Следующим шагом настоящего исследования стал структурный анализ эхокардиографических параметров у обследованных нами лиц, результаты которого отражены в табл. 3.
В группе мужчин прослеживалось достоверное увеличение диаметра восходящей аорты (3,51±0,43 против 3,14±0,25 см; р<0,05), продольного размера левого предсердия (3,57±0,47 против 3,36±0,39 см; р<0,05), конечного систолического (3,40±0,56 против 3,14±0,35 см; р<0,05) и диастолического размеров ЛЖ (5,25±0,51 против 4,93±0,41 см; р<0,05) по сравнению с лицами женского пола. При этом показатели глобальной функции ЛЖ, т.е. ее фракция выброса и относительная толщина стенок между исследуемыми когортами не различались (табл. 3).
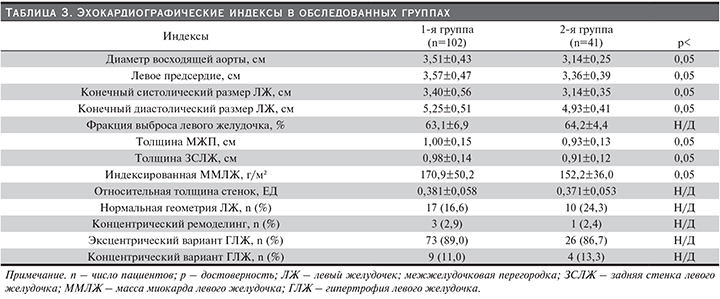
Заметная тенденция увеличения толщины межжелудочковой перегородки и задней стенки ЛЖ наблюдалась и в группе мужчин. Одновременно в той же группе был обнаружен статистически значимый рост уровня индекса массы миокарда ЛЖ. Кроме того, анализ структурных изменений геометрии ЛЖ показал тенденцию сокращения числа пациентов с нормальной геометрией ЛЖ у лиц мужского пола. Примечательно, что доля пациентов с различными типами структурной перестройки ЛЖ в группе как мужчин, так и женщин была схожей. Это и послужило основанием для проведения корреляционного анализа в каждой группе, результаты которой отражены в табл. 4.
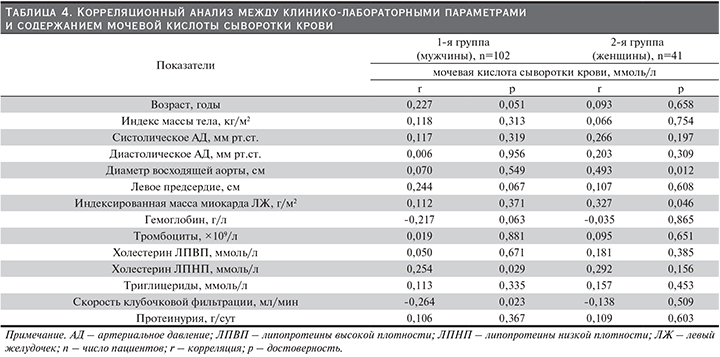
Как отмечено в табл. 4, видно, что достоверная прямая корреляция отмечается между содержанием МКСК и холестерином липопротеинов низкой плотности (r=0,254; p=0,029) и обратная связь с величиной СКФ (r=-0,264; p=0,029) в группе мужчин, чего не было в группе женщин. Необходимо отметить, что во 2-й группе, т.е. у лиц женского пола, прослеживалась положительная взаимосвязь между концентрацией МКСК и диаметром восходящей аорты (r=0,493; p=0,012). С другой стороны, в той же группе имела место прямая связь между уровнем МКСК и величиной ИММЛЖ (r=0,327; p=0,046). Данный факт полностью согласуется с результатами других работ [25], где у лиц женского пола с ХГН на додиализных стадиях показана прямая корреляционная связь между повышением уровня МКСК и увеличением ИММЛЖ.
Обсуждение
Результаты проведенного нами исследования больных ХГН на преддиализной стадии заболевания с увеличением концентрации мочевой кислоты сыворотки крови у мужчин свидетельствуют о возникновении структурных изменений левого желудочка, у пациентов женского пола – о развитии анемии и торможении СКФ.
В физиологических условиях гомеостаза здорового организма разница в показателях МКСК у мужчин и женщин в общей популяци объясняется тем, что эстрогены оказывают выраженное урикозурическое действие, а после развития менопаузы этот эффект устраняется [26, 27]. По данным отдельных исследователей, мужчины и женщины с ХБП различаются симптомами и признаками заболевания, различным реагированием на терапию и ее переносимостью [28, 29]. Следует отметить, что в большинстве сравнительных клинико-эпидемиологических исследований доля лиц женского пола составляет меньшинство, хотя сегодня признано, что половые различия имеют фундаментальное значение для большинства заболеваний, включая ХБП [30, 31]. В нашем исследовании число пациентов женского пола было также малочисленным по сравнению с мужчинами.
У здоровых лиц в ткани почек 90% профильтрованной мочевой кислоты реабсорбируется с участием транспортных систем, расположенных в апикальных мембранах проксимальных канальцев. В дальнейшем почти половина мочевой кислоты секретируется в дистальных отделах нефронов, причем степень секреции зависит от уровня МКСК [32]. При почечной дисфункции вследствие тубулоинтерстициальных изменений замедляется выведение МКСК и регистрируется при снижении СКФ. Перегрузка кристаллами моноуратов почечного тубулоинтерстиция приводит к усилению миграции и активации макрофагов, активации выработки ими медиаторов воспаления, вазоконстрикции, в итоге – к нарастающему тубулоинтерстициальному фиброзу, проявляющемуся снижением азотовыделительной функции почек [33]. С другой стороны, определен вклад Т-клеточной и макрофагальной инфильтрации в развитие и прогрессирование интерстициального поражения [34]; происходит инициация и поддержание воспаления и фиброза, в т.ч. опосредованно через активацию эффекторных клеток, продуцирующих матрикс, таких как тубулоциты и фибробласты. В условиях гиперурикемии происходит усиление экспрессии трансформирующего β-фактора роста 1-го типа с последующим изменением фенотипа тубулоинтерстициальной ткани и прогрессирования тяжести нефросклероза [35, 36].
Вместе с тем известно, что рост уровня МКСК приводит к подавлению образования оксида азота, усилению агрегации тромбоцитов, увеличению провоспалительной активности и продукции провоспалительных цитокинов [37]. Безусловно, присутствие названных патофизиологических сдвигов ухудшает течение ХБП и при наслоении гиперурикемии возрастает сердечно-сосудистые риски.
Предполагается, что уровень МКСК не только ассоциируется с сопутствующим действием инсулина, артериального давления и липидных показателей, но и может предсказать снижение чувствительности к инсулину и развитие сахарного диабета 2 типа в будущем. Следовательно, МКСК является потенциальной мишенью для предупреждения развития нарушения толерантности к глюкозе, гиперинсулинемии, повышению уровней АД и дислипидемии [38, 39].
M. Kaufman (2013) и R. Johnson (2013) показали, что имеется взаимосвязь уровней МКСК со снижением СКФ, к тому же гиперурикемии присваивается роль независимого фактора риска развития и прогрессирования ХБП [40,41]. И напротив, коррекция гиперурикемии с применением ингибиторов ксантиноксидазы достоверно замедляет прогрессирование почечной дисфункции [42]. По данным отдельных исследований, уровень МКСК является лабораторным маркером тяжести оксидативного стресса [43]. Как было отмечено, в группе женщин показатели красной крови и СКФ были сниженными, что вполне согласуется с имеющимися литературными данными. При ХБП появление анемии, как правило, ассоциируется снижением СКФ и прогрессирует по мере усугубления тяжести почечной дисфункции [44, 45]. Этот факт полностью нашел отражение и в наших исследованиях, т.е. в группе лиц женского пола замедление СКФ сочеталось со сниженным уровнем гемоглобина, чего не было в группе мужчин (табл. 2). Как было отмечено выше, увеличение МКСК также сопровождается ростом уровня оксидативного стресса, сочетание которого с анемическим синдромом достоверно ускоряет структурно-функциональные изменения со стороны сердечно-сосудистой системы. В наших ранее проведенных исследованиях гиперурикемия ассоциировалась с развитием анемии и замедлением СКФ [46].
Необходимость выявления структурных изменений миокарда у лиц с ХБП обусловлена ее связью с высоким риском развития ССО, частота которой у популяции пациентов с дисфункцией почек высокая [1, 4, 47]. Есть основание полагать, что связь МКСК с сердечно-сосудистой заболеваемостью и смертностью значительно выраженнее у пациентов ХБП [48, 4]. Кроме того, рядом исследований было показано взаимоусиливающая, прогностическая роль повышения МКСК и массы миокарда ЛЖ в популяции лиц, страдающих артериальной гипертензией [49]. Важно подчеркнуть, что в данном исследовании средние значения МКСК у лиц мужского пола не превышали верхних границ нормы. Тем не менее авторам удалось продемонстрировать достоверную корреляционную взаимосвязь между уровнем МКСК и величиной ИММЛЖ в группе мужчин и женщин. Однако указанная взаимосвязь в исследуемой нами группе не была обнаружена. На наш взгляд, это связано с небольшим числом пациентов, вошедших в исследование. В нашем исследовании продемонстрировано увеличение концентрации МКСК у пациентов мужского пола и это сопровождалось возникновением структурных изменений ЛЖ, в то время как у женщин регистрируется замедление скорости клубочковой фильтрации с достоверным снижением содержания гемоглобина, эритроцитов и тромбоцитов. Поэтому на ранних стадиях ХГН в процессе диспансерного наблюдения необходима своевременная коррекция гиперурикемии с целью торможения структурных изменений ЛЖ у лиц мужского пола и предупреждения прогрессирования почечной дисфункции среди женщин.

