Современный этап изучения развития недостаточности кровообращения дополнен новыми звеньями патогенеза. Нейрогормональные нарушения, лежащие с точки зрения современной науки в основе развития недостаточности кровообращения, в первую очередь повышение активности ренин-ангиотензин-альдостероновой системы (РААС) и аргинин-вазопрессина приводят к тому, что в почках перестает поддерживаться баланс между натрий (Na)-экскрецией и Na-ретенцией [1, 2]. Это в свою очередь приводит к превалированию процессов аккумуляции натрия в организме, росту объема жидкости в интерстиции, внутрисосудистого объема жидкости, развитию отеков и повышению давления заполнения левого желудочка (ЛЖ). Подтверждением этому теоретическому предположению служит хорошо известные факты: увеличение веса пациентов в момент госпитализации по причине декомпенсации кровообращения (у 50% пациентов >2 кг/нед. по данным регистра ОРАКУЛ-РФ) и рост давления заполнения ЛЖ, проявляющегося одышкой в покое [3].
Современные исследования процессов потребления натрия его экскреции и ретенции выявили не известные ранее факты. Так, очень важно, что избыток натрия был обнаружен у людей как с отеками, так и без них. Более того, избыток общего натрия в организме, периодическое повышение его уровня отмечены даже у практически здоровых людей, находящихся на постоянном уровне потребления соли [4]. Длительное наблюдение за группой абсолютно здоровых людей (исследовались космонавты, имитирующие полет на Марс) показало, что колебание уровня натрия в организме не приводит к увеличению общего объема жидкости в организме. То есть идея обязательности формирования гидростатических отеков при превалировании процессов ретенции натрия над процессами его экскреции, по-видимому, не всегда справедлива [5].
В исследованиях последних лет установлено, что значительная часть общего натрия в организме содержится в связанном состоянии (потеря осмолярного влияния) в гликозаминогликанах (ГАГ) в мышечной ткани, коже, а также в гликокаликсе. На основе полученных данных сформировался новый взгляд на эту проблему. По-видимому, следует рассматривать ГАГ и гликокаликс как буферные емкости для накопления катионов натрия, что поддерживает гомеостаз воды в организме и предотвращает повреждение эндотелия [6–8]. Можно предполагать определенный параллелизм между потреблением натрия и уровнем ГАГ в интерстициальной ткани, необходимый для его аккумулирования. Изменение соотношения структурных компонентов тканей приведет к изменению их свойств, в т.ч. физических, например жесткости миокарда, его эластических свойств, жесткости артериальной стенки, толерантности поперечно полосатой мышцы к нагрузке. Исследования в этом направлении могут открыть новые пути и механизмы лечения сердечно-сосудистых заболеваний и позволят выйти на уровень адресной коррекции структурных изменений в органах-мишенях.
В современном мире минимальное потребление соли зафиксировано у коренных жителей Новой Гвинеи и составляет 0,5 г/сут, при этом уровень артериального давления (АД), превышающий нормальные значения, практически не регистрировался, в то время как в популяции Западной Европы с уровнем потребления соли больше 12 г/сут уровень АГ имели ≥40% населения. При этом следует признать, что попытки снизить потребление соли в популяции не увенчались успехом [9]. Странность ситуации во многом объясняется экспериментом, выполненным D. Denton в 1995 г. [10]. Группа шимпанзе, ежедневно потреблявшая количество NaCl, адекватное содержанию в пище растительного происхождения, добываемой в условиях свободной жизни в лесах Африки, была переведена на принудительное потребление галет, содержащих заведомо большее количество соли, соответствовавшее 12 г соли в сутки. Новая еда понравилась испытуемым животным, ей стали отдавать предпочтение перед естественной вегетарианской диетой. Переход на новую еду осуществился за 2–3 дня и сопровождался улучшением настроения и повышенной активностью. Попытка добровольного перехода на прежнее питание не имела успеха, а насильственный переход сопровождался резким угнетением настроения. Автор сделал вывод – аппетит и настроение зависят от присутствия NaCl в пище. Снижение уровня потребления натрия сопровождается ухудшением настроения. Происходит быстрое формирование зависимости и развивается приверженность к высоким дозам NaCl. Пристрастие, приверженность в выборе пищи, богатой NaCl, называется «натриевый (солевой) аппетит». Это явление впервые было описано на экспериментальных животных, подвергшихся в условиях лаборатории значительному снижению общего натрия организма. В этих условиях экспериментальные крысы и собаки выбирали для питья из нескольких предложенных растворов: с максимальной концентрацией соли, и поглощали NaCl в существенно большем количестве, чем это требовалось для восполнения дефицита катионов натрия. Эта приверженность сохранялась и в последующем, что приводило к изменениям в привычках, т.е. формированию нового поведенческого стереотипа.
В реальной клинической практике дефицит катионов натрия, приводящий к развитию натриевого аппетита, возникает достаточно часто, например при форсированном диурезе, перитонеальном диализе, инъекциях полиэтиленгликоля [11]. Ведущим механизмом, переориентирующим поведенческий стереотип на увеличение потребления натрия, считается гиперактивация РААС.
Таким образом, можно считать, что в современном обществе несколько независимые причины могут приводить к развитию натриевого (солевого) аппетита:
- ухудшение настроения, связанное со снижением потребления соли, что сформирует индивидуальную приверженность к стабильно высокому потреблению соли и нежелание впоследствии отказаться от этой привычки;
- естественный для современного общества высокий уровень потребления промышленно приготовленных продуктов, где в качестве консерванта используется соль, что также сформирует индивидуальную приверженность к стабильно высокому потреблению соли;
- повторяющиеся эпизоды снижения уровня общего натрия организма, носящие явно ятрогенный характер.
Так или иначе, но проявление «натриевого аппетита» присуще значительной части современной популяции.
В эпидемиологическом исследовании INTERSALT [9] анализировалась связь потребления натрия, выделения с мочой натрия и уровня АД. В исследование были включены популяции 52 стран, в т.ч. индейцы Yanomamo и Xindu (Бразилия), жители сельских районов Кении и Папуа-Новая Гвинея, а также популяции западного мира. Всего был включен 1731 пациент с артериальной гипертензией (АГ) и 8343 без АГ. Самое низкое потребление соли 1–3 г/день отмечено у индейцев и жителей сельских районов Кении, уровень их АД составил 103 (vs 120 мм рт.ст. у жителей западного мира, где потребление соли составляло 9 г/сут). Интересно сравнить эту дозу с дозой, примерно рассчитанной в средневековой Европе. Современная доза потребления соли оказалась на 10–12 г/сут меньше. Можно только предполагать, сколько больных АГ было бы в средневековой Европе даже при незначимом увеличении их продолжительности жизни.
В современном экспертном сообществе нет единого мнения о безопасной (рекомендуемой) суточной дозе NaCl. Так, FDA рекомендует дозу 6 г/сут, A. Apple (2010), основываясь на результатах исследования DASH (Dietary Approaches to Stop Hypertension) [12], – дозу 1500 мг/сут натрия (65 ммоль/сут натрия, что эквивалентно 3,8 г/сут NaCl). В исследовании DASH было установлено, что приверженность к такому уровню потребления натрия уже через 30 дней приводит к стойкому снижению уровня АД на 7 мм рт.ст. независимо от исходного уровня АД, в т.ч. и у лиц с оптимальным и высоконормальным исходными уровнями АД. Расчеты показали, что снижение потребления натрия на 100 ммоль/день приводит к снижению систолического давления на 9 мм рт.ст. в возрастной группе 25–55 лет. Важнейшим результатом этого исследования стала обнаруженная прямая достоверная связь между объемом мочи за сутки и количеством выделенного натрия. Эта связь была прослежена как у гипертоников, так и у людей с нормальным уровнем АД. Снижение на 100 ммоль/день натрия в моче приводило к снижению объема мочи на 379 и 399 мл (у гипертоников и нормотоников). Таким образом, доза потребляемой соли всегда коррелирует с объемом мочи, т.е. с объемом выпитой жидкости.
Типичная современная диета содержит 12 г NaCl, что соответствует 200 ммоль/л натрия = (4,5 г), эта доза полностью всасывается в желудочно-кишечном тракте (ЖКТ). Концентрация натрия в плазме и осмолярность плазмы начинают увеличиваться через 30–60 минут после приема per os NaCl [13]. Повышение осмолярности плазмы даже на несколько мОсм/л приводит к раздражению осморецепторов в гипоталамусе и началу ретенции воды. Выраженность процесса реабсорбции воды регламентируется продукцией аргинин-вазопрессина.
В свою очередь барорецепторы в дуге аорты, каротидном синусе, в легочных артериолах и афферентных артериолах почечных клубочков реагируют на повышение объема общей воды, что приводит к повышению экскреции натрия.
Натрий фильтруется в клубочках почек из плазмы. В канальцах реабсорбируется 99% натрия, и только ничтожная часть натрия покидает организм с мочой. Потерями с потом и калом можно пренебрегать. Важно помнить, что даже малые (ничтожные) увеличения выделения или ретенции натрия приводят к значимым изменениям общего объема воды.
В небольших исследованиях, выполненных еще в 1980–1990-х гг. на пациентах с АГ и нормотониках, определялось влияние солевой нагрузки на уровень натрия в плазме крови [14]. Известно, что даже значимое увеличение солевой нагрузки в 20–40 раз не приводит к значимым колебаниям уровня натрия в сыворотке крови, колебания, не превосходящие 1,5–3,5 ммоль/л, свидетельствует об эффективности системы контроля уровня натрия в крови.
Систему контроля уровня общего натрия в организме (total body sodium control) описал A.C. Guyton в 1972 г. [13], основываясь на результатах, полученных в серии экспериментальных работ, начатых еще в 1959 г.
Автор поставил под сомнение абсолютность положений двух теорий, главенствующих в тот период в объяснении повышенного уровня АД:
- кардиоцентрической (основанной на повышении сердечного выброса);
- вазоцентрической (основанной на повышении уровня общего периферического сосудистого сопротивления [ОПСС]).
Анализируя связь сердечного выброса (СВ) и венозного возврата, A.C. Guyton в 1959–1972 гг. пришел к выводу, согласно которому СВ – всегда устойчивое состояние (steady-state), определяемое объемом экстрацеллюлярной жидкости [15]. По сути, впервые в патофизиологию контроля АД был введен новый параметр: потребление NaCl и Н2О и их выведение через почки. A.C. Guyton предположил, что существует 2 типа механизмов, контролирующих уровень АД: краткосрочные (немедленные) и долгосрочные. Долгосрочные активизируются в интервале 48–96 часов и сохраняют свою активность неопределенно долго. Дисбаланс между потреблением соли и ее выведением приводит к изменению заполнения сосудистой системы (объема жидкости), что и изменяет уровень АД, т.е. в масштабе реального времени уровень давления определяется способностью почек выводить натрий – эта зависимость была названа «кривая давление–натрийурез». A.C. Guyton определил, что в отдаленной перспективе уровень АД определяется установившимся соотношением между величиной вводимого натрия и величиной выводимого натрия, зависящего от функционального состояния почек. Это соотношение непрерывно меняется, стремясь к равновесию. Именно этот баланс и определяет величину истинного АД, т.е. уровень АД определяется таковым контроля объема внеклеточной жидкости – renal body fluid feedback.
Описанная выше система, по сути, является системой контроля общего натрия в организме (total body sodium control). Впервые эта система была описана A.C. Guyton на языке FORTRAN на компьютере PDP-9 в 1970 г. В последующем эта модель была переложена на современные компьютерные программы и дважды подвергалась апгрейду. Ниже представлены фундаментальные принципы системы, разработанной A.C. Guyton [13]:
Когда потребление NaCl превалирует над экскрецией, происходит незамедлительное (online) увеличение объема внеклеточной жидкости, происходит увеличение объема циркулирующей крови, что в свою очередь повышает среднее давление заполнения сосудистого русла, отражающее взаимоотношение объема крови к сосудистой емкости, в дальнейшем происходит смещение равновесной кривой вверх и вправо, что означает возрастание венозного возврата и рост давления в правых отделах сердца, в ответ на это происходит рост СВ и, соответственно, рост АД: чем выше АД, тем выше почечный кровоток и тем больше возрастает экскреция NaCl. Наступает равновесие между потребленным количеством соли и экскретированным количеством соли.
Таким образом, главным фактором в немедленной реакции почек на увеличение потребления соли становится увеличение скорости клубочковой фильтрации. Современный уровень знаний позволяет считать, что механизмы, обеспечивающие ретенцию Na+ (ион-обменные насосы), при избыточном введении соли не успевают реабсорбировать должное количество катионов Na+ на уровне проксимальных канальцев и восходящей части петли Генле. В норме в проксимальных канальцах Na+ реабсорбируется в кровь, обмениваясь на Н+ионы. Катализатором этого процесса выступает ангиотензин II (АТII). На уровне восходящей петли Генле в кровь реабсорбируются ≈30% катионов Na+. До 7% катионов Na+ реабсорбируются в дистальных канальцах – под контролем гормона альдостерона. Оставшиеся катионы Na+ (≈2–3%) реабсорбируются в собирательной трубке, что приводит к росту концентрации (сохранению высоких уровней концентрации катионов Na+ в первичной моче). На этот неестественно высокий уровень катионов, пришедших в дистальный каналец, реагирует сенсорный участок плотного пятна (macula densa), расположенного в юкстагломерулярном аппарате (зона афферентной артерии клубочка), распознавая это состояние как избыточную потерю Na+. Ответом на раздражение macula densa служит активация локальной РААС, как следствие – повышение активности АТII и альдостерона, что приводит к усилению ретенции Na+ в проксимальном канальце (под влиянием АТII) и дистальном (под влиянием альдостерона) [16].
Парадокс ситуации заключается в том, что эволюционно локальная РААС должна была активизироваться только при истинном дефиците Na+, позволяя выживать индивидуумам при исходно низком уровне вводимого Na+. Таким образом, изначально нормальная физиологическая реакция приобрела патологическое значение.
Теорию A.C. Guyton во многом дополняют современные генетические исследования. Экспрессия гена, имеющего решающее значение для ретенции натрия, коррелирует с локализацией места жизни индивидуума, т.е. имеет значение, на каком расстоянии от экватора в направлении на север или юг живет человек. Жители влажных, жарких регионов рядом с экватором имеют нормальную экспрессию гена. Жители холодных регионов, напротив, имеют измененную экспрессию гена, кодирующего синтез белков, обеспечивающих повышенную ретенцию Nа+. Удаление от экватора увеличивает частоту генетических мутаций (по-видимому, это защитный механизм). В зонах под Сахарой, где предположительно появился человек, NaCl в естественных продуктах находится в малом количестве, а потери с потом носят выраженный характер. В условиях естественного отбора особи, развившие в таких условиях способность к повышению ретенции натрия, выживали. Этот адаптивный механизм, выработанный в ходе эволюции, потерял свое защитное значение в зонах холодного климата, куда направились основные миграционные потоки первобытного человека. На вновь заселяемых зонах, где не могло быть повышенной потливости, приобретенный и переданный потомкам механизм повышенной ретенции натрия остался по-прежнему высокоэффективным, но приобрел патологический характер, приводя к стойкому повышению уровня общего натрия организма. Этот факт не остался незамеченным, еще в китайской медицине обращали внимание на появление напряженного пульса при избытке соли в диете. Анализируя ген CYP3A5, отвечающего за ретенцию натрия, Di Rienzo [17] обнаружил его мутацию CYP3A5*3, приводящую к синтезу неактивного протеина, являющегося частью цитохрома-Р450, контролирующего в т.ч. вывод из клеток Na+, что резко снижало активность процесса экскреции натрия. Чем дальше от экватора, тем чаще встречается эта мутация. Так, в Нигерии частота встречаемости мутации составила 6% (80 от экватора), в Синегале – 31% (120 от экватора), в Уйгурском районе Китая – 95% (440 от экватора). В России, Италии и Франции частота встречаемости составила 80–90%. Связь изучаемых параметров исчезала, когда расстояние от экватора превышало 510. В этих регионах появилась связь с другим геном – AGTM235, кодирующим в т.ч. синтез ангиотензина.
Важно помнить, что здоровые почки могут выдержать нагрузку солью, примерно в 40–50 раз превосходящую нормальный уровень суточной потребности Nа+. Даже при такой нагрузке уровень АД не будет подвергнут существенным колебаниям, уровень Nа+ в плазме останется близким к нормальным значениям.
В работах G. Kimura [18] было установлено, что новый уровень равновесия при избыточной нагрузке Nа+ достигается примерно за 7 суток (96–168 часов).
Универсальна ли теория A.C. Guyton? По-видимому, нет. Современное экспертное сообщество считает, что в модели не учитывается роль первичных гипертоний: первичного поражения надпочечников, приводящего к нарушению синтеза минералкортикоидов, роль коарктации аорты. Кроме этого установлено, что значительное количество аутокринных и паракринных факторов влияет на баланс катионов Nа+. Важнейшим пунктом критики модели служит отсутствие (неучет) роли центральной нервной системы (ЦНС) в контроле уровня АД. A.C. Guyton предполагал, что ЦНС может регулировать кровоток через почки в своих ранних работах, но в окончательной версии модели эти предположения не нашли своего отражения. Примерно в тот же период, что и опубликованная теория A.C. Guyton, была выполнена работа по оценке объема внеклеточной жидкости у пациентов с АГ. Вопреки ожиданиям, далеко не у всех пациентов был обнаружен ее избыток. Ожидалось, что в соответствии с механизмом изменения объема внеклеточной жидкости в ответ на возросшую ретенцию Nа+ объем внеклеточной жидкости будет увеличен у всех больных.
В работах A.C. Simon (1979) [19] и C.Baretta-Picoli (1990) [20] приведены взаимоисключающие данные по объему внеклеточной жидкости у больных АГ. Эти данные позволяют считать, что помимо описанного A.C. Guyton механизма обратной связи существуют и другие патологические процессы, приводящие к изменению общего натрия организма и ОПСС.
На современном этапе изучения проблемы исследовано и установлено:
- увеличение активности эндогенных ингибиторов Nа+-, К+-АТФазы (marinobutagenin и белка, ассоциированного с АГ) приводит к значимому росту общего Nа+ организма;
- активация NF-kB – фактора, усиливающего синтез провоспалительных цитокинов в проксимальной части канальцев и увеличивающего общий Na+ организма;
- мутация генов, вызывающих эффект, подобный таковому при синдромах Liddle [21–23] и Bartter. На такую роль претендуют мутация в гене, кодирующем синтез киназы, регулирующей в т.ч. активность глюкокортикоидов (SGK-1) и количество Nа+ в дистальной зоне канальцев.
Несмотря на критику, модель успешно используется в современной трактовке патогенеза развития АГ. В настоящее время модель дополнена ролью натрийуретических пептидов. Важно учесть, что контроль уровня общего натрия, нормальных значений давления и объема внеклеточной жидкости, описанный A.C. Guyton, осуществим при исходно нормальном (адекватном) количестве активно функционирующих нефронов и нормальной морфологии нефронов. Избыточное потребление соли, приводящее к активности РААС, возрастные изменения фильтрационной поверхности почек, воспаление интерстициальной ткани почек вносят существенные изменения в способность почек поддерживать баланс вводимого и выводимого количества катиона Nа+ при нормальном уровне АД. Хорошо известно, что с возрастом происходит прогрессивное снижение величины фильтрационной поверхности почек. В 1989 г. David Barker в British Med. Journal [24] опубликовал данные анализа выживаемости и причин смерти у лиц, рожденных в городе Hertfordshire (Великобритания) в начале XIX в. Оказалось, что вес при рождении имел тесную обратную корреляционную связь с риском развития и смерти от ИБС. Критическим уровнем веса при рождении стал вес ≤2500 г. В последующем в крупных наблюдательных исследованиях было определено, что у здоровых лиц среднего возраста скорость клубочковой фильтрации (СКФ) коррелирует с весом при рождении. В среднем СКФ была на 7 мл/мин больше при различии исходного веса в 1 кг. Исследование популяции штата Южная Каролина показало, что риск развития терминальной почечной недостаточности (ТПН) при весе новорожденного менее 2,5 кг возрастало в 1,4 раза [95% ДИ – 1,1–1,8] [25]. Данные Норвежского почечного регистра по сравнению риска развития ТПН в зависимости от веса в момент рождения свидетельствуют, что между первой и 10 процентилями веса новорожденного происходит увеличение риска развития ТПН в 1,7 раза (95% ДИ – 1,4–2,2)[26]. Главный вывод этих наблюдений: низкий вес ребенка при рождении задолго до манифеста клинически значимой хронической болезни почек (ХБП) приводит к нарушению функции почек. Эти данные удивительно точно вписались в концепцию «программируемого развития хронических заболеваний у взрослых» (DOHaD: Development Origins of Health and Diseases) [27]. Эти наблюдения были дополнены анализом веса ребенка в первые 6 месяцев. Диета, избыточно богатая протеином, глюкозой и солью, приводила к опережающему увеличению массы тела и повышала риск развития ХБП [28]. Как связаны вес новорожденного и ухудшение функции почек? В статье «Glomeruli and blood pressure. Less of one, more the other?» B.M. Brenner [29] сформулировал теорию «the low nephron number», т.е. в основе такой связи лежит снижение фильтрационной поверхности почек (абсолютного числа нефронов), характерное для низкой массы тела новорожденного. Снижение в этой ситуации общей экскреторной способности почек бесспорно затрагивает и экскрецию катионов натрия. A.B. Neder в 1994 г. [30] в статье «Adaptation, allometry and hypertension» проанализировал соотношение веса почек и веса тела. Это соотношение непрерывно меняется: при рождении оно равно 4,5 мл объема почки/1 кг веса, при массе тела 55 кг оно снижается до 2 мл/1 кг веса тела.
Вес почек также зависит от массы тела:
W правой почки (г) = 4,456×(вес тела)0,795
W левой почки (г) = 4,214×(вес тела)0,823,
где W вес почки.
Очевидно, что с возрастом возникает несоответствие между фильтрационной и реабсорбционными возможностями почек и массой тела. Парадокс ситуации заключается в том, что увеличение массы тела всегда пропорционально объему жидкости в теле, а с учетом постоянства осмотического давления в тканях и жидкостных средах организма – и величине общего натрия организма. Таким образом, водная и солевая нагрузка на единицу веса (объема) почечной ткани начинает возрастать. По-видимому, эта нагрузка не может носить линейный характер, она характеризуется как степенная. Чем выше солевая нагрузка на единицу объема почек, тем выше должно быть АД, чтобы стремиться достичь равновесия между потреблением и выведением натрия. Говоря о единице объема почек, следует понимать под этим абсолютное количество нефронов. Известно, что в ходе человеческого нефрогенеза формирование почек завершается между 34–36 неделями гестации, причем 60% нефронов формируются в третьем триместре гестации. Самый подробный подсчет числа нефронов был произведен в серии работ, выполненных в т.ч. и в австралийском университете Monash [31]. Анализ посмертного материала в различных возрастных группах, включая детский возраст, показал, что среднее количество нефронов, приходящееся на 1 почку, составляет 900 тыс., при этом этот параметр колеблется от 210 тыс. до 2 000. Такое различие нефронов детерминировано в первую очередь генетическими предпосылками и в меньшей степени факторами окружающей среды. Самый низкий уровень числа нефронов зарегистрирован у аборигенов Австралии и афроамериканцев. Самый мощный из известных факторов, детерминирующих количество нефронов, – это вес ребенка в момент рождения. Анализ числа нефронов у детей, рожденных с нормальной массой тела, показал, что при весе ребенка от 3000 до 3500 г количество нефронов может разниться на 30%. Расчет показал, что нехватка 1 кг веса к расчетному весу ребенка приводит к недоразвитию в каждой почке 250 тыс. клубочков. В ходе исследования по подсчету количества нефронов была определена закономерность связи объема клубочка и числа функционирующих клубочков. Оказалось, что эта связь носит обратный характер: чем меньше число нефронов, тем больше объем оставшихся клубочков. Такие изменения носят компенсаторный характер. Эта закономерность легкообъяснима. Для поддержания экскреторной функции почек, в первую очередь для адекватной нагрузки выведения Nа+ должен увеличиваться размер клубочка и возрасти СКФ, т.е. должен осуществиться переход на режим гиперфильтрации. У гипертоников объем клубочка составляет 6,5×10-3 мм3 vs объем клубочка у нормотоника 2,79×10-3 мм3 (р<0,0001). Вся возрастающая избыточная нагрузка на оставшиеся нефроны приведет к ускорению процесса снижения объема функционирующей почечной ткани, т.е. приведет к прогрессированию нефросклероза. Таким образом, патологический круг замыкается: чем меньше количество функционирующих нефронов, тем больше объем оставшихся нефронов и выше СКФ (гиперфильтрация для достижения равновесия между потреблением и экскрецией Nа+), чем выше гиперфильтрация, тем быстрее развивается гибель нефронов (облитерация нефронов), чем больше нефронов погибло, тем меньше стало активно функционировать нефронов, которым для достижения равновесия между вводимым и экскретируемым Nа+ требуется больший уровень АД. Описанный патологический круг объясняет прогрессирующее снижение количества нефронов и потерю равновесия в метаболизме Nа+ в сторону снижения натрийуреза и роста уровня общего натрия организма, следовательно, – увеличения объема внеклеточной жидкости.
A.C. Guyton [13] считал, что при снижении количества активно функционирующих нефронов на 30% уровень АД должен возрастать на 30% для достижения равновесия между вводимым и экскретируемым натрием. Повышение уровня потребления NaCl должно приводить к еще большему росту уровня АД для достижения равновесия в новых условиях. Кривая «АД–натрийурез» в этих условиях соответствует смещению кривой вправо.
Описанные процессы изменения натрийуреза имеют прямое отношение абсолютно ко всем представителям современной популяции, т.к. установлено, что в течение 50 лет (с 30- по 80-летний возраст) происходит естественное снижение фильтрационной поверхности почек на 40%. Следовательно, с увеличением биологического возраста пропорционально снижается натрийурез.
Не вдаваясь в детали, приводящие к гипотрофии плода (низкопротеиновая диета, плацентарная недостаточность, избыток катехоламинов у матери в период беременности), отметим, что количество рожденных и оставшихся в живых (благодаря успехам медицины) значимо возросло, также достоверно возросла продолжительность жизни и достоверно возросло потребление соли (88×106 т NaCl на всех жителей Земли в год, что соответствует ≈13,2 г/день). Все эти факторы говорят о важности учета олигонефронии в повседневной практике как фактора, приводящего к раннему нарушению равновесия между потреблением и экскрецией натрия в сторону снижения натрийуреза и росту уровня общего натрия организма. Изменения количества нефронов идут параллельно с развитием других морфологических изменений как в самом нефроне, так и в интерстициальной ткани почек. Стойкое повышение потребления соли в первую очередь приводит к увеличению объема клубочков и выраженному процессу пролиферации мезангиального матрикса. В последующем к этому процессу присоединяется гиалиноз почечных артерий. Экспериментальные исследования позволяют считать, что через 2 месяца регулярного приема избыточного количества NaCl возникают изменения, идентифицируемые в световом микроскопе. На более поздних этапах доминирующим становится процесс коллагенизации. Депозиции коллагеновых волокон приводят к расширению интерстиция. Локализация коллагеновых волокон в клубочковой зоне потенцирует гибель клубочков. Наши собственные наблюдения [32], основанные на морфометрии коллагена в ткани почек у больных хронической сердечной недостаточностью (ХСН), умерших в период декомпенсации болезни, не снизивших потребление соли и снижавших по совету врача на протяжении последнего года, не выявили достоверного различия между ними, однако нельзя не отметить масштабность (выраженность) процесса коллагенизации почек как в одном, так и в другом случае. Отсутствие различий в морфометрической картине было объяснено исходным длительным периодом существования болезни.
Таким образом, необратимые морфологические процессы, вызванные в т.ч. избыточным потреблением соли: пролиферация мезангиального матрикса+депозиции коллагена, в т.ч. и в зоне клубочков,+гипертрофия клубочков, делают необратимыми нарушения метаболизма натрия. Равновесие процессов нарушается и необратимо смещается в сторону снижения натрийуреза и увеличения депозиции катионов Na+ в организме.
В последние годы уделяют особое внимание изучению роли кратковременного повышения напряжения сдвига в капиллярах клубочка на фоне избыточного потребления Na+. Напряжение сдвига – это сила взаимодействия (сопротивления) между слоями крови. Большое физиологическое значение приобретает напряжение сдвига между пристеночным слоем крови и эндотелиальными клетками. Пристеночный слой с самой низкой скоростью движения оказывает зависящее от скорости движения давление на эндотелиальные клетки, стимулируя синтез NO и поддерживая сосудистое сопротивление. Очевидно, что любая перегрузка солью приводит к гиперволемическому состоянию. Вне зависимости от продолжительности гиперволемии возникает изменение как объемного кровотока, так линейной скорости движения крови. Большая скорость движения пристеночного слоя, с одной стороны, приводит к снижению давления на эндотелиальные клетки и изменению синтеза NO, что влечет за собой рост сосудистого сопротивления, с другой – к механическому разрушению гликокаликса – защитного слоя из гликозаминогликанов на поверхности эндотелия [33]. Установлено, что гликокаликс выполняет роль буфера для катионов Na+, адсорбируя их и препятствуя их безпрепятственному проникновению в клетки эндотелия. Повреждение этого слоя, по сути, означает депонацию катионов Na+ в сосудистой стенке, изменение тонуса сосудистой стенки, ее повреждение и начало воспалительной реакции [34]. Наиболее уязвимы для измененного напряжения сдвига капилляры гипертрофированного клубочка, находящегося изначально в условиях гиперфильтрации [35]. Повреждение капилляров приводит к ускорению процесса запустения клубочков.
О выраженности воспалительной реакции можно судить по уровню активности цитокинов. К числу наиболее изученных цитокинов относится transforming growth factor-β1 (TGF-β1). Именно этому фактору принадлежит ключевая роль в инициации и прогрессировании гипертрофии тканей, в частности ткани почек и эндотелия сосудов. Анализ экспериментальных работ позволяет считать, что продукция на единицу объема TGF-β1 в ткани почек выше, чем в других тканях, например в миокарде. Анализ приведенных данных позволяет прийти к выводу, согласно которому повышение потребления соли включает еще один патологический механизм – изменения напряжения сдвига пристеночного слоя крови, что запускает системное воспаление. Чем выше уровень TGF-β1 в ткани почек, тем выше уровень фибробластов в ткани и тем выше уровень депозиции коллагена [36].
Наша исследовательская группа [36– 38], анализируя влияние исходного уровня потребления соли на морфологическую перестройку восходящего участка петли Генле, где реабсорбируется в норме до 30% катионов Na+, установила ряд не известных ранее фактов:
- Избыточное количество катионов Na+, пришедших из-за невозможности реабсорбировать 60% Na+ в проксимальном участке канальца, в зону восходящего участка петли Генле (что характерно для всех случаев исходно избыточного потребления NaCl), приводит к перенапряжению механизмов реабсорбции, индуцируя воспаление в этой зоне.
- Нам впервые удалось доказать рост уровня белка Тамма–Хорсфалла, превышающего уровень 25 мг/сут, и иммуногистохимически доказать значимое увеличение цитокина TGF-β1 в клетках восходящей части петли Генле.
Выявленные факты означают, что поврежденные в ходе воспаления клетки еще больше снизят реабсорбцию Na+, а в дистальные участки придет существенно большее количество катионов Na+, что, бесспорно, будет способствовать смещению равновесия потребления/выведения натрия в сторону снижения натрийуреза и роста уровня общего натрия организма. Эти данные представляют особый интерес, т.к. хорошо известно, что высокие дозы диуретиков, повышающие уровень выводимого натрия, не приводят к снижению синтеза и содержания в тканях TGF-β1, т.е. не снижают выраженность воспаления. Очевидно, что пока не произойдет снижения уровня вводимого натрия извне и радикального снижения количества натрия в проксимальных канальцах, следовательно, – в последующих структурах нефрона, нельзя изменить (снизить) выраженность структурных изменений.
Описанное выше требует от специалиста понимания того, что избыток вводимого натрия порождает не только гемодинамические изменения, но и гемодинамически независимые процессы, со временем порождающие необратимые структурные изменения в тканях органов мишеней. По сути, на современном этапе понимания и изучения этой проблемы произошло расширение понимания роли метаболизма натрия и прогностической роли натрийуреза от роли первопричины в развитии объем-зависимой АГ к пониманию причинно-следственных связей в структурных нарушениях тканей органов-мишеней.
С момента введения в повседневную практику термина «соль-чувствительность» изучение метаболизма натрия, в частности динамика натрийуреза, приобрело особое значение. По-видимому, первым, кто обратил внимание на влияние снижения уровня потребляемой соли на уровень АД, был W. Kempner [39], который стал применять рисовые отвары и рис (низкий уровень NaCl) в лечении АД. Эффект такого лечения он описал в 1939 г., отметив, что эта терапия, в целом оказывая положительный эффект – снижая уровень АД, не позволяла достигать успеха в 100% случаев. Существенно позже сформировалось представление о соль-чувствительности, т.е. способности изменять уровень АД в зависимости от уровня Na+. Принято два критерия, характеризующих это состояние:
- изменение среднего АД на уровень ≥10% от исходного при изменении потребления поваренной соли или применения диуретиков;
- отсутствие сниженного АД на 10–20% в ночные часы от исходного (известно, что повышенный уровень АД в ночные часы необходим для экскреции избыточно накопленного натрия, что соответствует механизму, описанному A.C. Guyton, «АД–натрийурез»).
Легко представить, что чем дольше сохранен и выраженнее ночной подъем АД, тем больше смещено равновесие потребление/выведение натрия в сторону снижения экскреции натрия.
Позже Myron Weinberger в статье «Salt sensitivity of blood pressure in humans» [40] определил, что с возрастом число пациентов, попадающих под определение «соль-чувствительный», возрастает. У пациентов с АГ в возрасте ≤30 лет соль-чувствительность определяется в 51% случаев, в возрастной группе ˃50 лет – в 85%. Аналогичная закономерность прослеживается и у нормотензивных здоровых людей. Соль-чувствительные составляют 26% этой популяции. В пересчете на популяцию пациентов с АГ в РФ это соответствует примерно 22–25×106 людей, что говорит о масштабе проблемы, особенно с учетом того, что смертность среди соль-чувствительных людей достоверно выше, чем среди соль-нечувствительных [41].
Однако связь потребления соли с сердечно-сосудистой смертностью и общей смертностью оказалась сложной и не до конца изученной. Так, на основе обсервационного исследования, выполненного в рамках National Health and Nutrition Examination Survey (NHANES) [42], было обнаружено
M.H. Alderman [43], что потребление соли имеет обратную (!) связь с общей и кардиоваскулярной смертностью, но прямую и выраженную с параметром, оцениваемым как соотношение суточное потребление соли (г)/суточное потребление (ккал). На основании этих наблюдений совет экспертов пришел к выводу о невозможности формирования персональных рекомендаций по потреблению соли. Повторный анализ этих данных, выполненный J. He [44], показал, что при исключении из базы данных пациентов: (1) стойко соблюдающих низкосолевую диету и (2) с манифестировавшей ИБС, прямая связь потребления соли, а также риск развития инсульта и сердечно-сосудистой смерти становятся очевидными в популяции людей, имеющих избыточный вес. Причем потребление соли достоверно повышает риск развития ХСН [44]. Такая связь потребления соли и смертность среди лиц с избыточной массой тела были объяснены в работах F. Hammer (2006) [45] и T. Uzu (1997) [46]. Авторы этих работ считают, что в условиях избыточного потребления соли происходит нарушение суточного цикла метаболизма кортизола. Уровень активности этого гормона во многом детерминирует колебания уровня АД, в частности снижение уровня АД на 10–20% в ночные часы. Именно в этой группе пациентов связь потребления соли и сердечно-сосудистых исходов становится абсолютно очевидной.
Обзор этих исследований показывает следующее:
- чем выше потребление соли, тем выше риск развития АГ;
- отсутствие ожидаемых результатов по связи сердечно-сосудистой смертности с потреблением соли скорее всего объясняется различием исходного состояния почек у обследуемых, т.е. от потенциальной функциональной способности почек восстанавливать равновесие между потребляемой солью и натрийурезом.
Убедительным доказательством этого предположения служит афоризм L.K. Dahl (1972) [47, 48] «гипертензия путешествует за донорской почкой». Трансплантируя почки крыс с АГ крысам с нормальным уровнем АД, автор доказал развитие АГ у изначально здоровых крыс. Как это возможно? Современный уровень знаний позволяет считать, что у пациентов с манифестом АГ помимо избыточного эндогенного поступления катионов натрия комплекс следующих изменений приводит к развитию самоподдерживающегося патологического круга, приводящего к росту общего натрия в организме:
- морфологические изменения в структуре клубочка, приводящие к снижению скорости клубочковой фильтрации;
- морфологические изменения в интерстициальной ткани, приводящие к росту уровня ретенции натрия в канальцах.
Увеличение потребления соли приводит к активации локальной РААС, что реализуется в возрастающей степени спазма афферентной и эфферентной артерии клубочка и исключает увеличение объема крови, проходящего через клубочек.
В результате меньшее количество отфильтрованного натрия попадает в проксимальные и последующие зоны канальца, приводя к постоянно растущей ретенции натрия.
Таким образом, изменения приобретают необратимый характер. Маркером такого состояния является рост уровня альбумина и белка ТНР в моче. Наши собственные данные анализа динамики суточного натрийуреза показывают, что СКФ и величина дневного диуреза в период с 7:00 до 23:00 имеют слабовыраженную прямую корреляцию [36]. Сравнение ночного диуреза 23:00–7:00 имело выраженную обратную корреляцию. Величина ночного натрийуреза имела тесную связь с величиной индекса аугментации (ИА).
Особый интерес представляло сопоставить величину натрийуреза с интервалом каждые 2–3 часа и динамику уровня систолического АД. Снижение уровня систолического АД всегда совпадало с увеличением уровня экскреции натрия, оцениваемого по уровню кондуктивности мочи. Главный вывод из этого наблюдения: контролируемый натрийурез должен осуществляться плавно и максимально долго, желательно – круглосуточно. Нарушение этого принципа приводит к росту объема внеклеточной жидкости и гидродинамическому воздействию на канальцы клубочка, усугубляя их повреждение, даже при кратковременном повышении объема внеклеточной жидкости.
Итак, избыточное потребление соли, характерное для современного общества, приводит к тому, что эволюционно закрепленный защитный механизм по задержке натрия в организме приводит к патологическому накоплению натрия в организме (увеличение общего натрия). Этот процесс предопределяет не только изменение объема внеклеточной жидкости и уровня АД, в первую очередь ночного, но и старт процессов, приводящих к изменению структур органов-мишеней. Натрийурез динамически меняется в различное время суток, что позволяет ставить на повестку дня вопрос о круглосуточном контроле натрийуреза как нового направления в лечении сердечно-сосудистых заболеваний.
Примерно 65% от общего натрия в организме содержится во внеклеточной жидкости (плазма и интерстиций). От 5 до 10% – во внутриклеточном пространстве, около 25% – в форме апатитов в костях. Эти соединения не подлежат изменениям в отличие от натрия во внутри- и внеклеточных пространствах [13]. В последние 10 лет было обнаружено, что значительное количество катионов натрия содержится в отрицательно заряженных биополимерах – ГАГ [4]. Гликозаминогликаны – это составная часть гликопротеидов. Гликопротеиды – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов варьируется от 1 до 85% по массе. Различают два класса гликопротеидов:
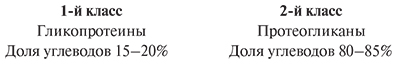
Многократно дублируясь, дисахарид образует олиго- или полисахаридные цепи – гликаны. Гликозаминогликаны содержат аминогруппы с избытком в них анионных групп – сульфатных и карбоксильных, что придает ГАГ высокий отрицательный заряд. Отрицательный заряд позволяет фиксировать на поверхности положительно заряженные частицы, в т.ч. и электролиты (натрий), коллагеновые волокна, белки. Такой конгломерат создает повышение онкотического давления. Важно, что из-за превалирования натрия в экстрацеллюлярном пространстве связь с заряженными частицами в основном происходит с натрием, что создает локальную зону повышенной концентрации натрия.
Натрий в интерстиции
Основное вещество в интерстиции – это ГАГ. Совместно с коллагеном и эластическими волокнами они и создают структуру интерстиция. ГАГ могут аккумулировать массу катионов натрия.
Крупнейшие исследования последних лет доказали, что значительные количества натрия могут аккумулироваться в интерстиции, не вызывая колебаний концентрации натрия в плазме и компенсаторного увеличения ретенции Н2О, т.е. при постоянстве концентрации натрия в крови общий уровень натрия может существенно меняться. ГАГ «смягчают» колебания концентрации натрия в плазме, «скрывают» от осморецепторов натрий, что предотвращает обязательный в такой ситуации процесс повышения секреции вазопрессина и рост ретенции воды. С другой стороны, депонированные натриевые катионы не достигают нефрона, что делает их трудновыводимыми из организма.
Уровень ГАГ во многом зависит от потребления соли и подстраивается под этот уровень.
Повышенный уровень натрия:
- меняет количество свободных сульфатных групп (связывая их) и повышает суммарный заряд ГАГ;
- экспрессирует ген, кодирующий синтез ГАГ полимеразы – энзима, повышающего содержание ГАГ, что в итоге повышает емкость для депонирования натрия.
При снижении уровня натрия, поступающего извне, полимеризация ГАГ снижается, уменьшение ГАГ сопровождается массивным высвобождением натрия из резерва. При длительной перегрузке натрием ГАГ происходит повреждение макромолекул, нарушаются буферные свойства ГАГ. В частности, у соль-чувствительных пациентов это приводит к резкому росту уровня АД, у пациентов с ХСН – к гиперактивации РААС.
ГАГ формируют тканевое осмолярное давление. Рост его уровня должен приводить к увеличению объема жидкости, выходящего за просвет капилляров [49]. Однако ограниченные эластические свойства ГАГ и их низкая податливость препятствуют аккумуляции жидкости. Тем не менее небольшое количество жидкости попадает в интерстиций, что приводит к значимому напряжению интерстиция. Величина возникшего напряжения регулируется возрастающим уровнем «сброса» жидкости в лимфатические сосуды и в системный кровоток. Этот процесс поддерживает гидростатическое давление на нормальном уровне только на стадии компенсации. Кроме этого известно, что макрофаги, реагируя на повышенный уровень натрия, синтезируют белок TonEBP. Этот белок – транскрипторный фактор, приводящий к повышенной экспрессии генов, ответственных за синтез эндотелиального фактора роста – белка, стимулирующего рост лимфатических сосудов и усиление синтеза NO-синтазы. В ряде работ отмечено повышение количества лимфатических сосудов в коже и мышцах в ответ на гиперупотребление поваренной соли.
Развитие отека интерстиция зависит от состава и состояния матрикса ткани. Повреждение ГАГ, например, при перегрузке катионами натрия приводит к превалированию процессов транссудации жидкости из капилляров над скоростью эвакуации жидкости из тканей, то есть развитию отека ткани.
Натрий и эндотелиальная функция
Эндотелиальный гликокаликс (EGC) – тонкий слой, состоящий в т.ч. из растворимых протеогликанов, соединен с эндотелием молекулами адгезии. Толщину и состав EGC во многом определяет величина напряжения сдвига между слоем крови и эндотелием. Растворенные в плазме молекулы (альбумин, протеин, ионы) взаимодействуют с EGC. Гликокаликс экранирует, защищает эндотелиальные клетки, снижает проницаемость сосудистой стенки, препятствует взаимодействию лейкоцитов и тромбоцитов c молекулами адгезии. Важно, что ЕGC связывает натрий, контролируя проникновение натрия из плазмы в эндотелиальные клетки. Натрий попадает в эндотелиальные клетки через апикальный эндотелиальный натриевый канал. Далее Nа+-, К+-АТФаза переправит натрий в интерстиций. Движение натрия осуществляется по электромеханическому градиенту [33, 34].
Главное, что EGC – это механотрансдусер, переправляющий сигналы напряжения сдвига в клетки эндотелия, стимулируя выработку NO.
Концентрация натрия в эндотелии и синтез NO
При повышении концентрации натрия в плазме резко возрастает активность и количество натриевых каналов на эндотелиальных клетках. Высокая концентрация альдостерона резко ускоряет формирование таких каналов. Таким образом, суммация влияния высокосолевой диеты и повышенной концентрации альдостерона приводит к повышению содержания натрия в эндотелиальных клетках. Чем больше катионов натрия в эндотелии, тем выше жесткость сосудистой стенки и меньше уровень синтезируемого NO. Исследованиями в атомном микроскопе установлено, что через несколько минут после повышения концентрации натрия в эндотелиальных клетках происходит повышение жесткости сосудистой стенки. Один из механизмов, обеспечивающий этот процесс, – это взаимодействие натриевых каналов с цитоскелетным протеином – актином.
Повышение натрия в эндотелиальных клетках:
- понижает синтез NO;
- повышает активность ингибитора NO-синтазы (асимметричный диметил L-аргинин).
Суммация этих процессов приводит к ухудшению эндотелиальной функции.
Таким образом, повреждение гликокаликса приводит к повышению уровня катионов натрия в эндотелиальных клетках, повышению тонуса сосудистой стенки, снижению уровня синтеза NO и повышению проницаемости сосудистой стенки для молекул H2O по направлению из полости сосуда в ткань. Установленные факты позволяют предположить, что ГАГ – новое звено в понимании патогенеза развития и, возможно, лечения сердечно-сосудистых заболеваний. Наличие изменений в ГАГ и гликокаликсе (уровень структурного повреждения) должно рассматриваться как первое звено в патологическом процессе, предшествующее клиническому манифесту патологии.
Итак, уровень катионов натрия в интерстиции – новый фактор риска и прогноза развития сердечно-сосудистых заболеваний. Известно, что применение магнитно-резонансной томографии позволяет определять уровень катионов натрия в тканях, а определение уровня Syndecan или сульфата гепарина – продукта-деградации гликокаликса позволит судить о состоянии слоя гликокаликса. Гликокаликс может быть визуализирован при исследовании микропрепаратов и в световом микроскопе.
Попытки медикаментозного влияния на гликокаликс с целью сохранения этого барьерного слоя крайне малочисленны. Известны исследования по применению гидрокортизона больных острым инфарктом миокарда (ОИМ). Результаты исследования противоречивы и не позволяют прийти к какому-то заключению. Применение Sulodexide (смесь компонентов ГАГ, принимаемая per os и в/в и использовалась как антикоагулянт) также не привело к получению клинически значимых результатов. По-видимому, только снижение уровня натрия, вводимого с нутриентами, может рассматриваться сегодня как действенное, клинически значимое воздействие. Перспективно изучение роли натрийуретического пептида. Возможно, что увеличение его уровня в крови благодаря блокаде нейтральной эндопептидазы (НЭП) – неприлизина – препаратом AHU377 (сакубитрилом) приведет к протективному влиянию на гликокаликс.
Открытия в области метаболизма натрия в организме человека относятся к числу значимых событий в изучении нормальной физиологии. Так, вопреки устоявшемуся мнению «задержка натрия всегда сопровождается адекватной ретенцией жидкости» было установлено, что уровень общего натрия в организме может возрастать, но не приводить к развитию отеков. Более того, у практически здоровых людей, имеющих постоянный уровень потребления соли, периодически происходит повышение уровня общего натрия, депонированного в организме, не приводящее к увеличению общего объема жидкости организма. Таким образом, можно предполагать, что депонирование катионов натрия возможно без изменения осмотического давления плазмы крови. Современные исследования показали, что значительная часть натрия находится не в клеточном пространстве и сосудистом русле, а в связанном состоянии в отрицательно заряженных ГАГ, находящихся в интерстициальной ткани. По сути, ГАГ – это натриевый буфер, поддерживающий в первую очередь постоянство объема воды в организме и позволяющий избегать перегрузки объемом при избыточном введении натрия. C учетом повсеместности присутствия ГАГ в организме, по-видимому, можно начать обсуждать роль и прогностическое влияние количественного и качественного состояния ГАГ в органах-мишенях. Это позволит перейти от глобального-органного уровня оценки проблемы к более тонкому – тканевому, т.е. выйти на уровень структурного анализа. Очевидно, что изменение электростатического заряда ГАГ под воздействием присоединения катионов натрия к свободным анионным сульфатным и карбоксильным группам ГАГ при его депонировании должно опосредованно приводить к изменению физических свойств ткани, в первую очередь ее жесткости.
Типичная диета жителя крупного города содержит примерно 12 г NaCl, что соответствует примерно 4,5 г Na+ (200 ммоль Na+). Эта и большие дозы соли полностью всасываются в кишечнике и изменяют осмолярность плазмы уже через 30 минут [50]. Последующая последовательная активизация осморецепторов в гипоталамусе и барорецепторов в дуге аорты, каротидном синусе, афферентных артериях клубочков почек приводят к контролируемому повышению экскреции натрия в клубочках и 99% его реабсорбции в канальцах. Механизм практически 100%-ной реабсорбции натрия эволюционно закреплен, что позволяло ошибочно считать уровень общего натрия в организме постоянным.
Известно, что примерно 65% от общего натрия содержится во внеклеточной жидкости, до 10% – во внутриклеточном пространстве, 25% – в форме апатитов в костях [16]. За последние 10 лет было обнаружено, что значительное количество катионов натрия содержится в ГАГ. ГАГ – основное вещество в интерстиции, образуют класс протеогликанов (один из классов гликопротеидов), имеющих высокий уровень содержания углеводов, достигающий 85% [51]. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. ГАГ содержат в большом количестве свободные анионные группы: SO3– и ОН– , что придает ГАГ высокий суммарный отрицательный заряд. Отрицательный заряд позволяет ГАГ фиксировать на своей поверхности положительно заряженные коллагеновые волокна, белки и электролиты, в первую очередь из-за высокого содержания в экстрацеллюлярной жидкости, – катион Na+. Такой белково-электролитный конгломерат создает локальную зону высокого онкотического и осмотического давления.
Исследования доказали, что значительное количество натрия может аккумулироваться в ГАГ (в интерстиции), не вызывая колебаний уровня натрия в плазме и не увеличивая компесаторно ретенцию воды из первичной мочи [4, 51]. Иными словами, при постоянной концентрации натрия в плазме крови уровень общего натрия в организме может существенно возрастать. ГАГ, связывая натрий, сглаживают колебания уровня натрия в плазме крови и не позволяют катионам натрия стимулировать осморецепторы гипоталямуса, тем самым предотвращая синтез и высвобождение вазопрессина и, следовательно, ретенцию воды из первичной мочи.
Количество ГАГ во многом определяется уровнем потребления натрия. Чем выше уровень вводимого извне натрия, тем:
- меньше остается свободных анионных групп и, следовательно, выше электростатический заряд ГАГ;
- больше экспрессия гена, кодирующего синтез ГАГ-полимеразы, повышающей содержание ГАГ, что в итоге повышает емкость ГАГ-сети для аккумулирования катионов натрия.
Чем выше заряд ГАГ, чем больше количества ГАГ в интерстиции, тем выше внутритканевое давление и тем выше количество жидкости, выходящей за просвет капилляров. Однако изменившие свой заряд ГАГ существенно снизили свою эластичность и податливость и тем самым препятствуют скоплению жидкости в тканях. Тем не менее некоторое количество жидкости попадает в интерстициальную ткань и еще больше повышает напряжение (жесткость) ткани, которое частично снижается за счет усиления лимфотического дренажа тканей. Помимо изменения гидрофильности тканей избыток депонированных катионов натрия запускает локальное воспаление, а активированные макрофаги начинают синтез белка Ton EBP [52], экспрессирующий ген, кодирующий синтез эндотелиального фактора роста, стимулирующего рост в т.ч. и лимфатических сосудов.
При длительном существовании перегрузки уровнем вводимого извне натрия происходит повреждение макромолекул ГАГ, нарушаются их буферные свойства, в частности, соль-чувствительных пациентов это приводит к росту уровня АД. Таким образом, избыточное и долговременное введение извне катионов натрия приводит к изменению структуры ГАГ, появлению большего количества активно функционирующих лимфатических сосудов, большей гидрофильности тканей, локальному воспалению – эти процессы должны изменить механические характеристики тканей. В настоящее время не изучена роль уровня натрия в миокарде в формировании нарушений его механических свойств. По-видимому, первым обратившим внимание на связь уровня натрия с повреждением миокарда в условиях стресса был Ганс Селье (1961 г.) [53]. Им были описаны повреждение, отек и диффузные некрозы миокарда при избыточном введение NaCl. Современные исследования дополнили эти наблюдения принципиально новыми понятиями: повреждение миокарда начинается с накопления натрия в ГАГ, носит пролонгированный во времени характер и сопровождается изменением состояния самой мышечной ткани.
Целью нашей работы была попытка ответить на вопрос: есть ли связь между количеством натрия в миокарде и его жесткостью? Как видно из представленных выше данных, теоретические предпосылки для этой связи имеются, однако практически такая связь не изучена и не измерена [54].
Для изучения жесткости стенки миокарда нами была применена методика, ранее применимая для изучения жесткости сосудистой стенки у больных, скончавшихся от инфаркта миокарда. При изучении проведения звуковой волны тканями миокарда нами была получена связь между уровнем натрия в миокарде и проведением звуковой волны. Для определения уровня содержания натрия в миокарде применяли волнодисперсионный рентгенофлуоресцентный спектрометр BRUKER S8 TIGER 1 kW. Аутопсийные образцы, прошедшие акустическое исследование, были предварительно измельчены и подвергнуты озалению (в соответствии требованиями к проведению спектрометрии), после чего проводилась волнодисперсная рентгенофлуоресцентная спектрометрия. Статистический анализ позволил установить, что наибольшим образом на уровень натрия влияли вес миокарда (SS=3615,56, p=0,00029) и возраст умершего (SS=1965,568, p=0,0029), тогда как пол и курение оказывали влияние в существенно меньшей степени (SS=778,584, p=0,03). Также была получена взаимосвязь содержания уровня натрия в миокарде и толщины передней стенки ЛЖ (β=0,94, p=0,000001, r2= 0,88), толщины передней стенки ПЖ (β=0,82, p=0,000021, r2= 0,66), толщины МЖП (β=0,94, p=0,000001, r2=0,89).
Таким образом, уровень депонированного натрия в миокарде, имеющий прямую связь с уровнем потребления соли, имеет достоверную связь с жесткостью миокарда. Можно предполагать, что высокий уровень натрия, депонированного в миокарде, служит самостоятельным фактором, изменяющим жесткость миокарда и, по-видимому, влияющим на формирование диастолической дисфункции миокарда.

