Результаты многочисленных исследований показали существенную разницу в применяемых дозировках эритропоэз-стимулирующих средств (ЭСС) в разных странах. Однако анализ причин данного положения вещей до сих пор не был проведен. В настоящем исследовании представлен результат лечения 90 гемодиализных пациентов эритропоэтином α (Эральфон, ЗАО «Сотекс», Россия) внутривенно (в/в) в конце процедуры. В результате лечения на протяжении 6 месяцев уровень гемоглобина (Hb) оставался стабильным в пределах целевых уровней: в среднем от 104,7±12,6 (исходно) до 113,1±11,7 г/л (р>0,05). В исследовании не были зарегистрированы побочные эффекты, связанные с препаратом. Средние дозы препарата были ниже рекомендованных фирмой и составили 28,5 МЕ/кг в/в 3 раза в неделю. Дозы препарата прямо коррелировали с массой тела больного и обратно – с уровнем насыщения трансферрина железом (НТЖ). Масса тела больного в свою очередь прямо коррелировала с уровнями С-реактивного белка (СРБ) и ферритина. Полученные результаты могут объяснить такие большие отличия в дозах ЭСС в разных странах.
Анемия считается распространенным осложнением хронического заболевания почек, а коррекция анемии ЭСС связана с улучшенным исходом [1] и качеством жизни [2, 3]. ЭСС с коротким периодом полувыведения требуют частого введения (в основном 2–3 раза в неделю) для поддержания стабильных концентраций Hb. До последнего времени в стране сохраняется высокая зависимость от зарубежных ЭСС, но с 2009 г. после выхода на рынок отечественного препарата Эральфон с действующим веществом эпоэтин α эта ситуация изменилась к лучшему.
Целью нашего исследования было оценить терапевтическую эффективность данного препарата и удобство применения разных дозировок.
Материал и методы
Представлен опыт применения препарата Эральфон в двух крупных диализных центрах Москвы, «Фесфарм» и ГБУЗ ГКБ им. С.П. Боткина, 90 больными с использованием разных дозировок (2000 МЕ, 2500, 3000 МЕ).
 Исследование состояло из двух частей, разделенных по времени. Вначале было проведено ретроспективное исследование данных 60 больных, получавших Эральфон в рутинной практике на базе диализного центра «Фесфарм». Целью исследования было подтвердить гипотезу о небольших дозах данного препарата для достижения целевого уровня Hb 100–120 г/л. В последующем было проведено проспективное исследование на базе ГКБ им. С.П. Боткина (30 больных) с целью оценки эффективности применения Эральфона для лечения ренальной анемии дозами препарата, существенно меньшими рекомендованных инструкцией к препарату, и оценки факторов, влияющих на эффективность лечения. Пациенты были отобраны из двух центров Москвы в возрасте ≥18 лет, которые имели стабильную хроническую почечную анемию (с диапазоном Hb 10–12 г/дл) и были на регулярном гемодиализе. Чтобы быть включенными в исследование, пациенты должны были получать адекватный гемодиализ по индексу KT/V 3 раза в неделю в течение ≥12 недель. Пациенты должны были иметь стабильные концентрации Hb, определяемые как максимальное изменение 1 г/дл во время скрининга/включения в анализ. Они должны были проходить непрерывную терапию эпоэтинами в течение ≥8 недель до скрининга/анализа. Пациенты не были выбраны на основе дозы эпоэтинов. Пациенты также должны были обладать адекватным статусом железа, определяемым как сывороточный ферритин ≥100 мкг/л, насыщение трансферрина железом ≥20%. Пациенты были исключены из исследования, если у них было явное кровотечение, что потребовало бы переливания эритроцитов в течение 8 недель до включения в исследование, СРБ >30 мг/л; предполагаемая продолжительность жизни менее 12 месяцев.
Исследование состояло из двух частей, разделенных по времени. Вначале было проведено ретроспективное исследование данных 60 больных, получавших Эральфон в рутинной практике на базе диализного центра «Фесфарм». Целью исследования было подтвердить гипотезу о небольших дозах данного препарата для достижения целевого уровня Hb 100–120 г/л. В последующем было проведено проспективное исследование на базе ГКБ им. С.П. Боткина (30 больных) с целью оценки эффективности применения Эральфона для лечения ренальной анемии дозами препарата, существенно меньшими рекомендованных инструкцией к препарату, и оценки факторов, влияющих на эффективность лечения. Пациенты были отобраны из двух центров Москвы в возрасте ≥18 лет, которые имели стабильную хроническую почечную анемию (с диапазоном Hb 10–12 г/дл) и были на регулярном гемодиализе. Чтобы быть включенными в исследование, пациенты должны были получать адекватный гемодиализ по индексу KT/V 3 раза в неделю в течение ≥12 недель. Пациенты должны были иметь стабильные концентрации Hb, определяемые как максимальное изменение 1 г/дл во время скрининга/включения в анализ. Они должны были проходить непрерывную терапию эпоэтинами в течение ≥8 недель до скрининга/анализа. Пациенты не были выбраны на основе дозы эпоэтинов. Пациенты также должны были обладать адекватным статусом железа, определяемым как сывороточный ферритин ≥100 мкг/л, насыщение трансферрина железом ≥20%. Пациенты были исключены из исследования, если у них было явное кровотечение, что потребовало бы переливания эритроцитов в течение 8 недель до включения в исследование, СРБ >30 мг/л; предполагаемая продолжительность жизни менее 12 месяцев.
Исследование в ГКБ им. С.П. Боткина было проспективным открытым параллельным и групповым по изучению эффективности эпоэтина α (Эральфон). Пациентов разделили по массе тела на 3 группы: до 75 кг, 75–90 и свыше 90 кг. Исходя из данных, полученных в ходе ретроспективного исследования, препарат назначался в дозе 30 МЕ/кг массы тела в/в, что значительно меньше рекомендуемой по инструкции – 50 МЕ/кг в/в 3 раза в неделю [4].
 Дозы для всех пациентов корректировались таким образом, чтобы концентрации Hb оставались в пределах целевого диапазона 10–12 г/дл и не уменьшались >1 г/дл по сравнению с исходным уровнем каждого отдельного пациента. Дозы эпоэтина α корректировались не чаще 1 раза в месяц. Дозы эпоэтина должны были быть уменьшены на 25% для Hb >12 и ≤13 г/дл и увеличены на 25% при снижении Hb >1 г/дл по сравнению с исходным уровнем. При снижении содержания Hb >2 г/дл по сравнению с исходным уровнем доза препарата увеличивалась на 50%, при увеличении Hb 2 г/дл доза препарата уменьшалась на 50%. Лечение временно прерывалось, если Hb превышал 13 г/дл.
Дозы для всех пациентов корректировались таким образом, чтобы концентрации Hb оставались в пределах целевого диапазона 10–12 г/дл и не уменьшались >1 г/дл по сравнению с исходным уровнем каждого отдельного пациента. Дозы эпоэтина α корректировались не чаще 1 раза в месяц. Дозы эпоэтина должны были быть уменьшены на 25% для Hb >12 и ≤13 г/дл и увеличены на 25% при снижении Hb >1 г/дл по сравнению с исходным уровнем. При снижении содержания Hb >2 г/дл по сравнению с исходным уровнем доза препарата увеличивалась на 50%, при увеличении Hb 2 г/дл доза препарата уменьшалась на 50%. Лечение временно прерывалось, если Hb превышал 13 г/дл.
Лечение препаратами железа начинали или усиливали в соответствии с практикой в случаях дефицита железа (сывороточный ферритин <100 мкг/л, НТЖ <20%) и прекращали в отношении пациентов, у которых уровни ферритина в сыворотке были >500 мкг/л или НТЖ >40%. Оценивали массу тела больных, уровни ферритина, трансферрина, НТЖ, СРБ ежемесячно. Демографические данные пациентов и распределение по нозологии представлены в табл. 1–3.
 Оценка безопасности проведена по следующим параметрам:
Оценка безопасности проведена по следующим параметрам:
Серьезные и все побочные эффекты, случаи смерти.
Показатели жизнедеятельности оценивались на каждом визите 3 раза в неделю (жалобы, частота сердечных сокращений – ЧСС, функционирование а-в фистулы).
Электрокардиограмма.
Лабораторные показатели: общий анализ крови, включая уровень Hb, показатели обмена железа, СРБ оценивались ежемесячно.
Адекватность процедуры диализа (3 раза в неделю).
Мониторирование артериального давления – АД 3 раза в неделю во время процедуры гемодиализа.
Статистический анализ. Непараметрические методы, компьютерное ПО SPSS 18.0.
Результаты исследования
Исходно средний уровень Hb у больных в ретроспективном исследовании составлял 105,96±6,81 г/л, колебания его в течение исследования не были значимыми и через 6 месяцев средний уровень Hb составил 107,47±13,22 г/л. Средние величины гематокрита также значимо не менялись на терапии Эральфоном. Большинству (87–95,7%) больных на протяжении 6 месяцев удавалось поддерживать уровни Hb в целевом диапазоне (100–120 г/л). Кроме того, на протяжении 6 месяцев 76–85,7% пациентов удавалось поддерживать уровни ферритина и НТЖ в целевом диапазоне (табл. 4).
 Средние дозы препарата для больных в диализном центре «Фесфарм» оказались значительно ниже рекомендованных и колебались от 15,5 до 40 МЕ/кг 3 раза в неделю, в/в, в среднем составили 26 МЕ/кг. С учетом полученных результатов в ГКБ им. С.П. Боткина были отобраны пациенты для проспективного исследования. Начальная доза Эральфона рассчитывалась исходя из дозы 30 МЕ/кг/ в/в 3 раза в неделю. Дозы корректировались согласно протоколу. В период наблюдения изменение дозы в сторону повышения понадобилось только 1 пациенту, у 2 пациентов доза снижалась.
Средние дозы препарата для больных в диализном центре «Фесфарм» оказались значительно ниже рекомендованных и колебались от 15,5 до 40 МЕ/кг 3 раза в неделю, в/в, в среднем составили 26 МЕ/кг. С учетом полученных результатов в ГКБ им. С.П. Боткина были отобраны пациенты для проспективного исследования. Начальная доза Эральфона рассчитывалась исходя из дозы 30 МЕ/кг/ в/в 3 раза в неделю. Дозы корректировались согласно протоколу. В период наблюдения изменение дозы в сторону повышения понадобилось только 1 пациенту, у 2 пациентов доза снижалась.
Исходно средний уровень Hb у больных в проспективном исследовании составил 103,6±5,83 г/л, колебания его в течение исследования не были значимыми, однако наблюдалась тенденция к повышению уровня Hb и через 6 месяцев средний уровень Hb составил 118,7±11,2 г/л.
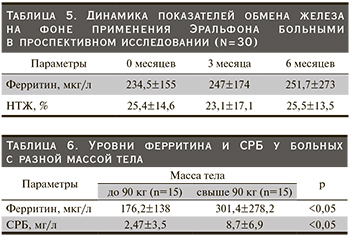
Показатели ферритина в среднем достоверно оказались выше у больных в проспективном исследовании, чем у больных группы ретроспективного исследования (табл. 5).
Средние показатели уровней ферритина и СРБ оказались достоверно выше (p<0,05) у больных с массой тела более 90 кг.
Данные представлены в табл. 6.
Была проанализирована зависимость дозы препарата от показателей обмена железа в обеих группах больных (из 2 центров), оказалось, что она повышалась при повышении уровня ферритина (r=0,7; p<0,05) и низком уровне НТЖ (r=-0,5; p<0,05). При повышении уровня С-реативного белка наблюдалась также прямая корреляция дозы препарата (r=0,3, p<0,05).
За время исследования серьезных побочных эффектов не зафиксировано (табл. 7). Летальных исходов не было. Тромбозы артериовенозной фистулы зафиксированы не были.
На стабильном уровне сохранялись гемодинамические показатели: систолическое АД – 136±21 и 138±26 мм рт.ст., диастолическое АД – 81±12 и 84±13 мм рт.ст., среднее АД – 99,3±16 и 102±17 мм рт.ст. и ЧСС – 70±9 и 72±10 ударов в 1 минуту в конце исследования.
Обсуждение
За последнее время, несмотря на повышение уровня Hb на фоне лечения ЭСС, существенного улучшения результатов лечения не произошло [5–6]. Было также показано, что увеличение уровня Hb выше 130 г/л приводит к увеличению кардиоваскулярных осложнений. В представленном нами исследовании средняя масса тела пациента превышала 80 кг и большинством больных применялась доза ЭСС 2500 МЕ в/в 3 раза в неделю. То есть для эффективного поддержания уровня Hb дозы Эральфона были существенно меньшими по сравнению с рекомендованными фирмой; аналогичные результаты были ранее получены А.Ю. Земченковым и соавт. [7]. Оценки и объяснения этому феномену нами в литературе найдены не были.
К сожалению, в литературе недостаточно данных по использованию доз ЭСС с учетом массы тела пациента. Тем не менее из данных DOPPS (Dialysis Outcomes and Practice Patterns Study) по разным странам известно, что наибольшие средние недельные дозы ЭСС применяются в США (от 12 тыс. до 42 тыс. МЕ/нед), меньше в Китае (от 9000 до 11 500 МЕ/нед) и наименьшие дозы ЭСС применяются в Японии (от 3000 до 4500 МЕ/нед), при этом корректировки на массу тела пациента не производились. Мы не нашли данных, объясняющих столь существенную разницу в дозах ЭСС. Однако можно смело предположить, что одной из причин данного положения вещей является разница в массе тела пациентов в разных странах. В США, по последним данным, более 70% населения страдают избыточной массой тела [8]. Однако одного этого факта недостаточно для понимания использования практически на порядок бóльших дозировок ЭСС в США. Воспаление считается известной и, может быть, основной причиной резистентности к лечению ЭСС, хорошим маркером которой служит СРБ. Недавно было показано, что уровень СРБ прямо коррелирует с массой тела и индексом массы тела [9, 10], и это, возможно, вторая причина использования бóльших доз ЭСС в США. Третьей возможной причиной является высокий уровень ферритина, который обратно коррелирует с уровнем Hb, в США он в среднем превышает 800 мкг/мл [11]. В свою очередь высокий уровень ферритина в США обусловлен, по всей видимости, двумя причинами: 1) большим числом пациентов с повышенной массой тела и ожирением, для которых повышение уровня ферритина более характерно как отражение воспаления, чем показатель железодефицита, как было недавно показано в работе A. Khan et al. [12]; 2) подходом к лечению железодефицита, когда отсутствует верхняя граница нормы для ферритина в национальных рекомендациях США.
В то же время в Японии средний уровень ферритина менее 200 мкг/мл [13] и более сдержанное отношение к введению препаратов железа (только 20–30% больных получают в/в препараты железа) и ниже целевые уровни ферритина [14]. Возможно, что высокие дозы парентеральных препаратов в США обусловливают и в целом худшие результаты лечения диализных больных, чем в других странах [15].
Выводы
Таким образом, мы предлагаем при назначении ЭСС наряду с абсолютной общей недельной дозой препарата более строго учитывать массу тела больного. При этом увеличение дозы ЭСС будет идти опережающими темпами по сравнению с приростом массы тела пациента. Рекомендованные средние дозы в инструкциях к препарату необходимо определять с учетом национальных особенностей населения, использовать препараты с разной дозировкой, подходить более осторожно к назначению препаратов железа, больше ориентируясь на показатель НТЖ.

