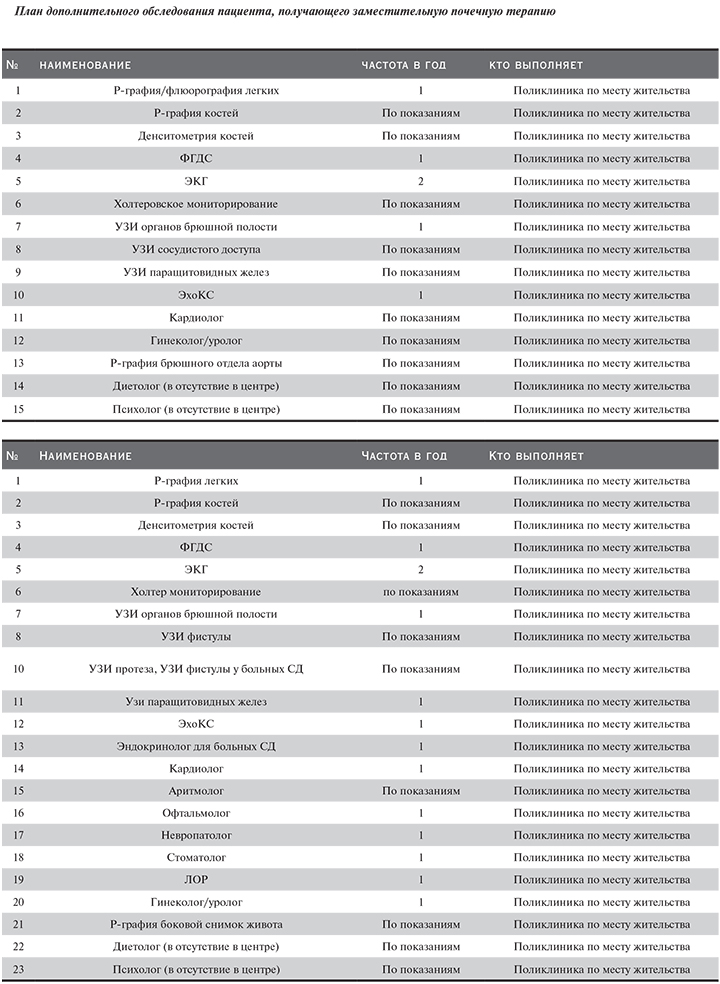
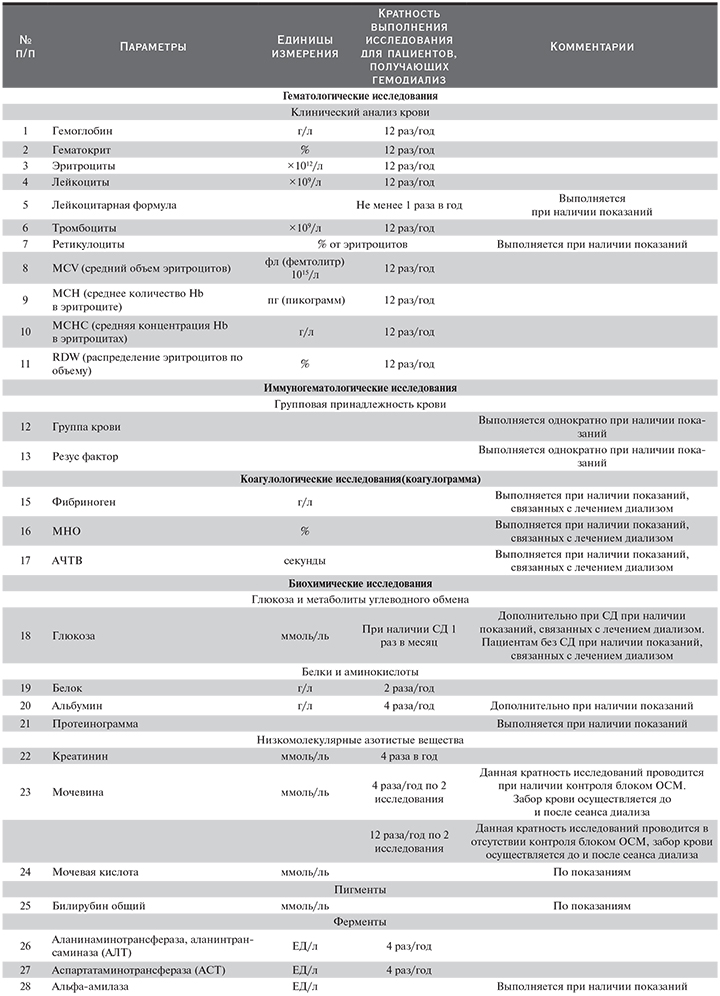
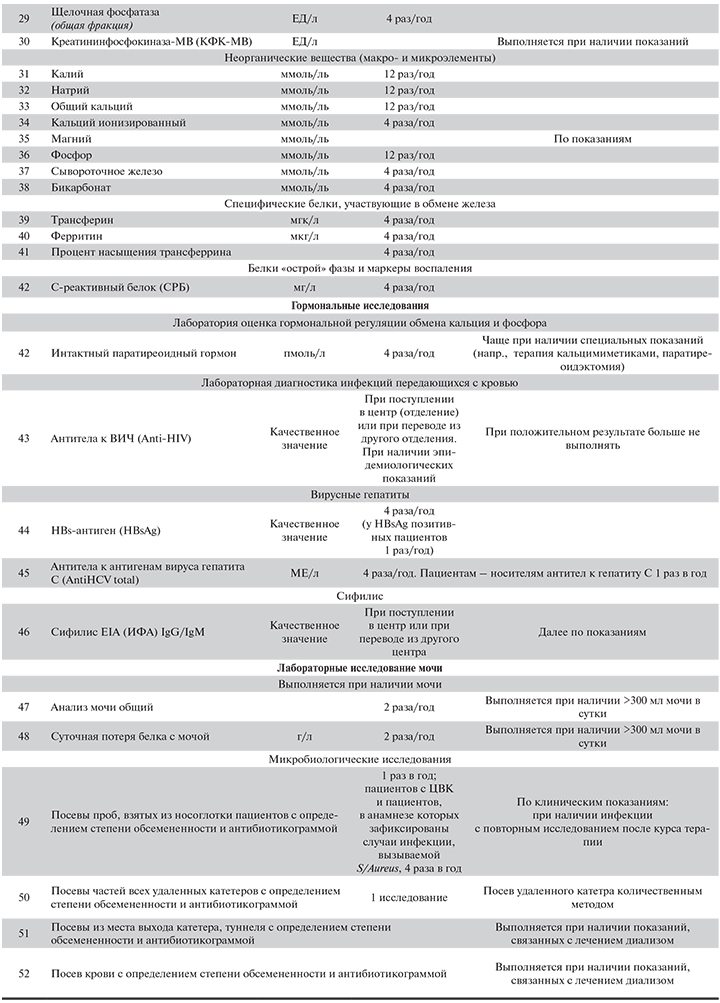
По данным Московского городского нефрологического регистра, темп прироста больных на заместительной почечной терапии (ЗПТ) составляет около 5% в год. Одновременно отмечается увеличение количества отделений и центров гемодиализа различных форм собственности, обеспечивающих доступность диализной помощи населению. В Москве в настоящее время лечение гемодиализом получают более 4000 пациентов в 40 отделениях. В общей структуре ЗПТ в Москве удельный вес гемодиализа составляет 70%. В связи с этим актуальна задача формирования единых методических подходов к лечению таких пациентов, обеспечивающих предоставление необходимой информации практикующему врачу, с одной стороны, и оказание качественной медицинской помощи пациентам, с другой.
Поскольку до настоящего времени в РФ не проводилось крупных доказательных исследований в области заместительной почечной терапии, методическое руководство в основном базируется на данных зарубежных исследователей.
Заместительная почечная терапия – замещение утраченной функций почек специализированными методами (экстракорпорального при гемодиализе и интракорпорального при перитонеальном диализе) очищения крови или трансплантацией почки.
Гемодиализ (ГД) – метод экстракорпорального очищения крови с применением аппарата «искусственная почка». Во время ГД кровь циркулирует через экстракорпоральный контур, состоящий из магистралей и диализатора. Забираемая из сосудистого доступа кровь, поступая в диализатор, находится с одной стороны от полупроницаемой мембраны, в то время как раствор, близкий по своему электролитному составу к циркулирующей крови, диализат прокачивается с другой стороны от нее. Очищение крови происходит в результате переноса через полупроницаемую мембрану воды и растворенных в ней молекул за счет градиента концентрации и градиента давления. Во время процедуры в диализаторе происходит эффективное удаление из крови в диализат воды и низкомолекулярных компонентов крови, токсических веществ и продуктов метаболизма, нормализация нарушений водного и электролитного баланса. Белки, форменные элементы крови, бактерии и вещества с молекулярной массой более 30 тыс. Дальтон через мембрану не проходят. Очищенная кровь затем возвращается в организм больного.
Скорость очищения крови зависит от градиента концентрации веществ между кровью и диализирующим раствором, от скорости кровотока и потока диализирующего раствора, от проницаемости и площади поверхности мембраны диализатора и от молекулярного веса удаляемых веществ. Диализаторы различаются по материалу мембраны (целлюлоза, «замещенная» целлюлоза, полусинтетическая и синтетическая). В настоящее время подавляющее большинство гемодиализных центров используют диализаторы с синтетической мембраной, поскольку последняя обладает наибольшей биосовместимостью, т.е. имеет наименьшую степень активации системы комплемента и клеточных элементов крови, а также лучшую проницаемость для молекул и воды.
Диализирующий раствор
При выполнении процедуры ГД требуется в среднем 120 литров воды, которая контактирует через полупроницаемую мембрану с кровью пациента. В связи с этим все отделения, выполняющие ГД, должны быть оборудованы сертифицированными системами водоочистки, позволяющими получить воду, соответствующую национальному стандарту «вода для гемодиализа». С учетом повсеместного применения высокопроницаемых мембран необходимо обеспечить бактериологическую чистоту диализирующей жидкости, а именно вода, подающаяся к аппарату, должна содержать не более 100 КОЕ, бактериальный эндотоксин должен содержаться в количестве менее 0,25 в мл [9], аппарат должен быть оснащен специальным фильтром диализирующей жидкости.
Гемодиафильтрация (ГДФ) – модификация процедуры гемодиализа. Для выполнения процедуры необходим модифицированный аппарат «искусственная почка». Метод очищения крови основан на принципе диффузионного, фильтрационного и конвекционного переноса через высокопроницаемую, высокопоточную мембрану воды и растворенных в ней молекул за счет градиента концентрации и давления, обеспечивающий эффективное удаление из крови воды и низко- и среднемолекулярных субстанций плазмы крови. Конвекционный перенос осуществляется за счет массивной ультрафильтрации с одновременным замещением раствором-субституатом, либо заранее приготовленным, либо приготовляемым непосредственно аппаратом (on line) из диализата в процессе проведения процедуры.
Начало диализного лечения
Принятие решения о начале диализного лечения пациенту с хронической болезнью почек (ХБП) 5-й стадии должно основываться на клинических и лабораторных данных, при этом время начала диализа должно у каждого больного определяться индивидуально, с учетом всей совокупности этих данных. Диализ должен быть начат при наличии одного из перечисленных, тем более при сочетании следующих симптомов:
- признаки уремической интоксикации: тошнота, рвота, серозит в сочетании с высокой азотемией (уровень мочевины плазмы крови более 40 ммоль/л);
- нарушения кислотно-основного (ацидоз, кетоацидоз) и электролитного баланса (гиперкалиемия);
- угрожающая жизни гипергидратация без возможности консервативного лечения;
- прогрессивное снижение статуса питания, рефрактерное к диетическому вмешательству.
Такие симптомы часто, хотя не во всех случаях, наблюдаются при снижении скорости клубочковой фильтрации (СКФ) до 5–10 мл/мин/1,73 м2. Начало диализного лечения при уровне СКФ ниже 5 мл/мин/1,73 м2 может быть отложено в исключительных случаях: у пациентов с отсутствием клинической симптоматики уремии на период созревания артериовенозной фистулы или у пожилых пациентов в отсутствие выраженной уремии, а также при условии соблюдения пациентом жесткой диеты и наличии возможности проводить ему весь комплекс соответствующей консервативной медикаментозной терапии под наблюдением врача-нефролога.
Для оценки СКФ рекомендуется применять формулу на основе показателя сывороточного креатинина Chronic Kidney Disease Epidemiology Collaboration CKD-EPI [1]. Результаты не требуют приведения к стандартной площади поверхности тела, рассчитываются по возрасту и уровню креатинина.
Для женщин с уровнем креатинина (SCr) ≤0,7 мг/дл
СКФ=144×(0,993)Возраст×( SCr/0,7)-0,328
Для женщин с уровнем креатинина (SCr) >0,7 мг/дл
СКФ=144×(0,993)Возраст×( SCr/0,7)-1,210
Для мужчин с уровнем креатинина (SCr) ≤0,9 мг/дл
СКФ=141×(0,993)Возраст×( SCr/0,9)-0,412
Для мужчин с уровнем креатинина (SCr) >0,9 мг/дл
СКФ= 141×(0,993)Возраст×( SCr/0,7)-1,210
Для проведения процедуры ГД (ГДФ) пациенту с ХБП-5 необходимо наличие постоянного сосудистого доступа. Подобным доступом служат нативная артерио-венозная фистула (АВФ), сосудистый синтетический протез (ССП) и постоянный манжеточный катетер. Сосудистый доступ должен обеспечивать адекватный кровоток не менее 300 мл/мин для осуществления эффективного лечения.
Временный сосудистый доступ для проведения процедур гемодиализа – двухпросветный венозный катетер – может быть использован только в стационаре круглосуточного наблюдения, если пациенту требуется экстренное проведение процедуры, а функционирующего постоянного сосудистого доступа в текущий момент времени не имеется.
Программа диализного лечения
Гемодиализ (гемодиафильтрацию) следует проводить не менее 3 раз в неделю, общее эффективное диализное время должно быть не менее 720 минут в неделю, за исключением случаев значительной остаточной почечной функции. При невозможности достичь требуемой эффективности диализа за 4 часа, при выраженной гемодинамической нестабильности в ходе сеанса ГД, при неконтролируемой фосфатемии, выраженном нарушении статуса питания число и/или продолжительность сеансов лечения могут быть увеличены. При этом диализное время – это самостоятельный, независимый фактор, оказывающий влияние на результаты лечения, неизменный даже при достижении других целей, например дозы диализа. Данные положения приняты в основных рекомендациях [2–4].
При вводе пациентов в диализную программу для профилактики развития синдрома нарушенного равновесия, а также с учетом возможной функциональной незрелости сосудистого доступа стартовым временем процедуры следует считать 120 минут, стартовой скоростью кровотока – 200 мл/мин. При удовлетворительной переносимости процедур время ГД постепенно увеличивается до 240 минут, скорость – до 300 мл/мин.
Количественные характеристики эффективности лечения
При выборе диализатора для проведения процедуры для получения эффективного результата от конкретного пациента следует учитывать следующие параметры диализатора:
- площадь поверхности – она должна быть максимально сопоставимой с площадью поверхности тела;
- клиренс диализатора по мочевине/креатинину/фосфату и витамину В12;
- коэффициент ультрафильтрации (КУф) – характеризует проницаемость мембраны для воды, показывая количество воды в мл/ч, способное пройти через мембрану при давлении на мембрану в 1 мм рт.ст.; высокопроницаемые мембраны имеют КУф более 20.
Для оценки адекватности диализной процедуры используется индекс Kt/V [5]. Он рассчитывается как произведение клиренса диализатора K на время диализа t в минутах, отнесенное к объему распределения мочевины V в мл. Теоретический расчет обладает малой ценностью ввиду непостоянства величин K и V в ходе сеанса ГД [6], однако его необходимо применять при подборе индивидуальной диализной программы для пациента. Классическим методом определения дозы диализа является ее расчет по доле снижения мочевины за сеанс. Для выполнения этого метода необходимо определение уровня мочевины крови до и после процедуры ГД. Для забора образца крови «после ГД» следует после окончания выполнения аппаратом диализной программы на 3 минуты отключить поток диализата, на 15 секунд снизить поток крови до 100 мл/мин, остановить мотор и выполнить забор крови из порта на артериальной диализной магистрали [7]. Вместе с тем следует отметить, что в этом случае оценивается эффективность лишь одной конкретной процедуры, в то время как эффективность остальных 12 процедур (за месяц лечения) остается неоцененной.
В настоящее время широко доступны диализные аппараты, имеющие возможность определять Kt/V в режиме on-line. Применяется в основном измерение изменения кондуктивности диализата. Массоперенос и клиренс по натрию рассчитываются по изменению кондуктивности на входе и выходе диализирующего раствора из диализатора [8], также возможны определение содержания мочевины в диализате и спектрофотометрические методы. Преимущество этих методов состоит в отсутствии потребности забора двух образцов крови, а также в получении показателя обеспеченной дозы диализа.
В любом случае международные рекомендации называют минимальной целью лечения при 3-разовом в неделю ГД обеспеченную его дозу Kt/V 1,2 для однопуловой модели расчета [7]. При наличии существенной остаточной функции почек (ОФП) недельный обеспеченный индекс Kt/V (рассчитанный как сумма диализной дозы и клубочковой фильтрации) должен быть не менее 2,1 [2]. Расчет ОФП у таких пациентов должен производиться ежемесячно для осуществления адекватного лечения.
Гемодиафильтрация (ГДФ)
Метод экстракорпорального очищения крови, представляющий собой модификацию процедуры ГД, предназначенный для увеличения выведения средне- и высокомолекулярных веществ за счет конвекции. Процедура осуществляется на высокопоточных диализаторах – гемодиафильтрах (коэффициент ультрафильтрации более 20 мл/час/мм рт.ст., коэффициент просеивания для β2-микроглобулина свыше 0,6).
На сегодняшний день ГД и ГДФ могут использоваться в равной мере для ЗПТ, до сих пор не получено убедительных данных по преимуществу одного метода лечения над другим.
При технических возможностях выполнения процедуры ГДФ преимущество следует отдавать пациентам, страдающим диализ-связанным амилоидозом, полинейропатией, гемодинамической нестабильностью, сердечной недостаточностью, ишемической болезнью сердца и сахарным диабетом. Также рекомендуют применять лечение ГДФ при длительной ожидаемой продолжительности жизни пациента на диализе, диализном стаже более 10 лет.
Для проведения процедуры необходимо использовать сверхчистую диализирующую жидкость. Целесообразно применять режим постдилюции – введение замещающего раствора после диализатора. Следует стремиться, чтобы объем замещения за процедуру ГДФ в режиме постдилюции был ≥18 л. При использовании режима предилюции – введения замещающего раствора до диализатора, при оценке конвективного объема следует помнить, что фильтрат состоит в определенной пропорции из введенного в кровь чистого замещающего раствора и этот объем не должен учитываться в общем объеме замещения за процедуру.
Заключение
Лечение ГД следует начинать при снижении СКФ до уровня 5–10 мл/мин либо ранее – при наличии клинико-биохимической уремической интоксикации.
Введение в программу диализа производится постепенно. Программный ГД проводится в режиме 3 раза в неделю, длительность процедуры составляет не менее 240 минут. При необходимости кратность и продолжительность процедур могут быть увеличены.
Следует стремиться, чтобы при выполнении ГД/ГДФ индекс Kt/V (обеспеченный) составлял не менее 1,2 за процедуру, а объем замещения при ГДФ был не менее 18 л. Необходимо отметить, что у ряда пациентов достигнуть такой диализной дозы будет невозможно в силу состояния их сосудистого доступа (низкий объемный кровоток) либо антропометрических особенностей (вес более 100кг).
ЛИТЕРАТУРА
- Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604–612.
- KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 Update Am. J. of K. D. 2015;66(5):884–930.
- European best practice guidelines on haemodialysis (Part 2). Nephrol. Dia.Transplant. 2007;22(2).
- National Kidney Foundation KDOQI Clinical Practice Guidelines for Hemodialysis Adequacy, Update 2006.
- Gotch F.A., Sargent J.A. A mechanistic analysis of the National Cooperative Dialysis Study (NCDS). Kidney Int. 1985;28(3):526–534.
- Земченков Г.А., Сабодаш А.Б., Казанцева Н.С. с соавт. Классические и online методы измерения Kt/V: сопоставления и надежность. Нефрология и диализ. 2015;17(2):173–184.
- National Kidney Foundation. KDOQI clinical practice guideline and clinical practice recommendations: hemodialysis adequacy, peritoneal dialysis adequacy, and vascular access: update 2006. Am J Kidney Dis. 2006;48:S1–S322.
- Lindley E.J., Chamney P.W., Wuepper A. et al. A comparison of methods for determining urea distribution volume for routine use in on-line monitoring of haemodialysis adequacy. Nephrol. Dial. Transplant. 2009;24(1):211–216.
- ГОСТ Р 52556-2006 Вода для гемодиализа. Технические условия (с Поправкой, с Изменением N 1).
АНТИКОАГУЛЯЦИЯ
Для пациентов с терминальной стадией почечной недостаточности характерно нарушение свертывающей системы крови [1]. Несмотря на то что ГД за счет удаления уремических токсинов снижает риск кровотечения, контакт крови с инородными поверхностями запускает процессы тромбообразования в диализном контуре, что в свою очередь снижает эффективность процедуры, увеличивает потерю крови, порой приводит к необходимости полной замены диализных магистралей и диализатора, увеличивая таким образом нагрузку на медицинский персонал и повышая стоимость лечения [2, 3]. В связи с этим обязательно проведение антикоагуляции во время процедуры, которая не только предотвращала бы тромбоз в диализном контуре, но и имела бы минимальные риски кровотечения.
Наиболее часто используемый метод – антикоагуляция нефракционированным гепарином [4]. Период полураспада гепарина составляет 30–120 минут [5]. По данным исследований, длительное использование нефракционированного гепарина (НФГ) за счет кумулятивного эффекта может приводить к ряду нежелательных явлений: развитию остеопороза, гиперкалиемии за счет супрессии альдостерона, нарушениям липидного профиля и эндотелиальной дисфункции [3, 6, 7]. Альтернативой служит применение низкомолекулярных гепаринов (НМГ), обладающих сопоставимой антикоагулянтной эффективностью с НФГ, при этом удобных в применении, улучшающих липидный профиль и реже вызывающих гиперкалиемию [3].
Следует отметить, что в литературных источниках отмечается существенная гетерогенность между результатами клинических исследований и текущими руководствами по антикоагулянтной терапии ввиду отсутствия убедительной доказательной базы [8]. Европейская ассоциация ERA-EDTA рекомендует применять при проведении процедур ГД низкие дозы НФГ – начальный болюс 50 ЕД/кг веса тела, а в дальнейшем 800–1500 ЕД/ч или НМГ в соответствии с инструкцией производителя [3].
British Renal Association также предлагает применять или НФГ, или НМГ, не отдавая преимуществ какому-либо гепарину. При этом НФГ рекомендуется также вводить в начале процедуры болюсно, в течение процедуры вводить 500–150 ЕД в час, отключая инфузию гепарина за 30 минут до конца процедуры [9].
The National Kidney Foundation рассматривает НФГ как основной метод антикоагуляции, принимая во внимание легкость его применения и короткий период полужизни препарата, подчеркивая недостаток данных о безопасности применения НМГ [10].
Австралийская ассоциация KHA-CARI отмечает отсутствие доказанных преимуществ применения НМГ перед НФГ [8], подчеркивая гетерогенность результатов клинических исследований.
Режим гепаринизации должен быть индивидуализирован в зависимости от особенностей пациента, его возможной сопутствующей антикоагулянтной и/или антиагрегантной терапии, а также применяемых при процедуре расходных материалов. В рутинной практике лабораторная оценка эффективности антикоагуляции применяется редко. При использовании НФГ традиционным тестом служит определение активированного времени свертывания (АВС), которое должно поддерживаться на уровне 200–250 секунд [5]. При использовании в качестве антикоагулянта НМГ следует оценивать уровень анти-Ха, содержание которого в плазме крови пациента должно составлять 0,25 ЕД/мл, при превышении этого порога возрастает риск кровотечений [11]. С учетом крайне низкой доступности определения анти-Ха и высокой стоимости анализа целесообразно при проведении процедур ГД использовать визуальные методы оценки экстракорпорального контура [5, 12, 13]. Кровь темного цвета в диализных магистралях, темные участки в диализаторе, маятникообразное движение крови в сегменте между диализатором и венозной ловушкой, образование тромбов в венозной ловушке, наличие сгустков в артериальном отделе диализатора, заполнение кровью датчиков давления свидетельствуют о недостаточной антикоагуляции. Нарастание трансмембранного давления в течение процедуры также будет свидетельствовать о повышенном тромбообразовании. Напротив, длительное кровотечение из мест пункций у пациента будет свидетельствовать об избыточной гепаринизации [6].
Для профилактики повышенного тромбообразования в экстракорпоральном контуре поток крови должен быть более 300 мл/мин, особенно при использовании высокопоточных диализаторов. Следует применять диализные иглы соответствующего размера для обеспечения адекватного кровотока. Рециркуляция в сосудистом доступе будет способствовать гемоконцентрации и, сответственно, риску тромбообразования. Воздух должен быть тщательно удален из экстракорпорального контура, диализатора и линии подачи гепарина [14].
Рекомендуется стандартная доза НФГ: болюс: 25 ЕД/кг, затем введение в дозе 1000 ЕД/ч, остановить введение за 30–60 минут до окончания процедуры [14]. Низкая доза НФГ: болюс: 10 ЕД/кг, затем введение в дозе 10 ЕД/кг/ч, остановить введение за 30–60 минут до окончания процедуры [14]. При применении НМГ следует использовать рекомендации по дозированию завода-изготовителя.
Заключение
Для обеспечения безопасной и эффективной антикоагуляции при проведении процедур ГД/ГДФ следует использовать нефракционированный гепарин. Доза препарата подбирается таким образом, чтобы в диализном контуре после окончания процедуры не выявлялось тромбозов, а кровотечение из мест пункций после удаления игл полностью останавливалось через 5–7 минут.
Низкомолекулярные гепарины могут быть альтернативой НФГ для антикоагуляции при ГД/ГДФ, если у пациента имеются показания к постоянному приему этих препаратов в связи с сопутствующим заболеванием или состоянием: ранний послеоперационный период после оперативного вмешательства на сердечно-сосудистой системе, лечение тромбоэмболии легочной артерии, лечение тромбозов глубоких вен, профилактика тромбообразования у лиц, имеющих предрасположенность к таковому.
ЛИТЕРАТУРА
- Jalal D.I., Chonchol M., Targher G. Disorders of hemostasis associated with chronic kidney disease. Semin Thromb Hemost. 2010;36:34–40.
- Kerr P., Perkovic V., Petrie J., Agar J., Disney A. Caring for Australians with Renal Impairment (CARI): dialysis adequacy (HD) guidelines. Nephrology. 2005;10:S61–S80.
- European Best Practice Guidelines Expert Group on Hemodialysis: European Renal association: Section V: chronic intermittent haemodialysis and prevention of clotting in the extracorporeal system. Nephrol Dial Transplant. 2002;17:63–71.
- Golper T., Fissell R., Fissell W., Hartle M., Sanders L., Schulman G. Hemodialysis: core curriculum 2014. Am. J. Kidney.Dis. 2014;63:153–163.
- Руководство по диализу / под ред. Даугирдас Д.Т., Блейк П.Д., Инг Т.С. М.: Центр Диализа. Тверь:ООО «Издательство «Триада». 203. 744 с.
- Suranyi M., Chow J.S.F. Review: anticoagulation for haemodialysis. Nephrology. 2010;15:386–392.
- Lavainne F., Meffray E., Pepper R., Néel M., Delcroix C., Salama A., Fakhouri F. Heparin use during dialysis sessions induces an increase in the antiangiogenic factor soluble Flt1. Nephrol. Dial. Transplant. 2014;29:1225–1231.
- Kessler M., Moureau F., Nguyen P. Anticoagulation in Chronic Hemodialysis: Progress Toward an Optimal Approach. Semin. Dial. 2015;28(5):474–489.
- Mactier R., Hoenich N., Breen C. Renal Association Clinical Practice Guideline on Haemodialysis. Nephron. Clin. Pract. 2011;118:c241–c286.
- Ikizler T.A., Schulman G. Hemodialysis: techniques and prescription. Am J Kidney Dis. 2005;46:976–981.
- Lim W., Cook D.J., Crowther M.A. Safety and efficacy of low molecular weight heparins for hemodialysis in patients with end‐stage renal failure: a meta‐analysis of randomized trials. J. Am. Soc. Nephrol. 2004;15:192–206.
- Vareesangthip K., Thitiarchakul S., Kanjanakul I., Krairittichai U., Bannachak D. Efficacy and safety of enoxaparin during hemodialysis: results from the HENOX study. J. Med. Assoc. Thai. 2011;94:21–26.
- Sabry A., Taha M., Nada M., Al Fawzan F., Alsaran K. Anticoagulation therapy during haemodialysis: a comparative study between two heparin regimens. Blood Coagul Fibrinolysis. 2009;20:57–62.
- Davenport A. Optimization of heparin anticoagulation for hemodialysis. Hemodial Int. 2001;15:S43–S48.
СОСУДИСТЫЙ ДОСТУП
В 1966 г. M.J. Brescia и J.E. Cimino предложили формировать подкожную артериовеноную фистулу (АВФ) в качестве постоянного сосудистого доступа для ГД. Было предложено формировать анастомоз между a.radialis и v.cefalica в области нижней трети предплечья. Со временем вена артериализировалась и становилась доступной для многочисленных пункций [1]. В связи с возрастанием количества пациентов, особенно старшего возраста, увеличением продолжительности их жизни на диализе и сокращением сосудистого резерва стала возникать необходимость формирования гемодиализного доступа с применением синтетических сосудистых протезов (ССП). Дальнейшему совершенствованию методик заместительной почечной терапии и существенному увеличению продолжительности жизни пациентов на ГД сопутствовала необходимость применения новых видов постоянного сосудистого доступа – центральных внутривенных манжеточных катетеров (ЦВК), которые зачастую остаются единственным видом доступа для определенной группы больных.
По данным многочисленных исследований, использование АВФ в отношении пациентов на диализе ассоциировано с лучшими клиническими исходами, включая меньшую частоту инфицирования сосудистого доступа, сроки госпитализации и риск смерти [2–4]. В США в связи с высокой частотой использования катетеров была поставлена цель по созданию АФВ для более чем 50% больных на ГД [5]. Вместе с тем в когорте зарубежных пациентов в отношении 72–90% начавших лечение диализом применялся ЦВК, несмотря на жесткие рекомендации в качестве первого вида сосудистого доступа использовать АВФ [5, 6]. Результаты клинических исследований показали, что ССП имеют преимущества перед ЦВК в меньшем риске инфекционных осложнений, в то время как по сравнению с нативной АВФ сосудистый протез требует большего количества сосудистых интервенций и имеет менее продолжительный срок жизни [7].
Пациентам с коротким ожидаемым сроком жизни и/или такими сопутствующими заболеваниями, как тяжелая сердечная недостаточность или заболевания периферических сосудов, целесообразна имплантация ЦВК [8, 9]. Отрицательное влияние АВФ на сердечно-сосудистую смертность прямо пропорционально скорости потока крови в фистуле и коррелирует с тяжестью исходной сердечно-сосудистой патологии. Так, в отношении пациентов с фракцией выброса ЛЖ ниже 40% и значительной легочной гипертензией не должна использоваться АВФ. Поэтому операции формирования АВФ должна предшествовать оценка сердечной деятельности (ЭКГ и ЭхоКГ-мониторинг) с привлечением при необходимости кардиолога. При формировании как АВФ, так и сосудистого протеза у пациента должны быть достаточный сердечный выброс, способный обеспечить требуемый кровоток в периферических сосудах, адекватное состояние артериального русла, соответствующий потребностям диаметр венозных сосудов и отсутствие препятствий оттоку крови. Если в анамнезе у пациента имелись периферические или ЦВК, имплантируемые водители сердечного ритма, можно ожидать стеноза или окклюзии v.basilica или v.cephalica, в этих случаях формирование АВФ не рекомендуется [10].
Ряд исследований демонстрирует, что пациенты старшего возраста, женщины, пациенты с сосудистыми заболеваниями либо факторами риска сосудистых заболеваний имеют высокую вероятность несостоятельности АВФ [11–13]. Вместе с тем в этой когорте пациентов в качестве первого доступа может быть использован сосудистый протез [14, 15].
Сосудистый доступ для ГД должен быть сформирован заблаговременно. Вместе с тем, как демонстрируют исследования и текущая клиническая практика, прогнозирование времени начала ЗПТ представляет собой сложную задачу. Клинические рекомендации декларируют формировать сосудистый доступ при наличии признаков прогрессирования почечного заболевания при уровне СКФ 15–20 мл/мин [16]. В авторитетном исследовании M.J. Oliver et al. показано, что среди пациентов с заблаговременно сформированным сосудистым доступом 9% умирают, так и не начав лечения, а 10% не нуждаются в ЗПТ в течение 2 лет наблюдения. Среди начавших ЗПТ пациентов только у 40% сосудистый доступ сформирован в срок от 3 до 12 месяцев до старта диализа [17]. Следует подчеркнуть, что, по литературным данным, частота первичной недостаточности АВФ (тромбоз или невозможность пункции) до начала использования в качестве сосудистого доступа составляет от 25 до 60% [18, 19], в то время как первичная недостаточность сосудистого протеза составляет 12–20% [20, 21]. Таким образом, целесообразно планировать создание АВФ за 2–3 месяца до предполагаемого начала ГД. Не рекомендуется формирования АВФ за год или более до начала ГД и при уровне Hb >120 г/л вследствие высокого риска тромбоза фистулы.
Готовность АВФ к пункции оценивается клинически. Сосуд должен хорошо контурироваться, легко пальпироваться и сжиматься, спадаться при подъеме руки. Над анастомозом пальпаторно должно определяться дрожание, аускультативно выслушиваться специфический шум.
KDOQI предлагает «правило 6» для определения степени зрелости сосудистого доступа [22]. Через 6 недель после формирования поток по АВФ должен быть 600 мл/мин, диаметр сосуда – 6 мм, располагаться сосуд должен не глубже 6 мм под кожей и на фистуле должен быть прямой участок, доступный для пункции протяженностью не менее 6 см. Исследование Hemodialysis Fistula Maturation (HFM) провело «ревизию» положений KDOQI. Авторы делают вывод, согласно которому 1-дневные либо 2-недельные показатели объемного кровотока и диаметра сосудов могут использоваться для прогноза «созревания» фистулы и ее возможности обеспечивать адекватный кровоток в будущем. Таким образом, через 2 недели от момента формирования анастомоза АВФ должна быть оценена специалистом на «зрелость», в случае отсутствия признаков «созревания» необходимо выполнять УЗИ для оценки дальнейшего прогноза.
К потенциальным причинам замедленного созревания фистул относятся неоинтимальная гиперплазия стенки фистульной вены [23] и снижение эластичности артерий [24, 25]. Пункция АВФ травматична для сосудистой стенки, в дальнейшем может вызывать неоинтимальную гиперплазию и формирование стеноза [26]. Повторные пункции в одно и то же место сопровождаются рубцовой трансформацией венозной стенки с последующим образованием аневризмы [27]. Другую серьезную проблему составляют постинъекционные гематомы, наблюдающиеся практически у трети пациентов, наиболее часто возникающие при пункции «свежих» фистул или у пациентов старшего возраста [28]. По данным T. Lee, частота тромбозов АВФ после образования гематом составляет 26%, а объем госпитализаций, связанных с гематомами, – 5,2% в год [28].
По данным S.A. Suttie, из 398 фистул независимо от локализации (плечо/предплечье) у 54% развился стеноз, ответственный за значимое снижение кровотока, и 40% фистул в течение 3–5-летнего потеряли функцию [29].
В связи с этим важным аспектом считается техника пунктирования фистулы. Пункцию АВФ должен выполнять опытный персонал. Следует применять «лестничный» или «ротационный подход», меняя места пункций каждую диализную сессию, использовать всю длину фистулы, отступив не менее 3 см от анастомоза. Пункция венозной иглы осуществляется в антеградном направлении – по ходу кровотока; подобное положение иглы уменьшает образование гематом и снижает тенденцию к образованию гематом [30]. Исследования последних лет продемонстрировали, что ретроградное расположение артериальной иглы ассоциировано с достижением большего объемного кровотока [31]. Гемостаз осуществляется точным прижатием места пункции после извлечения иглы. Компрессию необходимо осуществлять в течение 5–10 минут до полной остановки кровотечения; таким образом предотвращается образование гематом в области сосудистого доступа.
Следует обучить пациента ежедневно выполнять физикальное обследование доступа: определение вибрации и пульсовых толчков в области анастомоза при пальпации, аускультативный шум.
Функциональные возможности АВФ следует оценивать не реже 1 раза в месяц. Повторное тромбообразование, трудности с пункцией, длительное кровотечение после извлечения игл, отек руки, снижение диализной дозы служат признаками стеноза АВФ. Ранняя диагностика позволяет своевременно выполнять оперативное вмешательство до того момента, как разовьется тромбоз [32]. Пункции в аневризматически измененный участок доступа не допускаются.
Также следует оценивать руку, на которой расположен сосудистый доступ, на предмет формирования ишемических изменений (синдром обкрадывания). Особое внимание следует уделять пациентам старшего возраста, пациентам с артериальной гипертензией и окклюзирующими заболеваниями периферических артерий или ангиохирургическими вмешательствами в анамнезе, пациентам с сахарным диабетом. При возникновении ишемических изменений необходимы экстренные меры ввиду высокого риска гангрены и ампутации конечности [33].
Предложена классификация степени ишемии
- Стадия I – бледная кожа/либо с синюшным оттенком и/или похолодание конечности без боли;
- Стадия II – боль возникает при упражнениях или во время ГД;
- Стадия III – боль возникает в покое;
- Стадия IV – возникновение язв, участков гангрены, стеноза.
На сегодняшний день принято считать, что целевые показатели скорости кровотока в фистуле должны составлять 400–600 мл/мин; при скорости кровотока более 800 мл/мин целесообразно выполнение хирургического пособия для уменьшения сброса тока крови из артерии в вену. Для мониторинга за состоянием АВФ используются УЗДГ, вено- и артериография (фистулография). Пациентам с рефрактерной хронической сердечной недостаточностью, ишемической болезнью сердца с нестабильной стенокардией, синдромом коронарного или периферического «обкрадывания» и тяжелой легочной гипертензией показано лигирование АВФ с переводом на перитонеальный диализ (ПД). При эндокардите после удаления инфицированной АВФ рекомендован временный перевод больного ГД на ПД или на низкопоточный диализ, повышающий эффективность антибактериальной терапии с последующим протезированием сердечных клапанов. Также ПД может использоваться на время формирования и созревания стандартной АВФ вместо фистулы с избыточным сбросом.
Инфицирование первичного сосудистого доступа рассматривается как эквивалент подострого бактериального эндокардита и нуждается в назначении антибактериальной терапии на период 6 недель [33].
Заключение
- АВФ – метод выбора для пациентов на диализе и ассоциирована с лучшими клиническими исходами, включая меньшую частоту инфицирования сосудистого доступа, сроки госпитализации и риск смерти.
- Целесообразно планировать создание АВФ за 2–3 месяца до предполагаемого начала ГД. Не рекомендуется формирования АВФ за год или более до начала ГД и при уровне Hb >120 г/л вследствие высокого риска тромбоза фистулы.
- Пациентами с фракцией выброса ЛЖ ниже 40% и значительной легочной гипертензией АВФ не должна использоваться.
- Пункцию АВФ должен выполнять опытный персонал. Следует применять «лестничный» или «ротационный подход», меняя места пункций каждую диализную сессию, использовать всю длину фистулы, отступив не менее 3 см от анастомоза.
Туннельные манжеточные катетеры
Туннельные манжеточные катетеры (ТМК) в последние годы все шире применяются в качестве сосудистого доступа для ГД [34]. Имплантация катетера позволяет использовать его сразу после установки, не требуя времени для созревания сосудистого доступа. При использовании ТМК нет необходимости многократных пункций для проведения процедур. Катетер не влияет на сердечный выброс и не создает повышенной нагрузки на миокард. Вместе с тем по сравнению с другими сосудистыми доступами у ТМК имеются недостатки, основные из которых – тромбозы [35, 36] и инфекционные осложнения [34]. Кроме этого существует риск стеноза или окклюзии катетера. Ожидаемое время жизни этого сосудистого доступа значительно короче по сравнению с АВФ и сосудистым протезом, по данным литературы, в среднем составляет 289 (10–720) дней [34] . Также через катетер невозможно осуществлять скорость кровотока более 350 мл/мин, в связи с этим для достижения достаточной диализной дозы необходимо увеличивать время процедуры.
Клинические рекомендации по сосудистому доступу предлагают, если возможно, избегать установки туннельных манжеточных катетеров длительного стояния в качестве постоянного сосудистого доступа. В случае необходимости использования на период созревания сосудистого доступа катетер не должен устанавливаться на сторону, где располагается свежий доступ [33]. Не следует устанавливать ТМК в бедренную вену в случае, если пациент стоит в листе ожидания на трансплантацию почки [33].
При работе с сосудистым доступом персонал должен строго соблюдать правила асептики и антисептики. Обработка наружной части катетера должна производиться антисептиками, разрешенными к применению компанией-производителем, спиртосодержащие антисептики могут вызывать разрушение ряда синтетических материалов, из которых изготовлены катетеры. При работе с ТМК для профилактики инфицирования следует надевать хирургическую маску и шапочку пациенту. Пациенты должны знать, что несоблюдение правил личной гигиены повышает риск инфекционных осложнений.
После окончания процедуры ТМК закрываются гепариновым замком, в каждое колено катетера вводится объем нефракционированного гепарина, соответствующий маркировке на катетере. Применение в качестве замка для ТМК растворов с антибиотиками в настоящее время не рекомендуется, поскольку не имеется доказательной базы преимуществ их применения [37]. Раствор тауролидина (входит в состав препарата Тауролок) обладает широким антимикробным спектром и схожей с гепарином антитромботической активностью. Может быть использован для создания замка в ТМК.
Прием низких доз варфарина или других системных антикоагулянтов для профилактики тромбоза ТМК не показан [37].
Обнаружение в месте стояния катетера покраснения, припухлости, местного повышения температуры тела, наличие экссудата из места стояния катетера должны рассматриваться как инфекционное осложнение. Пациент должен быть госпитализирован для определения вида возбудителя и чувствительности к антибиотикам. На период ожидания результата посева должна быть начата эмпирическая антибактериальная терапия.
В случае тромбоза ТМК без признаков воспаления следует предпринимать попытку растромбирования катетера. В связи с высоким риском возникновения осложнений во время тромболизиса пациент должен быть госпитализирован в стационар круглосуточного наблюдения.
В случаях катетер-ассоциированной инфекции, персистирующих тромбозов, повреждения наружных частей катетера последний должен быть удален [37].
Каждое отделение ГД должно иметь протокол работы с катетером.
ЛИТЕРАТУРА
- Мойсюк Я.Г., Беляев А.Ю. Постоянный сосудистый доступ для гемодиализа. Тверь: ООО «Изд-во “Триада”», 2004. 152 с.
- Xue H., Ix J.H., Wang W., Brunelli S.M., Lazarus M., Hakim R., Lacson E. Jr. Hemodialysis access usage patterns in the incident dialysis year and associated catheter-related complications. Am. J. Kidney Dis. 2013;61:123–130.
- Pisoni R.L., Arrington C.J., Albert J.M., Ethier J., Kimata N., Krishnan M., Rayner H.C., Saito A., Sands J.J., Saran R., Gillespie B., Wolfe R.A., Port F.K. Facility hemodialysis vascular access use and mortality in countries participating in DOPPS: An instrumental variable analysis. Am. J. Kidney Dis. 2009;53:475–491.
- Vascular Access 2006 Work Group: Clinical practice guidelines for vascular access. Am J Kidney Dis. 2006;48(1): S176–S247.
- Fistual First Breakthrough Initiative. Available at: http://www.fistulafirst.org/AboutFistulaFirst/FFBIData.aspx. Accessed July 7, 2013
- Drew D.A., Lok C.E., Cohen J.T. et al. Vascular access choice in incident hemodialysis patients: a decision analysis. J.Am. Soc. Nephrol. 2015;26(1):183–191.
- Lok C.E., Sontrop J.M., Tomlinson G., Rajan D., Cattral M., Oreopoulos G., Harris J., Moist L. Cumulative patency of contemporary fistulas versus grafts (2000–2010). Clin. J. Am. Soc. Nephrol. 2013;8:810–818.
- Beathard G.A., Spergel L.M. Hand ischemia associated with dialysis vascular access: an individualized access flow-based approach to therapy. Semin. Dial. 2013;26(3):287–314.
- Wasse H., Singapuri M.S. High-output heart failure: how to define it, when to treat it, and how to treat it. Semin. Nephrol. 2012;32(6):551–557.
- El Ters M., Schears G.J., Taler et al. Association between prior peripherally inserted central catheters and lack of functioning arteriovenous fistulas: a case-control study in hemodialysis patients.SJ Am. J. Kidney Dis. 2012;60(4):601–608.
- Monroy-Cuadros M., Yilmaz S., Salazar-Bañuelos A., Doig C. Risk factors associated with patency loss of hemodialysis vascular access within 6 months. Clin.J. Am. Soc. Nephrol. 2010;5:1787–1792.
- Miller C.D., Robbin M.L., Allon M. Gender differences in outcomes of arteriovenous fistulas in hemodialysis patients. Kidney Int. 2003;63:346–352.
- Lok C.E., Allon M., Moist L., Oliver M.J., Shah H., Zimmerman D.: Risk equation determining unsuccessful cannulation events and failure to maturation in arteriovenos fistulas (REDUCE FTM I). J. Am. Soc. Nephrol. 2006;17:3204–3212.
- Allon M., Lok C.E. Dialysis fistula or graft: The role for randomized clinical trials. Clin. J. Am. Soc. Nephrol. 2011;5:2348–2354.
- O’Hare A.M. Vascular access for hemodialysis in older adults: A “patient first” approach. J. Am. Soc. Nephrol. 2013;24:1187–1190.
- Jindal K., Chan C.T., Deziel C. Hemodialysis clinical practice guidelines for the Canadian Society of Nephrology. J. Am. Soc. Nephrol. 2006;17(3)(1):S1–S27.
- Oliver M.J., Quinn R.R., Garg A.X., Kim S.J., Wald R., Paterson J.M. Likelihood of starting dialysis after incident fistula creation. Clin J Am Soc Nephrol. 2012;7(3):466–471.
- Al-Jaishi A.A., Lok C.E., Garg A.X. et al. Vascular access creation before hemodialysis initiation and use: a population-based cohort study. Clin J Am Soc Nephrol. 2015;10(3):418–427.
- Dember L.M., Beck G.J., Allon M. et al .Effect of clopidogrel on early failure of arteriovenous fistulas for hemodialysis: a randomized controlled trial. JAMA. 2008;299(18):2164–2171.
- Allemang M.T., Schmotzer B., Wong V.L. Arteriovenous grafts have higher secondary patency in the short term compared with autologous fistulae. Am J Surg. 2014;208(5): 800–805.
- Lee T., Barker J., Allon M. Comparison of survival of upper arm arteriovenous fistulas and grafts after failed forearm fistula. J Am Soc Nephrol. 2007;18(6):1936–1941.
- Vascular Access Work Group. Clinical practice guidelines for vascular access. Am J Kidney Dis. 2006;48(suppl 1):S176-S247
- Lee T., Chauhan V., Krishnamoorthy M. et al. Severe venous neointimal hyperplasia prior to dialysis access surgery. Nephrol Dial Transplant. 2011;26(7):2264–2270.
- Lok C.E., Allon M., Moist L. Predicting successful arteriovenous fistula creation. Am J Kidney Dis. 2012;60(3):498–489.
- Dixon B.S. Why don’t fistulas mature? Kidney Int. 2006;70(8):1413–1422.
- Hsiao J.F., Chou H.H., Hsu L.A. et al. Vascular changes at the puncture segments of arteriovenous fistula for hemodialysis access. J Vasc Surg. 2010;52(3):669–673.
- Kronung G. Plastic deformation of Cimino fistula by repeated puncture. NDT. 1984;13:635–638.
- Lee T., Barker J., Allon M. Needle infiltration of arteriovenous fistulae in hemodialysis: risk factors and consequences. Am J Kidney Dis. 2006;47(6):1020–1026.
- Suttie S.A., Ponnuvelu G., Henderson N et al Natural history of upper limb arterio-venous fistulae for chronic hemodialysis. J Vasc Access. 2012;13(3):332–337.
- Ball L.K. Improving arteriovenous fistula cannulation skills. Nephrol Nurs J. 2005;32(6):611–617.
- Fulker D., Kang M., Simmons A., Barber T. The flow field near a venous needle in hemodialysis: a computational study. Hemodial Int. 2013;17(4):602–611.
- Руководство по диализу /под ред. Даугирдас Д.Т., Блейк П.Д., Инг Т.С. М.: Центр Диализа. Тверь:ООО «Издательство «Триада», 203. 744 с.
- Clinical Practice Guidelines for Vascular Access. Am. J. Kidney Dis. 2006l;48(S1): S176–247.
- Cetinkaya R., Odabas A.R., Unlu Y. et al. Using cuffed and tunnelled central venous catheters as permanent vascular access for hemodialysis: a prospective study. Ren Fail. 2003;25(3):431–438.
- Gunawansa N., Sudusinghe D.H., Wijayaratne D.R. Hemodialysis Catheter-Related Central Venous Thrombosis: Clinical Approach to Evaluation and Management. Ann Vasc Surg. 2018;51:298–305.
- Premuzic V., Perkov D., Smiljanic R. The development of central venous thrombosis in hemodialyzed patients is associated with catheter tip depth and localization. Нemodial Int. 2018 May 2. [Epub ahead of print]
- Haemodialysis catheters. Guidelines https://www.health.qld.gov.au
ПРОТОКОЛ РАБОТЫ С ДИАЛИЗНЫМ КАТЕТЕРОМ (ОБРАЗЕЦ)
Подключение больного к аппарату ГД:
- Вымыть руки, надеть шапочку, маску (шапочка и маска надеваются в обязательном порядке и на больного!), перчатки.
- Накрыть стерильной пеленкой одежду больного, образуя рабочее поле.
- Снять повязку с катетера; снять марлевые салфетки и полоски пластыря с концов катетера.
- Обработать концы катетера антисептиком (двукратно).
- Обработать перчатки раствором антисептика.
- Снять заглушки с катетера (зажимы на концах катетера должны быть закрыты!). Аспирировать гепарин из каждого просвета катетера (на каждый просвет используется отдельный шприц 20 мл), заполненный 10 мл 0,9%-ного раствора натрия хлорида.
- Промыть артериальный и венозный просветы катетера 0,9%-ным раствором натрия хлорида – 20 мл (на каждый просвет – отдельный шприц).
- Далее подключать пациента к аппарату по обычной схеме.
Отключение больного от аппарата ГД:
- Вымыть руки, надеть шапочку, маску (шапочка и маска надеваются в обязательном порядке и на больного!), перчатки.
- Отключить больного от аппарата ГД по обычной схеме.
- Промыть каждый просвет катетера 20 мл 0,9%-ного раствора NaCl (на каждый просвет – отдельный шприц).
- Ввести в артериальный и венозный просветы катетера чистый раствор гепарина, который набирается в разные 2,0 мл шприцы и вводится в количестве, указанном непосредственно на каждом конце катетера), затем на концы катетера навинчиваются стерильные заглушки.
- Обработать место входа катетера антисептиком, наложить стерильную наклейку.
- Наружные концы катетера закрыть стерильной салфеткой, фиксировать лейкопластырем к коже.
Технология проведения процедуры гемодиализа
Гемодиализ – процедура экстракорпорального очищения крови пациентов с диализ-потребной стадией ХБП, проводимая с использованием аппарата «искусственная почка» (АИП). Аппарат обеспечивает экстракорпоральное кровообращение и циркуляцию диализирующего раствора, а также контролирует параметры циркуляции, качество диализирующего раствора и обеспечивает безопасность экстракорпорального кровообращения и процедуры в целом.
В контуре диализирующего раствора очищенная вода, поступающая из системы водоподготовки, смешивается с кислотным и бикарбонатным гемодиализными концентратами, подогревается, дегазируется и подается в диализатор. В настоящее время все шире применяется аппаратура, позволяющая в онлайн-режиме приготовить бикарбонатный компонент диализного раствора из сухого порошка гидрокарбоната натрия, помещенного в картридж.
Процедура гемодиализа
Подготовить АИП к работе согласно инструкции фирмы-изготовителя. Перед началом процедуры аппарат должен пройти обязательное автоматическое тестирование, обеспечивающее проверку годности всех блоков аппарата.
Перед подключением пациента к АИП убедиться, что экстракорпоральный контур полностью заполнен физиологическим раствором (субституатом), коннекторы диализата подсоединены к диализатору, датчики давления на артериальной и венозной магистралях функционируют, установлены уровни жидкости в артериальной и венозной ловушках.
В системе магистралей нет перегибов, натяжений и скручиваний. Убедиться, что промывка экстракорпорального контура закончена, АИП готов к работе.
Выставить диализную программу в соответствии с назначенными параметрами. Убедиться, что диализатор, объем ультрафильтрации, время процедуры, состав диализата, объем и скорость подачи гепарина соответствуют предписанным значениям. При наличии опции определения диализной дозы выставить индивидуальные параметры пациента.
Пунктировать сосудистый доступ или подготовить ЦВК к работе. Убедиться, что кровоток будет соответствовать предписанной диализной программе.
Присоединить магистрали к пациенту. Произвести подключение пациента в соответствии с инструкцией к АИП.
После выхода АИП в режим диализа провести завершающий контроль параметров процедуры, показателей систем мониторинга аппарата.
В течение процедуры проводить динамический контроль состояния пациента во время процедуры.
В случае тромбирования экстракорпорального контура крови или обнаружения брака системы в ходе процедуры необходимо провести замену части или всей системы магистралей и диализатора.
По завершении процедуры отключить пациента от АИП в соответствии с инструкцией к аппарату.
После полной остановки кровотечения из мест пункций наложить асептическую повязку/при использовании ЦВК, промыть катетер физиологическим раствором, заполнить бранши катетера гепарином в соответствии с маркировкой. Наложить фиксирующую повязку.
Провести дезинфекцию АИП. Выполнить гигиеническую обработку поверхности аппарата.
Правила пунктирования артериовенозной фистулы
Проверить готовность аппарата:
а) техническую;
б) по выставляемым параметрам.
Проверить комплектность индивидуального столика:
а) набор стерильных пеленок;
б) стерильные салфетки;
в) салфетки с кожным антисептиком;
г) три–пять полосок лейкопластыря (укрепить на фронтальной поверхности индивидуального столика);
д) комплект фистульных игл;
е) перчатки, маску, шапочку;
ж) лоток для отработанного материала.
Осмотреть фистулу и определить места пункции артериальной и венозной игл. Артериальная игла может быть установлена как по ходу кровотока, так и против на расстоянии не менее 5 см от анастомоза. Венозная игла устанавливается только по ходу кровотока. Расстояние между артериальной и венозной иглами должно быть не менее 5 см, от мест прежних пункций – не менее 1 см.
Надеть медицинскую шапочку, медицинскую маску, перчатки.
Вскрыть стерильный набор, за края раскрыть пеленку и уложить под фистульную руку пациента.
Трижды обработать область пункций раствором кожного антисептика. Дождаться полного высыхания.
Фистульные иглы с соблюдением мер асептики вскрыть и выложить на пеленку. Проверить колпачки на иглах.
Пунктировать артериальный и венозный отделы фистулы соответствующими иглами (при пункции зажим на иглах открыт).
Проверить положение игл в просвете сосуда:
а) игла параллельна стенкам сосуда (по возможности);
б) срез игл направлен вниз (красная метка на корпусе иглы сверху).
Фиксировать иглы полосками лейкопластыря.
Дальнейшее подключение пациента проводится в соответствии с инструкцией к аппарату.
ПРИЛОЖЕНИЯ