Введение
Cовременная иммуносупрессивная терапия позволяет достигать более 90% однолетней выживаемости почечных трансплантатов, однако это сопряжено с развитием сердечно-сосудистых, онкологических, инфекционных осложнений и посттрансплантационного сахарного диабета (ПТСД) [1]. Принципы диагностики и лечения ПТСД или впервые возникшего СД после трансплантации NODAT (New Onset Diabetes After Transplantation) основаны на критериях СД и нарушенной толерантности к глюкозе (НТГ), принятых Всемирной организацией здравоохранения (ВОЗ) и Американской диабетической ассоциацией (АДА) и опубликованных в 2003 г. международной группой экспертов – трансплантологов и диабетологов [2]. Показатели заболеваемости ПТСД в значительной степени зависят от продолжительности наблюдения, диагностических критериев и режима иммуносупрессии [3]. F. Vincenti et al. показали, что распространенность ПТСД достигает 20,5% в течение первых 6 месяцев после аллотрансплантации почки (АТП), когда реципиенты получают максимально высокие дозы иммуносупрессантов [4]. Через 6 месяцев после трансплантации ежегодная заболеваемость СД становится аналогичной, выявляемой у пациентов, находящихся в листе ожидания на трансплантацию почки, и составляет около 6% в год [5]. После 3 лет АТП, по данным USRDS (United States Renal Data System), у 4,105 (19,1%) из 21,489 реципиентов выявляется ПТСД. У реципиентов с ПТСД развиваются характерные для СД 2 типа (СД2) осложнения, которые диагностируют через 500–600 дней после его дебюта [6]. Как следствие – ПТСД ассоциируется с плохим прогнозом из-за повышенного риска сердечно-сосудистых катастроф, потери трансплантата, смерти от потери трансплантата и смерти реципиента [7, 8]. Кроме этого ПТСД существенно увеличивает медицинские расходы [9].
Наше исследование, проведенное на базе Московского городского нефрологического центра (МГНЦ), направлено на изучение распространенности ПТСД у пациентов, наблюдавшихся в данном центре после АТП, и влияния факторов риска развития этой патологии.
Материал и методы
В качестве статистических методов анализа использовались процедуры описательной статистики: распределение частот, средняя величина, показатели разброса (среднеквадратическое отклонение, дисперсия, стандартная ошибка среднего, асимметрия, эксцесс).
Процедуры таблицы сопряженности включали анализ распределения показателей двумерных соотношений в разных группах испытуемых (управляющая переменная). Также вычислялся ряд критериев и мер силы связи для двумерных таблиц: χ2-критерий Пирсона, критерий линейно-линейной связи, коэффициент корреляции Пирсона, коэффициент сопряженности. Рассчитывалась достоверность различий для разных выборок и сравнивалась с заданным уровнем значимости.
Линейная модель. Построение стандартной единичной модели для предсказания целевой переменной (ПТСД), используя ее взаимосвязи с предикторами (входные поля), методом прямого шагового отбора по критериям включения/удаления – информационный критерий (AICC), который включает эффекты с р-значениями, меньше чем 0,05, и исключает эффекты с р-значениями, больше чем 0,01.
Статистические данные обрабатывались с помощью программы IBM SPSS Statistics 22.0.

Результаты исследования
Распространенность ПТСД среди реципиентов с АТП. Проведен ретроспективный анализ амбулаторных карт 146 реципиентов (мужчин и женщин 46,6%, женщин 53,4%), которые прожили более года после АТП и наблюдались в МГНЦ с января 1989 по декабрь 2014 г. Диагноз «сахарный диабет», установленный до проведения АТП, был критерием исключения пациентов из исследования. На основании диагностических критериев ВОЗ/АДА 2003 г. ПТСД выявили у 32 (21,9%) пациентов (табл. 1).
Средний возраст реципиентов АТП с развитием ПТСД на момент проведения исследования составил 42,9 года. Вероятность развития ПТСД росла по мере увеличения возраста реципиентов (r=0,345 при р≥0,01).
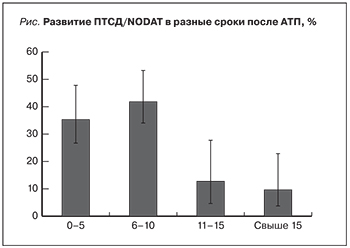 Вероятность развития ПТСД обратно связана со временем проведения АТП. Более половины всех случаев ПТСД (24 [75,0%]) выявлены в первые 10 лет после АТП. Вероятность развития ПТСД была наибольшей в первые 5 и 10 лет после АТП (11 [34,4%] и 13 [40,6%] соответственно) и резко снижалась в последующие годы: через 11–15 лет после АТП распространенность ПТСД составила 4 (12,5%)), после 15 лет – 4 (9,4%) случая (см. рисунок).
Вероятность развития ПТСД обратно связана со временем проведения АТП. Более половины всех случаев ПТСД (24 [75,0%]) выявлены в первые 10 лет после АТП. Вероятность развития ПТСД была наибольшей в первые 5 и 10 лет после АТП (11 [34,4%] и 13 [40,6%] соответственно) и резко снижалась в последующие годы: через 11–15 лет после АТП распространенность ПТСД составила 4 (12,5%)), после 15 лет – 4 (9,4%) случая (см. рисунок).
Влияние режимов иммуносупрессивной терапии на распространенность ПТСД. Поскольку АТП проводилась реципиентам в разные годы на протяжении большого периода времени (более 15 лет), а именно на тот период приходится изменение режимов иммуносупрессивной терапии, мы предположили, что различия в распространенности ПТСД (75,0% vs 21,9% до и после 10 лет АТП соответственно) могут быть связаны с режимом проводимой иммунносупрессивной терапии. Протокол иммуносупрессивной терапии был известен у 103 из 146 больных и представлял следующие препараты (табл. 2):
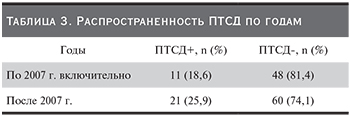
Концентрации ЦсА и Тс в плазме поддерживались в пределах терапевтических значений в течение всего времени наблюдения. Как оказалось, частота развития ПТСД до и после 2007 г., несмотря на различия в протоколах, статистически не различалась (табл. 3).
Факторы риска развития ПТСД (линейное моделирование). С целью выявления независимых факторов риска, предсказывающих возникновение ПТСД, создана стандартная линейная модель методом прямого пошагового отбора по информационному критерию (AICC). Анализу подверглись следующие предикторы: основные характеристики пациентов: пол, возраст, срок АТП и применение иммуносупрессивной терапии ГКС, Тс, ЦсА.
 Информационный критерий равен значению -320,127 на четвертом шаге. Точность модели равняется 38%. Частотные поля пола и срока АТП пациентов не вошли в модель из-за отсутствия эффекта этих предикторов.
Информационный критерий равен значению -320,127 на четвертом шаге. Точность модели равняется 38%. Частотные поля пола и срока АТП пациентов не вошли в модель из-за отсутствия эффекта этих предикторов.
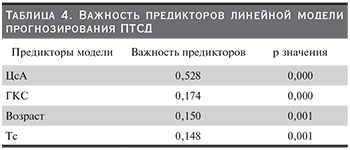
В табл. 4 показаны предикторы модели, т.е. факторы, влияющие на возникновение целевой переменной ПТСД. Показатель важности предиктора демонстрирует относительную важность каждого предиктора при оценке модели до 1,0. Необходимо понимать, что важность фактора (предиктора) не связана с точностью самой модели. Она лишь связана с важностью каждого предиктора для прогнозирования, а не с точностью этого прогнозирования.
Выявленная модель свидетельствует: иммуносупрессивная терапия и возраст служат факторами риска, предсказывающими возникновение ПТСД. При этом важность применения ЦсА для результата прогноза более чем в 3 раза превышает ГКС и Тс, но это не означает, что использование ЦсА в рамках данной модели в 52,8% случаев приведет к развитию ПТСД.
Обсуждение
 Возраст. Старший возраст – важный фактор риска развития ПТСД, что подтверждается результатами проведенного исследования B.L Kasiske et al., проанализировавшего данные USRDS (US Renal Data System) более чем 11 тыс. первичных трансплантаций почек в период между 1996 и 2000 г. и выявившего сильную ассоциацию между возрастом и ПТСД [8, 10]. F.G. Cosio et al. показали, что у реципиентов старше 45 лет ПТСД развивается в 2,2 раза чаще, чем у тех, которые на момент трансплантации были моложе (р<0,0001). Относительный риск ПТСД у реципиентов в возрасте 45–59 лет по сравнению с 18–44-летними составил 1,9 (р<0,0001), для тех, кто были ≥60 лет, относительный риск составил 2,09 (р<0,0001) [10].
Возраст. Старший возраст – важный фактор риска развития ПТСД, что подтверждается результатами проведенного исследования B.L Kasiske et al., проанализировавшего данные USRDS (US Renal Data System) более чем 11 тыс. первичных трансплантаций почек в период между 1996 и 2000 г. и выявившего сильную ассоциацию между возрастом и ПТСД [8, 10]. F.G. Cosio et al. показали, что у реципиентов старше 45 лет ПТСД развивается в 2,2 раза чаще, чем у тех, которые на момент трансплантации были моложе (р<0,0001). Относительный риск ПТСД у реципиентов в возрасте 45–59 лет по сравнению с 18–44-летними составил 1,9 (р<0,0001), для тех, кто были ≥60 лет, относительный риск составил 2,09 (р<0,0001) [10].
Наши данные совпадают с представленными в литературе и демонстрируют тесную корреляцию ПТСД с возрастом и высокую частоту ПТСД среди реципиентов старше 50 лет. Самая высокая распространенность ПТСД (26 [37%]) была среди пациентов старше 50 лет, самая минимальная – 1 (6,7%) и 1 (4,2%) в группе до 30 и 31–40 лет соответственно (см. табл. 1).
Ингибиторы кальциневрина (ИКН/CNI). ЦсА и Тс служат ингибиторами кальциневрина (ИКН/CNI) с аналогичным механизмом действия и вызывают нарушение секреции инсулина, препятствуя ядерному фактору активации Т-клеток передавать сигналы β-клеткам поджелудочной железы. Этот путь запускает экспрессию генов, важных для функции β-клеток, включая по крайней мере 6 генов, мутации которых связаны с наследственными моногенными формами СД [11]. Тс подавляет секрецию инсулина на уровне транскрипции мРНК через реакцию с биндером протеина-12 и последующим ингибированием кальциневрина в β-клетках поджелудочной железы [12]. Высокий уровень Тс, связывающий биндер протеин-12 в панкреатических β-клетках, может объяснить, почему этот препарат ингибирует секрецию инсулина сильнее, чем циклоспорин [12].
Исследования показали, что терапия и концентрация ИКН оказывают токсическое воздействие на β-клетки поджелудочной железы [11–15], тесно коррелирует с НТГ, ПТСД и диабетическими осложнениями после трансплантации органов [11, 13, 14, 16–21].
 В первом открытом многоцентровом рандомизированном исследовании DIRECT (Diabetes Incidence after Renal Transplantation: Neoral C2 monitoring versus Tacrolimus) и представленных мета-анализах [22, 23] было продемонстрировано, что заболеваемость ПТСД или НГН (по определению ВОЗ/AДA) через полгода после трансплантации была достоверно ниже при лечении ЦсА по сравнению с Тс (26 против 33,6%; р=0,046). Связанный с Тс риск ПТСД зависит от дозы, и высокая концентрация ИКН повышает этот риск, особенно в ранний период после трансплантации [15, 24–26]. Однако конверсия ЦсА на Тс в позднем периоде после трансплантации не оказывала достоверного влияния на метаболизм глюкозы [25, 27, 28].
В первом открытом многоцентровом рандомизированном исследовании DIRECT (Diabetes Incidence after Renal Transplantation: Neoral C2 monitoring versus Tacrolimus) и представленных мета-анализах [22, 23] было продемонстрировано, что заболеваемость ПТСД или НГН (по определению ВОЗ/AДA) через полгода после трансплантации была достоверно ниже при лечении ЦсА по сравнению с Тс (26 против 33,6%; р=0,046). Связанный с Тс риск ПТСД зависит от дозы, и высокая концентрация ИКН повышает этот риск, особенно в ранний период после трансплантации [15, 24–26]. Однако конверсия ЦсА на Тс в позднем периоде после трансплантации не оказывала достоверного влияния на метаболизм глюкозы [25, 27, 28].
В нашем исследовании после конверсии ЦсА на Тс отмечено увеличение распространенности ПТСД с 11 (18,6%) до 21 (26%) случая, однако статистически достоверного различия не было (см. табл. 3).
Кроме того, доля пациентов с ПТСД, леченных ЦсА, которым требовалось назначение гипогликемического препарата или комбинированной терапии (инсулин и пероральные сахароснижающие препараты), была меньше по сравнению с долей пациентов, пролеченных Тс [4].
O. Heisel et al. в мета-анализе, оценивавшем распространенность ПТСД после трансплантации сóлидных органов (печень, сердце и легких), выявили более высокие показатели заболеваемости инсулинозависимым сахарным диабетом (ИЗСД) у реципиентов, леченных Тс, по сравнению с ЦсА (11,1 против 6,2%; р<0.003) соответственно. ИЗСД выявили у 9,8% реципиентов трансплантатов почки, леченных Тс, по сравнению с 2,7%, пролеченных ЦсА (р<0,00001) [22]. Тем не менее не все исследования показали, что Тс – более диабетогенный, чем ЦсА, препарат [29]. Предполагается, что эти противоречия частично связаны с разницей в определениях ПТСД, дозе и концентрации ИКН [24, 29].
ГКС. В 1964 г. Starlz впервые описал стимулирующую роль ГКС на ПТСД у реципиентов почки. В настоящее время доказан дозозависимый диабетогенный эффект ГКС [10, 27]. По данным E.P. Tillmann et al., исследовавших 400 пациентов после АТП, из которых 96 (24%) пациентов были на иммуносупрессивной терапии без применения ГКС и 304 (76%) – на терапии с применением преднизолона в дозе 5 мг/сут в сочетании с ЦсА или Тс как частью их иммуносупрессивного протокола, доказано, что применение преднизолона в дозе 5 мг/сут связано с повышением уровня гликированного гемоглобина и развитием НТГ, но не ПТСД [31].
F.L. Luan et al. в ретроспективном анализе базы данных OPTN/SRTR (Organ Procurement Transplant Network/Scientific Registry of Transplant Recipient), состоявшей из >25 тыс. реципиентов почечного трансплантата с января 2004 по декабрь 2006 г., показали, что иммуносупрессия без ГКС (steroid-free-иммуносупрессия) связана со значительным снижением вероятности развития ПТСД по сравнению с иммуносупрессией с применением ГКС. Кумулятивная заболеваемость ПТСД в течение 3 лет после трансплантации составила 12,3% среди тех, кто не получал ГКС (steroid-free-иммуносупрессия), по сравнению с 17,7%, кому проводилась иммуносупрессия с применением ГКС (р<0,001). В целом иммуносупрессия с применением ГКС на момент выписки из стационара была связана с 42%-ным увеличением риска для ПТСД [32–35].
По данным нашего исследования, ГКС применяли все реципиенты почечного трансплантата. При этом важность применения ГКС для результата прогноза развития ПТСД составила 17,4%.
Заключение
Реципиенты почечного трансплантата находятся в группе риска по развитию ПТСД, важная роль в котором отводится возрасту. Пациенты старшего возраста имеют больше шансов на развитие ПТСД, чем более молодые реципиенты на момент трансплантации. Наряду с возрастом применение послеоперационного режима иммунносупрессивной терапии ИКН в сочетании с ГКС в значительной степени повышает риски развития ПТСД. Различия в распространенности ПТСД между иммуносупрессивными режимами с применением ЦсА и Тс могут быть частично объяснены разницей в определениях ПТСД, дозе и концентрации ИКН. Терапия с включением ГКС до сих пор остается спорной, но по данным клинических исследований почечного трансплантата, общепризнанно, что кратковременная «пульс»-терапия и низкие поддерживающие дозы ГКС не только безопасны, но и могут снижать риск ПТСД.

