Введение
В последнее время отмечается четкая тенденция к увеличению частоты встречаемости HELLP-(Н – hemolysis, гемолиз; ЕL – еlеvated liver enzymes, повышение активности ферментов печени; LP – 1оw рlаtelet соunt, тромбоцитопения)-синдрома, а также к описанию новых подтипов тромботических микроангиопатий (ТМА) в акушерской практике в связи с появлением ТМА-настороженности и совершенствованием методов диагностики. В качестве примера объединенного варианта ТМА, взаимосвязанного с персистенцией антифосфолипидных антител (АФА), можно привести выделение микроангиопатического антифосфолипидного синдрома (МАФС). При этом варианте АФС, с одной стороны, возможно развитие катастрофического АФС (КАФС) с высокими показателями летальности, с другой – имеется перекрест с другими вариантами ТМА, в основном с HELLP-синдромом и тромботической тромбоцитопенической пурпурой (ТТП), случаи возникновения которой при высоких титрах АФА также описаны [1–4]. Вовлечение в процесс тромбообразования сосудов микроциркуляторного русла у пациентов с персистенцией АФА позволило говорить о ведущей роли последних в патогенезе МАФС. Термин МАФС, введенный идеологом АФС
R. Asherson в 2006 г. [5], позволяет обсуждать закономерности в развитии отдельного фенотипического «подмножества» АФС, выделить предикторы, описать исходы и разработать тактику ведения. В настоящее время не вызывает сомнений тот факт, что у пациентов с первичным АФС со временем может развиваться системная красная волчанка, а также то, что более 80% пациентов с КАФС до его манифестации уже имеют историю АФС, т.е. все клинические варианты АФС могут переходить друг в друга. Остается открытым вопрос о роли АФА (если таковая имеется) в структуре ТМА: действительно ли именно они патогенны, или являются просто «свидетелем» генерализованной эндотелиальной дисфункции, вызванной активацией с последующим апоптозом эндотелиальных клеток, в результате чего запускается выработка АФА [3]? Имеются убедительные доказательства того, что АФА обладают провоспалительными и протромботическими действиями, первично приводящими к активации системы комплемента и повреждению эндотелиальных клеток [6–8].
Приводим два описания различных МАФС в акушерской практике, оба осложнились развитием HELLP-синдрома до 20-й недели, причем в одном примере следующая беременность завершилась рождением доношенного ребенка, однако даже в этом случае HELLP-синдром все же манифестировал после отмены низкомолекулярных гепаринов (НМГ) за сутки до родоразрешения.
Клинический случай 1
Больная М.Е. 34 лет. В возрасте 16 лет (1998) в связи с развитием острой светобоязни, резкой боли в области орбит была обследована окулистом, данные симптомы расценены как вирусный увеит, назначена местная терапия. В дальнейшем присоединилась лихорадка, достигающая гектических значений, через неделю была диагностирована правосторонняя нижнедолевая пневмония. Пациентка была госпитализирована в стационар по месту жительства, проведена антибактериальная терапия с эффектом. В 1999 г. – повторная двусторонняя пневмония, по поводу которой проведена антибактериальная терапия. В том же году была первая беременность, закончившаяся медикаментозным абортом без особенностей. В 2001 г. начат прием комбинированных оральных контрацептивов – КОК (Силест-норгестимат 0,25 мг+этинилэстрадилол 0,035 мг). На 21-й день от начала приема КОК возник выраженный отек всей левой нижней конечности, госпитализирована в ГКБ № 1 им. Н.И. Пирогова, диагностирован тромбоз левой общей подвздошной вены, проведена гепаринотерапия. Во время госпитализации выявлена пневмония, предположена ТЭЛА (тромбоэмболия легочной артерии), однако уточняющих обследований выполнено не было. После выписки переведена на фениндион 30 мг с достижением целевых значений МНО (международное нормализованное отношение) – 2,0–3,0. По рекомендации терапевта препарат был отменен через 6 месяцев.
В 2002 г. на фоне затухающей острой респираторной вирусной инфекции у пациентки развился окклюзивный тромбоз общей бедренной вены слева, который осложнился ТЭЛА мелких ветвей, подтвержденной с помощью сцинтиграфии (более 3 разрозненных сегментов), назначен варфарин на 4 месяца с последующей полной отменой.
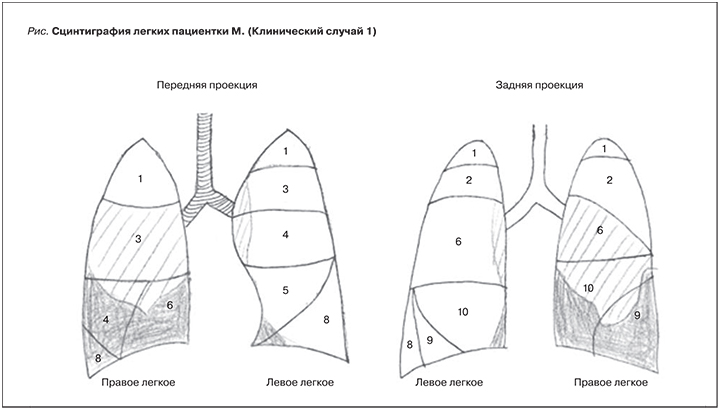
В 2004 г. наступила вторая беременность. На сроке 5 недель диагностирована неразвивающаяся беременность. Было выполнено выскабливание содержимого полости матки. Антикоагулянтная терапия не проводилась. В 2005 г. проведена сцинтиграфия легких, выявившая нарушение перфузии правого легкого по сегментарному типу: поражение суммарно 7 сегментов легких (см. рисунок). С 2005 по 2012 г. пациентка чувствовала себя удовлетворительно, не обследовалась, постоянную антикоагулянтную терапию не получала.
В 2013 г. обследована в связи с планированием беременности, впервые выявлены высокопозитивные уровни антител к кардиолипину ([АКЛ] 96 GPL, 80 MPL) и бета2 гликопротеину1 (анти-бета2-ГП1), положительный волчаночный антикоагулянт (ВА). Также были исследованы полиморфизмы генов тромбофилии, значимых мутаций не зарегистрировано, выявлено носительство среднепопуляционной гетерозиготы PAI I. Заподозрен первичный АФС, назначена НМГ-профилактика (надропарин кальция 0,3), ацетилсалициловая – АСК (100 мг) и фолиевая (5 мг) кислоты на протяжении 2 месяцев в качестве предгравидарной подготовки.
В том же году наступила самопроизвольная беременность, диагностирована дихориальная диамниотическая двойня. Антикоагулянтная терапия, необходимая для ведения такой беременности, не проводилась, исследование АФА не повторялось. На сроке 18–19 недель пациентка в связи с жалобами на боли в верхнем квадранте живота госпитализирована в гастроэнтерологическое отделение стационара по месту жительства с подозрением на острый холецистит. При обследовании: артериальное давление (АД) не превышало 130/80 мм рт.ст., однако выявлены тромбоцитопения (97×109/л), анемия (гемоглобин – Hb 70 г/л), протеинурия (2 г/сут) и цитолиз: аспартатаминотрансфераза (АСТ) 165 ЕД/л, аланинаминотрансфераза (АЛТ) 280 ЕД/л, биллируин 57,7 мкмоль/л. По данным гемостазиологического обследования, значения D-dimer достигали 4200 мкг/л, активированное частичное тромбопластиновое время (АЧТВ) – 26,7 с, протромбиновый индекс (ПТИ) – 121%, фибриноген – 6 г/л. С учетом срока беременности принято решение продолжить динамическое наблюдение, однако уже вечером появились жалобы на головную боль в височных областях, повышение АД до 140/90 мм рт.ст. Пациентка была переведена в реанимацию, начата магнезиальная терапия в сочетании с антигипертензивной без особого эффекта. Появились жалобы на одышку, усилились боли в эпигастрии, АД – 150/100 мм рт.ст., прогрессирование тромбоцитопении до 85×109/л, АСТ – 213, АЛТ – 480 ЕД/л. Диагностирован HELLP-синдром, пациентка была родоразрешена путем малого кесарева сечения. Проведена трансфузия свежезамороженной плазмы в объеме 1800 мл, эритроцитарной массы 1100 мл (уровень лактатдегидрогеназы [ЛДГ] на тот момент не был исследован). После родоразрешения произошел быстрый регресс явлений ТМА: уже на 2-е сутки уровень Hb составил 107 г/л, тромбоциты 110×109/л, АЛТ 27, АСТ 55 ЕД/л, протеинурия отсутствовала. Даже после родоразрешения пациентке с двумя подтвержденными тромбозами глубоких вен (ТГВ) в анамнезе не была назначена антикоагулянтная терапия. На 10-е сутки появились выраженная одышка, акроцианоз, отек правой голени; диагностирован ТГВ правой нижней конечности; проведена компьютерная томография с внутривенным контрастированием, подтвержден рецидив ТЭЛА. Антикоагулянтная терапия в течение 10 дней, дозы не указаны.
В 2014 г. появились выраженная цефалгия давяще-пульсирующего характера, онемение кончика языка, десен и губ менее минуты. Были заподозрены транзиторные ишемические атаки в вертебробазилярном бассейне, госпитализирована, тогда же выявлен флеботромбоз правого подколенно-берцового сегмента. Проведено консервативное лечение НМГ с последующим переводом на прямые ингибиторы тромбина пожизненно. Пациентке назначен ривароксабан 10 мг.
В течение 3 лет (с 2013 по 2016 г.) пациентка регулярно мониторировала АФА, т.к. планировала беременность. В связи с сохраняющимися крайне высокими титрами АКЛ (до 180 GPL и 130 MPL) и анти-бета2-ГП1 (5 норм IgG в сочетании с 3 нормами IgM), положительным ВА трижды проведены процедуры плазмафереза без существенного влияния на титры антител. По данным карт наблюдения, до наступления данной беременности обращала на себя внимание протеинурия до 0,5 г/сут в сочетании с единичными эпизодами повышения АД и снижением скорости клубочковой фильтрации (СКФ) до 68 мл/мин. Это дало нам основание предположить наличие АФС-ассоциированной нефропатии.
В 2016 г. наступила 4-я самопроизвольная беременность. Индекс массы тела на момент наступления беременности составил 16,6 (рост – 170 см, масса тела – 49 кг). На ранних сроках пациентка обратилась в НЦАГиП им. Кулакова. Обследована: несмотря на частые рецидивы ТЭЛА, признаков легочной гипертензии выявлено не было (систолическое давления в легочной артерии – 27 мм рт.ст.), выполнен суточный мониторинг АД – без признаков артериальной гипертензии (АГ), СКФ (Реберга) была незначительно снижена для беременной женщины – 82 мл/мин. Незамедлительно начато введение НМГ в лечебной дозе с достижением терапевтического окна антиХа-активности 0,7–1,2 МЕ/мл (эноксапарин 0,4 дважды в сутки), дополнительно назначен гидроксихлорохин (ГХ) 400 мг/сут, в 12 недель добавлена АСК 100 мг/сут. Начиная с 15-й недели гестации каждые 5–7 недель мониторировались sFlt-1/PLGF. Маркеры преэклампсии (ПЭ) на протяжении всей беременности оставались в пределах референсной нормы для разных сроков гестации, соотношение sFlt-1/PLGF варьировалось от 4,2 на ранних сроках до 38,8 в 34 недели (n=8–80). Титры АФА в течение беременности оставались высокими (АКЛ достигали 60–80 GPL и MPL, анти-бета2-ГП1 – 2 нормы), ВА положителен. Самостоятельно на сроке 18 недель обратилась в другое ЛПУ, где было выполнено 5 процедур плазмафереза, титр АФА после выполнения несколько снизился, АКЛ IgM/IgG=3,0/12,4 ЕД/мл (норма менее 7), анти-бета2-ГП1 IgM/IgG=4,1/12,4 ЕД/мл (норма менее 5), суммарные АФА IgM/IgG=5/17 ЕД/мл. Однако менее чем через месяц уровень АФА «вернулся» к исходным значениям: АКЛ IgM/IgG=17,2/20,8 ЕД/мл (норма менее 7), антитела к анти-бета2-ГП1 IgM/IgG=4,1/12,4 ЕД/мл (норма менее 5). Начиная с 20-й недели каждую неделю мониторировались показатели мочи, раз в 2–4 недели – тромбоциты, ЛДГ, АЛТ, АСТ. Данных за дебют ПЭ ни клинически, ни лабораторно отмечено не было.
При подготовке к плановому родоразрешению на сроке 37 недель беременности за 24 часа была отменена терапия НМГ. Утром пациентка пожаловалась на распирающую боль в подреберье, головную боль. АД составило 140 и 90 мм рт.ст., протеинурия – 0,4 г/л, уровень тромбоцитов снизился до 106 тыс. в мкл, Hb – 118 г/л, ЛДГ – 645,5 ЕД/д, уровень АЛТ составил 30,4 ЕД/л, АЛТ – 48,9 ЕД/л. Был заподозрен дебют HELLP-синдрома. Пациентка экстренно родоразрешена путем кесарева сечения. Родилась живая девочка массой 2230 г, рост – 48 см. Оценка по шкале Апгар – 8 баллов на 1-й минуте, 8 баллов на 5-й. После родоразрешения пациентке была продолжена лечебная антикоагулянтная терапия НМГ в течение 6 недель, затем она была переведена на прямые ингибиторы тромбина (ривароксабан 20 мг/сут) с рекомендацией пожизненного приема.
Клинический случай 2
Больная Б.Н. 42 лет. В 1994 г. диагностирован синдром поликистозных яичников, в течение более 9 лет проводилась гормональная терапия КОК. В 2004 г. проведена резекция правого яичника (апоплексия?), в 2006 г. – левосторонняя тубэктомия по поводу внематочной беременности. С 2008 г. обследуется по поводу бесплодия, предположительная причина – трубный фактор. С 2010 г. неоднократные попытки экстракорпорального оплодотворения (ЭКО), в т.ч. по длинному протоколу общим числом 6, медицинской документации не сохранилось. Ни одна из процедур не завершалась наступлением беременности. В 2011 г. впервые выявлены высокие титры АФА, предложено проведение стимуляции овуляции с использованием НМГ-профилактики, однако беременность не наступила. В 2013 г. консультирована в клинике Германии. Диагностировано ожирение 1-й степени (индекс массы тела – 33 кг/м2), впервые зарегистрирована АГ (при физикальном обследовании АД=135/100 мм рт.ст.). Тогда же выявлена дислипидемия и повышение активности АЛТ до 47 ЕД/л (норма до 35). В выписном эпикризе указано, что все основные показатели биохимического анализа крови, включая уровень мочевой кислоты в сыворотке, показатели почечной функции, обмена железа, а также показатели анализа мочи, находятся в допустимых пределах. Повторно исследованы АФА и гемостаз: выявлено удлинение протромбинового времени до 45 секунд (норма до 38), АЧТВ до 222 секунд (норма до 100), положительный ВА, АКЛ 20 GPL/мл (норма до 10), антитела к бета2-ГП1 33 ЕД/мл (норма до 20). По результатам обследования дано заключение: лабораторные изменения не соответствуют критериям АФС, однако с учетом персистенции АФА рекомендовано во время процедуры ЭКО и в течение всей беременности проводить НМГ-профилактику тромбозов в связи с их повышенным риском, а также присоединение 100 мг АСК ежедневно со II триместра.
В 2014 г. – 2-я беременность после очередной попытки ЭКО, с момента начала стимуляции получала НМГ в неадекватно низкой дозе (эноксапарин – 0,2), АСК не принимала. В 18 недель дебют АГ с единичными эпизодами АД до 170 и 120 мм рт.ст., что трактовалось как хроническая АГ. В 20 недель присоединился выраженный отечный синдром, отметила уменьшение объема мочи, ПУ не исследована. В 21–22 недели появились боли в правом подреберье, трактованные как явление гастрита, в 22–23 недели госпитализирована, зарегистрирована тяжелая тромбоцитопения (18 тыс. в мкл), цитолиз достигал 600 ЕД/л, значений ЛДГ и ПУ не помнит, выписных эпикризов не сохранилось. Родоразрешена, введен тромбоконцентрат. О введении свежезамороженной плазмы и последующем использовании НМГ данных нет.
Далее повторно исследованы АФА, результатов на руках нет, со слов выявлены высокие титры основных АФА. Вне беременности АГ не регистрировалась.
В 2017 г. 3-я беременность, наблюдалась в одной из частных клиник Москвы. С ранних сроков получала НМГ в разных дозах (эноксапарин 0,6–0,8), доза титровалась на основании гемостазиологических параметров. В 14 недель дебютировала АГ до 140–150 и 90–100 мм рт.ст., выявлена тромбоцитопения до 101 тыс. в мкл, цитолиз, достигший 90 ЕД/л. Госпитализирована в НЦАГиП, где при повторном исследовании уровень тромбоцитов по Фонио составил 168 тыс. в мкл., АЛТ – 196 ЕД/л, АСТ – 78 ЕД/л, ЛДГ – 458 (норма менее 418). Исследован уровень ADAMTS 13 (87%) и антител к ADAMTS13, что позволило исключить дебют тромботической тромбоцитопенической пурпуры во II триместре. Впервые исследованы маркеры ПЭ: PLGF – 8,8 пг/мл (n=90–490), sFlt-1 5 – 740 пг/мл (n=730–4400), sFlt-1/PLGF – 652, 27 (n=17–80). Исследованы АФА: АКЛ IgM/IgG=18,2/22,8 ЕД/мл (норма менее 7), анти-бета2-ГП1 IgM/IgG=8,2/19,2 ЕД/мл (норма менее 5). При этом ПУ отсутствовала, функция почек не страдала. Согласно всестороннему обследованию, данных за другие органные поражения получено не было. С учетом срока беременности принято решение о выжидательной тактике, доза НМГ подобрана по антиХ-активности (0,2–0,5 МЕ/мл) и составила 0,8 эноксапарина, к терапии добавлено 150 мг АСК и 400 мг ГХ, подобрана антигипертензивная терапия (метилдопа 2000 мг/сут). Однако в течение последующих 2 недель клинико-лабораторные показатели, характеризующие течение ТМА, носили волнообразный характер: цитолиз спонтанно уменьшался и увеличивался до прежних величин, число тромбоцитов – 148–162 тыс. в мкл, ЛДГ – 422–586 ЕД/л. Через 2 недели присоединилась протеинурия 0,4 г/сут, появились признаки прогрессирования АГ с эпизодами повышения АД до 170 и 100 мм рт.ст, число тромбоцитов снизилось до 98 (в момент прерывания беременности составили 72 тыс. в мкл), в связи с чем принято коллегиальное решение о прерывании беременности. На сроке 17–18 недель беременности произошел поздний индуцированный выкидыш, после завершения которого введено 500 мг преднизолона внутривенно в связи с риском генерализации ТМА вплоть до КАФС.
На следующие сутки показатели крови были с явной положительной динамикой: тромбоциты – 138 тыс., АЛТ – 78 ЕД/л, АСТ – 52, ЛДГ – 513 ЕД/л. Была продолжена пульс-терапия преднизолоном до достижения 1500 мг суммарно. Явления ТМА полностью купированы, выписана в удовлетворительном состоянии с рекомендацией продолжить НМГ-профилактику до 6 недель после родоразрешения.
Обсуждение
Продемонстрированные нами наблюдения подтверждают возможность дебюта HELLP-синдрома до 20-й недели беременности. Общепринятым считается факт, согласно которому ПЭ и HELLP-синдром служат осложнением второй половины беременности. Случаи ПЭ или HELLP-синдрома до 20-й недели гестации встречаются крайне редко, имеются лишь единичные описания «очень ранней ПЭ» при АФС, многоплодной беременности или при тяжелой хромосомной аномалии у плода [9–15]. Самый ранний дебют HELLP-синдрома зарегистрирован в 12 недель [16]. Анализ литературы о случаях «чистой» ПЭ до 20 недель гестации, не связанных с АФС или хромосомными аномалиями плода, показал, что столь ранний дебют наиболее часто сопровождает предшествующую хроническую болезнь почек (ХБП), а признаки АФС-ассоциированной нефропатии были в первом случае [17]. В серии описаний раннего дебюта ПЭ выделены и другие факторы риска: возраст матери более 40 лет, многоплодная беременность, множественные ПЭ и тромботические события в анамнезе [9, 18–22]. При очень раннем дебюте ПЭ беременность прекращается до жизнеспособности ребенка [23]. В литературе имеется описание только 1 случая дебюта ПЭ на 15-й неделе гестации, когда беременность была пролонгирована и завершилась рождением живого ребенка с экстремально низкой массой тела 285 г на сроке 23 недели, ребенок выжил. Матери проведен селективный аферез с удалением sFlt1, при этом признаков ТМА зарегистрировано не было [24]. «Агрессивная» акушерская тактика ведения пациенток с HELLP-синдромом (родоразрешение независимо от сроков беременности) и неоправданный риск консервативной тактики при АФС обусловлены возможным запуском других более грозных форм ТМА, прежде всего КАФС – генерализованной ТМА с поражением 3 и более органов и систем, развивающейся в короткие сроки (от нескольких часов до нескольких дней) [25–28]. HELLP-синдром рассматривается многими авторами как вариант ПЭ, однако есть все основания предполагать обособленность HELLP-синдрома – самостоятельного варианта ТМА, что подтверждает наш первый случай, в котором HELLP-синдром, хоть и III класса, развился после отмены НМГ [29–31, 62]. Известно, что схожие клинические и лабораторные показатели затрудняют дифференциацию различных микроангиопатических синдромов в акушерстве, особенно при развитии признаков HELLP-синдрома во II триместре или после родоразрешения. Ретроспективный анализ G. Hanouna et al. (2013) выявил прогностическую роль HELLP-синдрома при развитии акушерского КАФС [32]. Кроме того, Appenzeller et al. в систематическом обзоре, включившем 29 клинических описаний и серий случаев, объединившем в общей сложности 51 HELLP-синдром у 50 пациентов с AФС за период с 1994 по 2010 г., пришли к выводу, что HELLP-синдром может стать одним из этапов развития КАФС, тогда как при реализации последнего риск материнской смертности крайне высок [33]. Связь развития HELLP-синдрома с персистенцией АФА описана еще в 1994 г. [34]. С того момента появилось огромное количество описаний фенотипически различных HELLP-синдромов у больных АФС, развивающихся, несмотря на комбинированную терапию НМГ и АСК [31, 35]. Разграничение акушерских ТМА при доказанном АФС усложняется возможным наслоением одного процесса на другой: так, ПЭ и HELLP-синдром могут стать триггерами развития КАФС, в то же время у женщин, перенесших ТГВ, во время беременности выше риск развития ПЭ и HELLP-синдрома [36]. Именно поэтому важно выделение субпопуляции МАФС, в которой «вершиной» опасности является КАФС. В связи с крайне высоким риском развития КАФС, для которого характерна 50%-ная летальность, принято решение о прерывании беременности во 2-м случае.
ТМА-настороженность должна присутствовать во всех случаях АФС. Так, по данным разных авторов, частота HELLP-синдрома в группе пациентов с верифицированным критериальным АФС, получавших комбинированную терапию НМГ и АСК, может достигать 10% [37]. Часто цитируемое исследование Backos et al., определившее частоту HELLP-синдрома при АФС 0,66% (ниже популяционной), включало только пациентов с подтвержденным АФС без ТГВ в анамнезе. Возможность развития МАФС у пациентки с уже имеющимся поражением крупных сосудов описана нами в первом случае. Как и, наоборот, при ТМА в 20% случаев развиваются тромбозы крупных сосудов. Такой переход одного варианта в другой может быть объяснен концепцией тромботического шторма, предложенной С. Kitchens в 1998 г., согласно которой заболевания с массивным тромбообразованием развиваются вследствие избыточного ответа на первоначальный протромботический стимул с прогрессирующей ступенчатой активацией образования тромбина и угнетением фибринолиза с потреблением антикоагулянтных факторов [25–27, 38].
Основное внимание мирового сообщества направлено на выделение предикторов и профилактику развития МАФС во время беременности. Интересно, что, по данным некоторых исследователей, сама процедура ЭКО сопряжена с более высоким риском развития HELLP-синдрома. Описан также фатальный HELLP-синдром, приведший к смерти 50-летней женщины, беременность которой наступила после программы ЭКО с использованием донорской яйцеклетки [39–41]. Акушерские и тромботические осложнения у больных АФС при проведении процедур ЭКО значимо сократились почти за 20-летнюю историю использования вспомогательных репродуктивных технологий в этой группе пациенток [42, 43]. Однако вопрос о причинно-следственной связи остается открытым: сама процедура ЭКО запускает продукцию АФА или персистенция АФА приводит к бесплодию [44] Данные о связи бесплодия с персистенцией АФА крайне противоречивы и немногочисленны, серии описаний разрозненны и включают наличие различных АФА в разном титре, в т.ч. не критериальных и не значимых, в связи с чем не могут считаться достоверными [45, 46].
Предикторы течения беременности у пациентов с АФС изучены в исследовании NOH-APS (The Nimes Obstetricians and Hematologists Antiphospholipid Syndrome). Наличие позитивности сразу по нескольким АФА (АКЛ, анти-бета2-ГП1 и ВА), как в наших клинических случаях, связано с наиболее высоким риском и тромботических, и акушерских осложнений во время беременности. Кроме этого доказана прямо пропорциональная зависимость наличия ВА и риска возникновения венозных тромбоэмболических осложнений. Комбинированная терапия НМГ и АСК способствовала снижению частоты ТГВ/ ТЭЛА в период беременности [47]. В другом исследовании, посвященном факторам риска неблагоприятных исходов беременности, PROMISSE (Predictors of Pregnancy Outcome: Biomarkers in Antiphospholipid Antibody Syndrome and Systemic Lupus Erythematosus) доказана роль только ВА, при этом наличие АКЛ и анти-бета2-ГП1 при отрицательном ВА существенно не меняло итогов беременностей [48].
Исследование FRUIT-RCT (Fractionated heparin in women with utero-placental insufficiency and thrombophilia), целью которого была оценка эффективности комбинированного использования НМГ и АСК для профилактики ПЭ/HELLP-синдрома, в т.ч. у больных АФС, прекращено после промежуточного анализа. Промежуточный анализ не продемонстрировал эффективности комбинированной терапии НМГ и АСК по сравнению с монотерапией АСК [49]. В первом случае, учтя неоднократные ТГВ/ТЭЛА в сочетании с верифицированным АФС, мы использовали НМГ в лечебных дозировках согласно рекомендациям ACCP, а также действовали сообразно обзорам и руководствам [50–53]. Сложность в данном случае состояла в том, что все клинические исследования по изучению эффективной стратегии ведения пациентов с акушерским АФС не включали беременных женщин с тромботическими событиями в анамнезе. Наша первая пациентка должна была получать антикоагулянты еще до беременности, а с момента подтверждения беременности в таких ситуациях рекомендуется переход на полные антитромботические дозы НМГ.
Поиск новых методов профилактики неблагоприятных акушерских исходов при АФС привел к возобновлению интереса к ГХ. Пик интереса к препаратам этой группы был зарегистрирован в 1970–1980 гг., когда их изолированное применение для профилактики ТГВ после ортопедических операций доказало антикоагулянтный потенциал [54]. Затем было обнаружено, что ГХ in vitro ингибирует активацию тромбоцитов, вызванную АФА, а также способствует резорбции тромба. Изучение механизма действия ГХ показало, что он имитирует действие специфических ингибиторов IIb/IIIa-рецепторов [55, 56]. В литературе имеются данные об улучшении исходов беременности при добавлении ГХ. Так, ретроспективное исследование S. Sciascia et al. выявило, что добавление ГХ к рутинной терапии АФС увеличивает процент живорожденных до 67% (vs 57% в контрольной группе), а также снижает частоту ПЭ/HELLP-синдрома (47 vs 63%; p=0,004) [57–59]. Базируясь на значимом улучшении акушерских исходов у пациенток с системной красной волчанкой, Европейское общество по ревматологии в 2017 г. полагало, что ГХ может быть рекомендован и при первичном АФС, однако указывает на необходимость дальнейших исследований. Также следует учитывать, что пик действия ГХ наступает спустя 4–6 месяцев от начала использования [60].
В 2017 г. опубликован протокол многоцентрового исследования HYPATIA (HYdroxychloroquine to Improve Pregnancy Outcome in Women with AnTIphospholipid Antibodies), в которое идет набор пациентов [61].
Заключение
Таким образом, данные случаи демонстрируют не только возможность дебюта HELLP-синдрома до 20-й недели беременности – они показывают возможность развития HELLP-синдрома и при нормальном уровне Sflt1/PLGF, что, по-видимому, в очередной раз подтверждает обособленность HELLP-синдрома от ПЭ. В обоих случаях зарегистрирована позитивность по всем трем группам основных АФА, что исходно увеличивало риск возникновения акушерских осложнений во время беременности, несмотря на адекватность лечения. Необходимость выделения МАФС подтверждается опасностью, которую несут все случаи развития признаков ТМА у больных АФС: риск генерализации ТМА вплоть до КАФС неоправданно высок. Только использование НМГ в сочетании с АСК может считаться «золотым» стандартом ведения таких пациенток. Добавление ГХ, возможно, улучшает исходы таких беременностей, что требует подтверждения в крупных многотицентровых исследованиях.

