Список сокращений
- АД – артериальное давление
- АПД – автоматический перитонеальный диализ
- ГД – гемодиализ
- ДР – диализный раствор
- Д/П – отношение содержания веществ в диализате к содержанию в плазме
- ЗПТ – заместительная почечная терапия
- ИБС – ишемическая болезнь сердца
- ИПД – интермиттирующий перитонеальный диализ
- К – диализный клиренс
- ОФП – остаточная функция почек
- ПАПД – постоянный амбулаторный перитонеальный диализ
- ПД – перитонеальный диализ
- ППД – приливной перитонеальный диализ
- ПЦПД – постоянный циклический перитонеальный диализ
- ПЭТ – тест перитонеальной эквилибрации
- ТХПН – терминальная хроническая почечная недостаточность
- УФ – ультрафильтрация
1. Введение
Поскольку глобально число больных хроническим заболеванием почек продолжает увеличиваться, возникает необходимость в рентабельной заместительной почечной терапии (ЗПТ). Во многих странах результаты лечения пациентов, получающих перитонеальный диализ, сравнимы или лучше, чем у пациентов на гемодиализе, а перитонеальный диализ в то же время более эффективен с точки зрения затрат, стоимость лечения перитонеальным диализом (ПД) ниже в 1,25–2,35 раза [1]. ПД в отличие от других методов ЗПТ позволяет обеспечивать наибольшую транспортно-географическую независимость пациента, снижение затрат на сопутствующую лекарственную терапию, улучшение результатов после трансплантации почки, а в случае с автоматическим перитонеальным диализом (АПД) – наибольшую социальную адаптацию и возможность сохранения работоспособности. Однако эти преимущества не всегда приводят к увеличению использования ПД.
Использование этой терапии растет в некоторых странах, включая Китай, США и Таиланд, но пропорционально уменьшается в Западной Европе и в Японии. Переменные тенденции в использовании ПД отражают многочисленные проблемы при назначении этой терапии пациентам. Ключевые стратегии для облегчения использования ПД включают реализацию политики и стимулов, которые способствуют развитию этого метода, поставку диализных растворов для ПД с низкой стоимостью и соответствующую подготовку нефрологов, чтобы обеспечить более широкое использование терапии. Дальнейший рост использования ПД необходим, чтобы эта модальность стала неотъемлемой частью программ ЗПТ. Доля ПД от общего числа пациентов на диализе составляет: в США более 10%, в Европе – в среднем 11,7%, в Японии – всего 2,6%. С другой стороны, в Гонконге процент пациентов, получающих лечение ПД, равен 71,8%, в Мексике – 45%, в Новой Зеландии – 32,2%, в Таиланде – 25%. В Москве программа по использованию ПД больными терминальной ХПН стартовала в 1995 г., затем этот метод стал использоваться и в других городах России.
Необходимо отметить, что ПД обладает рядом преимуществ по сравнению со стандартным программным ГД. ПД является домашним видом диализа, при нем значительно дольше сохраняется остаточная функция почек, имеются определенные преимущества этого метода для реципиентов трансплантированной почки в аспекте как более гладкого ближайшего послеоперационного периода, так и отдаленных результатов трансплантации. Выживаемость больных, получающих ПД, не уступает таковой пациентов на ГД.
Организация перитонеального диализа в нефрологическом центре
Необходимо, чтобы была создана специализированная команда медсестер ПД и назначен врач по ПД (нормативы и рекомендованные штаты определены Порядком оказания нефрологической помощи [2]). Все оборудование и диализные растворы, используемые для терапии ПД, должны отвечать соответствующим стандартам для медицинских препаратов и устройств. Ускоренное обучение и экстренная установка катетера для проведения ПД при остром начале ПД должны быть доступными и предлагаться соответствующим пациентам, которые хотят избежать временного ГД.
Перитонеальный диализ является методом первого выбора в лечении терминальной ХПН ввиду более длительного сохранения остаточной функции почек по сравнению с ГД.
Показания к выбору метода перитонеального диализа у пациентов с ХБП 5 стадии [3, 4]:
2. Показания к применению ПД в отношении пациентов с терминальной ХПН
2.1. Пациенты молодого возраста – кандидаты на трансплантацию почки.
2.2. Невозможность создания сосудистого доступа.
2.3. Большие колебания массы тела в междиализный промежуток при ГД.
2.4. Тяжелая гипертензия.
2.5. Выраженная анемия.
2.6. Дети (особенно 0–5 лет).
2.7. Неустойчивая гемодинамика и гипотензия.
2.8. Заболевания и состояния, которые могут влиять на возможность транспортировки пациентов в диализный центр.
2.9. Осознанный выбор больного.
3. Противопоказания
Абсолютные противопоказания:
- Активные воспалительные заболевания органов брюшной полости.
- Распространенные злокачественные онкологические заболевания брюшной полости.
- Выраженный спаечный процесс в брюшной полости.
- Врожденные (аномалии развития) или приобретенные анатомические дефекты передней брюшной стенки и/или брюшной полости и диафрагмы.
- Тяжелые хронические обструктивные легочные заболевания (III или IV стадия ХОБЛ).
Относительные противопоказания к проведению ПД:
- Заболевания позвоночника с выпадением дисков.
- Инфекции брюшной стенки или кожи.
- Выраженное ожирение и большая масса тела.
- Тяжелое нарушение питания.
- Абдоминальные грыжи (больные должны быть прооперированы до начала проведения ПД).
- Прогрессирующие неврологические заболевания.
- Снижение или отсутствие зрения.
- Расстройства движения и тяжелые артриты.
- Дивертикулез кишечника.
- Наличие цистостомы, нефростомы и т.п. из-за высокого риска возникновения грамотрицательного перитонита.
- Тяжелые социальные условия и психологические проблемы.
- Алкоголизм и наркомания.
- Массивная цитостатическая и/или глюкокортикоидная терапия.
Перитонеальный диализ необходимо проводить в контексте интегрального подхода к ЗПТ, включая ГД, трансплантацию и консервативное лечение. При этом для отдельных категорий пациентов ПД должен рассматриваться в качестве метода первого выбора ЗПТ. Поэтому в Нефрологическом центре должны быть доступны как постоянный амбулаторный перитонеальный диализ (ПАПД), так и автоматизированный перитонеальный диализ (АПД) во всех его формах.
4. Начало лечения методом перитонеального диализа
1. Принятие решения о начале диализного лечения пациента с хронической болезнью почек (ХБП) должно основываться на клинических и лабораторных данных, при этом время начала диализа должно для каждого больного определяться индивидуально с учетом всей совокупности этих данных. Диализ должен быть начат при наличии одного из перечисленных и тем более при сочетании следующих симптомов, выявленных при снижении остаточной функции почек:
Признаки уремической интоксикации: серозит, нарушения кислотно-основного (ацидоз) и электролитного баланса, кожный зуд; невозможность консервативными методами контролировать статус гидратации и/или артериальное давление; прогрессивное снижение статуса питания, рефрактерного к диетическому вмешательству.
2. Такие симптомы часто, хотя не во всех случаях, наблюдаются при снижении скорости клубочковой фильтрации (СКФ) до 5–10 мл/мин/1,73 м2. Пациентам, страдающим сахарным диабетом, может потребоваться более раннее начало диализного лечения.
3. Начало диализного лечения при уровне СКФ ниже 5 мл/мин/1,73 м2 может быть отложено в исключительных случаях. Например, когда преимущества отложенного начала лечения представляются очевидными для пациентов с отсутствием клинической симптоматики уремии на период полного заживления послеоперационной раны после имплантации ПД-катетера, а также для пациентов в стабильном состоянии в отсутствие выраженной симптоматики уремии, при условии соблюдения пациентом жесткой диеты и наличии возможности проводить весь комплекс соответствующей консервативной медикаментозной терапии под наблюдением врача-нефролога.
4. Для оценки СКФ рекомендуется применять формулу на основе показателя сывороточного креатинина CKD-EPI [5] (табл. 1). Результаты не требуют приведения к стандартной площади поверхности тела.

5. Виды перитонеального диализа
Выбор варианта перитонеального диализа: ПАПД или АПД определяется клинической и социальной ситуацией.
Автоматический ПД осуществляется с помощью циклеров, которые обеспечивают введение и выведение ДР без участия пациента. В современных циклерах предусмотрена возможность контроля и расчета ультрафильтрации, что позволяет выбирать ДР с нужной концентрацией осмотического агента. Кроме того, в циклерах предусмотрена система получения информации о лечении пациента в домашних условиях путем передачи информации о параметрах терапии через модем в компьютерный центр диализного отделения.
Это дает возможность медицинскому персоналу удаленно отслеживать ход диализа и своевременно корректировать программу лечения. Загрузка, хранение и автоматический анализ клинических параметров уменьшают необходимость в ручном вводе данных и связанный с ним риск ошибок. Возможность автоматически анализировать данные лечения облегчает их интерпретацию и ускоряет процесс принятия решений, требующих быстрого врачебного вмешательства; и имеется возможность изменения программы лечения на расстоянии, для чего необходимые коррективы вносятся в электронную дискету.
Виды автоматического перитонеального диализа:
- интермиттирующий (ИПД),
- приливной (ППД),
- постоянный циклический (ПЦПД).
Показания и противопоказания к проведению АПД такие же, как и для ПАПД. Этот метод лечения может успешно использоваться в лечении больных терминальной ХПН.
АПД рекомендован:
- при лечении детей, позволяя использовать малые объемы ДР, освобождая от дневных обменов ДР, обеспечивая возможность учебы и высвобождая близких;
- пациентам с непрерывным графиком работы рекомендуется применение ночного ИПД;
- АПД благоприятнее для пожилых больных, лиц с нарушением координации движений, сниженным или отсутствием зрения;
- больным с высоким риском утечки диализата в подкожную клетчатку, развития абдоминальных грыж (меньшие внутрибрюшное давление);
- пациентам, имеющим брюшину с высокими транспортными свойствами (особенно без остаточной функции почек), не позволяющими добиваться эуволемии;
- использование ППД может использоваться больными, имеющими трудности с дренажем диализата; больными с болями, возникающими во время заливки и слива диализата.
6. Расходные материалы, растворы и аппаратура для проведения перитонеального диализа
Катетеры для хронического ПД предназначены для долговременного использования. Существуют различные модификации перитонеальных катетеров (прямые, с завитком, изогнутые в виде «лебединой шеи» и т.д). Для долговременного ПД чаще используются т.н. двухманжеточные ПД-катетеры (одна манжета – для фиксации катетера к брюшине и апоневрозу, вторая – для фиксации в подкожном тоннеле). Убедительных данных о преимуществах какого-либо типа ПД-катетера до настоящего времени не получено. Считается, что несколько более безопасны (с точки зрения развития тоннельной инфекции) двухманжеточные ПД-катетеры. Стандарт внутреннего и внешнего диаметров катетеров единый и совместим с соединительными системами любого производителя.
Соединительные системы: адаптеры ПД-катетера (металлические или пластиковые), соединительные переходные трубки, удлинители ПД-катетера (в соответствии с инструкцией производителя, как правило, 1 раз в 6–12 месяцев требуют замены) предназначены для соединения магистралей пластикового контейнера с ДР с перитонеальным катетером. Для АПД используются специальные одноразовые системы подающих магистралей – пластиковых трубок, присоединяемых к контейнерам с ДР (дизайн и конструкция зависят от производителя циклера), удлинительные магистрали и дренажные наборы. При проведении ПАПД предпочтительно использование двух контейнерных неразъединяемых систем, которые состоят из пластикового контейнера с ДР и дренажного контейнера, соединенных Y-образной магистралью с системой для переключения потока ДР (введение-дренирование из брюшной полости).
Растворы для перитонеального диализа выпускаются в прозрачных полимерных пакетах. Для взрослых пациентов доступны растворы объемом 2,0, 2,5–3,0 литра для ПАПД и 5,0 литра для АПД в России. Состав раствора для ПД включает стерильную воду, электролиты (натрий, магний, кальций, хлор), буфер (лактат или бикарбонат), осмотический агент (мономер или полимер глюкозы, аминокислоты). Концентрации электролитов в растворах у разных производителей мало различаются [3]. В настоящее время существуют три стандартных состава раствора для ПД, отличающихся по содержанию осмотически активного вещества: 1,36; 2,27; 3,86% глюкозы (табл.2). У некоторых производителей на маркировке промышленных растворов в качестве осмотического агента обозначается декстроза в концентрации 1,5; 2,5, и 4,25%. Растворы для ПД перед введением в брюшную полость целесообразно подогревать до температуры 36,5–37,00 С. Категорически запрещено применять для нагревания ДР микроволновые печи, погружение контейнеров с растворами в воду, масляные радиаторы и т.п. В отсутствие нагревателя рекомендуется введение в брюшную полость растворов комнатной температуры.
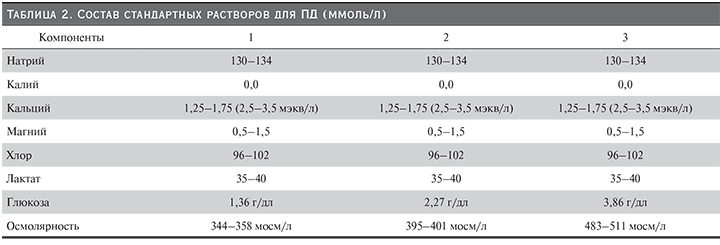
Стандартные растворы для ПД (осмотический агент – глюкоза, буфер – лактат) имеют кислую среду (рН~5,4–5,5) вследствие технологических особенностей тепловой стерилизации. При использовании таких растворов рН в брюшной полости повышается за счет поступления бикарбоната из крови пациентов.
Безглюкозные растворы для ПД с длинноцепочечным полимером глюкозы – 7,5%-ным икодекстрином. Действие этого ДР обусловлено осмотическим давлением, обеспечивающим ток жидкости через брюшину за счет концентрации крупных молекул икодекстрина, который медленно всасывается через лимфатическую систему и обеспечивает ультрафильтрацию до 16 часов.
Применяется в первую очередь для увеличения и поддержания достаточной УФ, особенно у больных с высокими транспортными характеристиками брюшины или с дефицитом УФ IV типа (истощение системы аквапоринового транспорта и неоангиогенез брюшины) [6, 7]. Корректирует водный баланс, уменьшает отеки. Используется 1 раз в сутки для длинной заливки.
Раствор для ПД с 1,1% аминокислот не содержит глюкозу и продукты деградации глюкозы. Аминокислотный осмотический агент обеспечивает ультрафильтрацию и клиренс низкомолекулярных растворенных веществ, сопоставимые с использованием раствора глюкозы с концентрацией 1,36%. Замена одного диализного обмена с использованием раствора глюкозы 1,36% на раствор с аминокислотами снижает всасывание глюкозы в кровоток на 7,8 кг в год и уменьшает глюкозную нагрузку на брюшину на 9,9 кг в год [8].
При введении в клиническую практику позиционировался для использования больными выраженной БЭН (нутриционная поддержка за счет абсорбции аминокислот из ДР). Однако такой эффект не подтвердился при проведении ряда клинических исследований [6]. ДР с аминокислотами показан к введениям 1 раз в сутки с относительно короткой экспозицией в брюшной полости (4–6-часовой обмен). Более частое использование такого раствора ассоциируется с риском развития метаболического ацидоза.
Растворы для ПД с икодекстрином и аминокислотами в настоящее время предлагаются к использованию в сочетании с глюкозосодержащими ДР для снижения т.н. глюкозной нагрузки за счет уменьшения абсорбции глюкозы. Целью такой стратегии служит уменьшение негативного локального и системного действия продуктов деградации глюкозы (ПДГ), образующихся вследствие ее значительной абсорбции из ДР через перитонеальную мембрану. При этом системное действие предполагает положительный метаболический эффект, который проявляется в т.ч. и меньшим нарушением липидного спектра у пациентов ПД. Результативность такой стратегии для пациентов с СД была убедительно продемонстрирована практически сразу с внедрением икодекстрина в клиническую практику ПД [9, 10] и подтверждена в специальном рандомизированном контролируемом исследовании [11].
В последние годы в клинической практике ПД активно используются диализирующие растворы, в которых достигается физиологический рН за счет бикарбонатного буфера (как в чистом виде, так и в смеси с лактатом), это отчасти решает проблему повышения биосовместимости ДР, однако такие ДР содержат в качестве осмотического агента глюкозу, и они имеют высокую осмолярность. Перспективным следует считать и использование глюкозосодержащих растворов, в которых за счет изменения технологии стерилизации значительно снижена концентрация ПДГ. В настоящее время в клинической практике доступны диализирующие растворы с низким содержанием ПДГ и бикарбонатным буфером. В некоторых исследованиях показано менее выраженное локальное повреждающее действие этих растворов на перитонеальную мембрану [12, 13] и сохранение остаточной функции почек, если они используются в течение 12 месяцев или более.
7. Имплантация катетера для перитонеального диализа
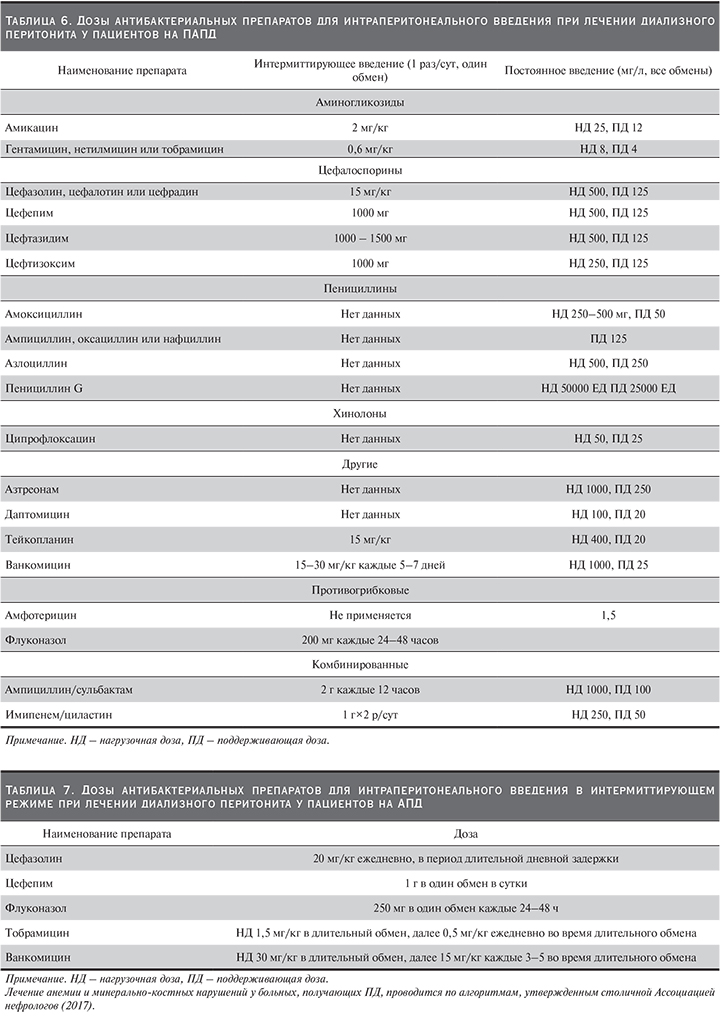
Имплантация катетера для перитонеального диализа должна осуществляться квалифицированным хирургом в стерильных условиях в операционной. Перед имплантацией необходим тщательный физикальный осмотр пациента, особенно передней брюшной стенки – наличие грыж, послеоперационных рубцов, определение места выхода катетера (МВК). Имплантация катетера в тех случаях, когда это возможно, целесообразна как минимум за 2 недели до начала ПД [14]. Необходимо проводить профилактическое пред- или интраоперационное введение антибиотиков. Препаратор выбора – цефалоспорины. Послеоперационное ведение заключается в асептическом уходе за местом выхода катетера до заживления раны. Повязка накладывается с целью иммобилизации катетера для профилактики травмы и кровотечения из места выхода. Во время раннего послеоперационного периода и после заживления место выхода катетера должно содержаться сухим. Не следует применять окклюзионные повязки. Повязки, если они применяются после полного заживления послеоперационной раны, следует менять ежедневно. Для профилактики инфекции МВК в ближайшем послеоперационном рекомендуется применение мази с мупироцином или гентамицином.
Каждый диализный центр (отделение) должен анализировать длительность функционирования ПД-катетеров, частоту осложнений, связанных с катетерами: целевое значение «выживаемости» катетеров >80%, удовлетворительно работающих к концу 1-го года после имплантации.
Катетеры для ПД могут быть имплантированы различными способами, выбор зависит от клинических особенностей больного, принятой практики клиники и опыта хирурга.
Минилапаротомия. Осуществляется путем мини-разреза брюшины и «слепого» проведения катетера в полость малого таза на специальном проводнике. Преимущества: минимальная травма, местная анестезия. Недостатки: отсутствие достаточной визуализации и, соответственно, невозможность ревизии и корректирующего вмешательства (разделение спаек, резекция сальника, фиксация дистального конца катетера в полости малого таза, повреждение внутренних органов).
Лапаротомия. Преимущества: низкий риск перфорации полых органов брюшной полости, достаточная визуализация, возможность ревизии и корректирующих вмешательств, фиксации катетера в полости малого таза. Недостатки: спинальная анестезия, больший разрез, выше риск подтекания ДР при начале ПД в ранние сроки.
Лапароскопия. При помощи мини-троакара с использованием перитонеоскопии (лапароскопчески). Преимущества: хорошая визуализация, возможность ревизии и корректирующих вмешательств, фиксации катетера в полости малого таза. Недостатки: высокая стоимость оборудования, необходимость специальной подготовки хирурга в перитонеоскопии, наркоз, пневмоперитонеум, большая длительность вмешательства.
8. Количественные характеристики эффективности лечения
- К критериям эффективности ПД относятся недельный КТ/V мочевины и суммарный недельный клиренс креатинина.
- Доза диализа должна выражаться коэффициентом очищения KT/V по мочевине. Об удалении мочевины судят по общему недельному КТ/V, равному ренальному и перитонеальному клиренсу мочевины за неделю.
Перитонеальный КТ/V=перитонеальный К (клиренс за 24 ч в литрах)=(объем дренируемого ДР за 24 ч×конц. мочевины)×7(число дней в нед.)/V конц. мочевины в плазме.
Клиренс мочевины нормализуется по отношению к общему объему воды в теле пациента. Предложены следующие формулы для оценки объема жидкости в организме человека.
Формула Watson:
мужчины: V(л)=2,447+0,3362×M+0,1074×H –0,09516×А
женщины: V(л)=-2,097+0,2466×M+0,1074×H–0,09516×А
Формула Hume:
мужчины: V(л)= -14,012934+0,296785×M+0,192786×H
женщины: V(л)= -35,270121+0,183809×M+0,3444547×H,
где M – масса тела (кг), Н – рост(см), А – возраст (число лет).
Уровень КТ/V должен быть не менее 1,7 у больных анурией при ультрафильтрации ≥1 л/сут, клиренс креатинина должен быть не менее 50 л/нед/1,73 м2 .
Режим непрерывного 24-часового ПД предпочтительнее прерывистого режима для пациентов с анурией.
У больных на АПД индекс КТ/V должен быть идентичным с больными, получающими ПАПД не менее 1,7, а клиренс креатинина должен быть не менее 50 л/нед/1,73 м2
Для оценки транспортных характеристик брюшины используется изучение отношения концентрации вещества, обменивающихся при помощи конвекционного потока, в диализате к концентрации его в плазме – перитонеальном эквилибрационном тесте (ПЭТ). Определение в ДР содержания глюкозы, креатинина, мочевины, К и Na производят сразу после введения ДР в брюшную полость (проба 0), через 2 и 4 часа (проба 2 и 4). Плазму забирают через 2 часа от начала процедуры и определяют в ней концентрацию креатинина, мочевины, К, Na . Транспорт глюкозы рассчитывают как фракционное ее исчезновение (абсорбцию) из ДР (D4/D2; D4/D0), а креатинина, мочевины и электролитов – по нарастанию соотношения между концентрацией каждого вещества в ДР и плазме (D0/Р; D2/Р; D4/Р).
По результатам ПЭТ-теста выделяют 4 категории транспортеров:
А. по уровню D/P по креатинину:
- низкие – 0,65–0,50,
- очень низкие – 0,5–0,34,
- высокие – 0,65–0,81,
- очень высокие транспортеры – 0,81–1,03.
В. по уровню D/P по глюкозе:
- низкие – 0,49–0,61,
- очень низкие – 0,38–0,49,
- высокие – 0,26–0,38,
- очень высокие транспортеры – 0,26–0,12.
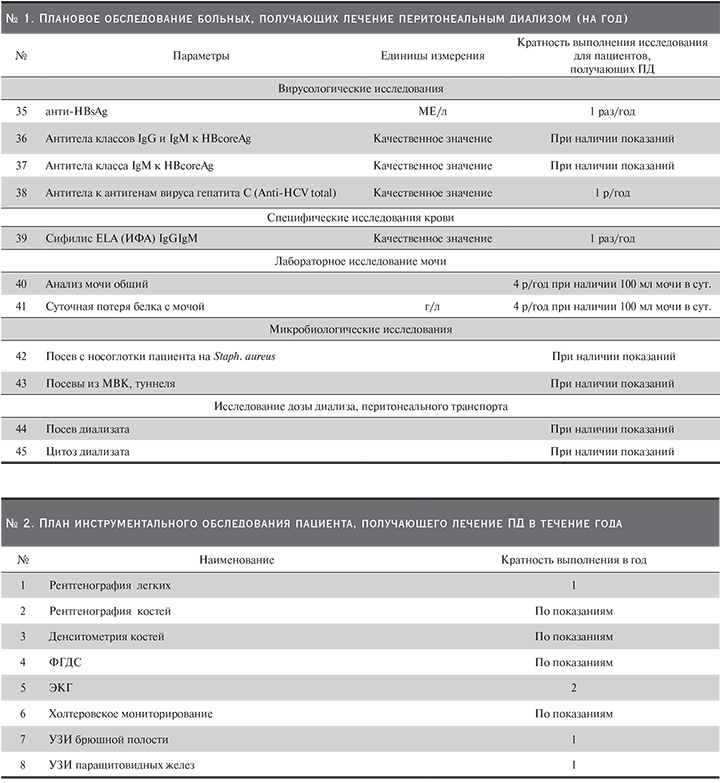
Функции перитонеальной мембраны необходимо контролировать (через 4–6 недель после начала лечения и по крайней мере ежегодно или при наличии клинических показаний) с помощью теста перитонеального равновесия (ПЭТ, Приложение № 3) или других функциональных тестов (модифицированный ПЭТ-тест, мини-ПЭТ APEX). Суточные объемы мочи и перитонеальной ультрафильтрации должны контролироваться не менее 1 раза в 6 месяцев.
Нарушение ультрафильтрационной способности перитонеальной мембраны диагностируется при дренировании объема менее 2100 мл после 4-часовой экспозиции 2,27%-ного раствора глюкозы или менее 2400 мл при использовании 3,86%-ного раствора глюкозы соответственно (руководство ISPD Международного общества перитонеального диализа) [15].
При оценке эффективности ПД у пациентов с остаточной функцией почек должна учитываться величина СКФ. Для учета остаточной функции почек у пациентов на ПД при оценке суммарной дозы очищения необходимо проводить ее лабораторное определение со сбором мочи за сутки и исследованием клиренсов мочевины и креатинина (по формуле):
Формула для расчета СКФ:
(остаточный клиренс Ur+остаточный клиренс Cr),
остаточный клиренс Ur=(конц. Ur в моче/уровень Ur в сыворотке)×объем мочи в mL/1440,
остаточный клиренс Cr=(конц. Сr в моче/уровень Сr в сыворотке)×объем мочи в mL/1440,
где Ur – концентрация мочевины; Cr – концентрация креатинина.
Основные требования к определению показателей адекватности:
Определение мочевины и креатинина должно проводиться в отношении больных, находящихся в стабильном состоянии.
Исследование ДР для определения креатинина и мочевины должно проводиться не ранее чем через 1 месяц после перитонита.
Забор эффлюента для исследования креатинина и мочевины не производится при сбоях во время проведения процедуры АПД.
Эффлюент для исследования креатинина и мочевины берется из контейнера, при этом его содержимое хорошо перемешивается и взвешивается.
Мочу необходимо собирать за сутки, а при малом ее количестве время сбора должно быть увеличено до 48 часов.
Диализный режим, приводящий к рутинному использованию гипертонических (3,86% глюкозы), должен был сведен к минимуму. При необходимости это должно быть достигнуто использованием икодекстрина или диуретиков. Стратегии лечения, способствующие сохранению почечной функции или объема, должны быть приняты, когда это возможно. К ним относятся использование ACEi, ARB (только для взрослых) и диуретики, а также предотвращение эпизодов обезвоживания. Пациенты без остаточной функции почек, которые были гипергидратированы и последовательно получали ежедневную ультрафильтрацию менее 750 мл для взрослых, должны тщательно контролироваться. Эти пациенты могут воспользоваться рецептурными изменениями и/или переключателем модальности.
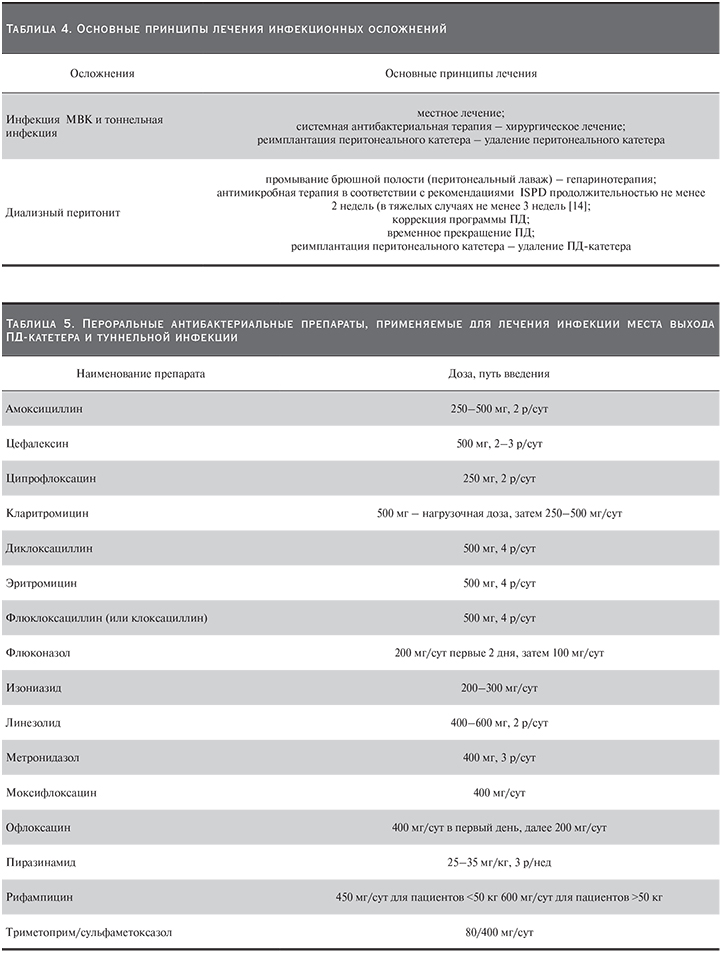
9. Инфекционные осложнения перитонеального диализа [16, 17]
Диализный перитонит (ДП) – воспалительное заболевание брюшины у пациентов, получающих ПД, не обусловленное деструкцией органов брюшной полости и развивающееся вследствие микробной контаминации брюшной полости или воздействия других раздражающих факторов. ДП в подавляющем большинстве случаев лечится консервативно. Основной путь ведения антибактериальных препаратов – интраперитонеальный (в ДР).
Инфекция места выхода ПД-катетера – воспаление кожи и подкожной клетчатки, распространяющееся до манжеты, расположенной в подкожном тоннеле. Инфекция МВК лечится консервативно.
Тоннельная инфекция ПД-катетера – воспаление кожи и подкожной клетчатки, распространяющееся после манжеты, расположенной в подкожном тоннеле, с вовлечением манжеты в воспалительный процесс. Тоннельная инфекция может быть причиной развития ДП и в большинстве случаев лечится оперативно.
Нефрологическим отделениям по ПД необходимо проводить регулярный аудит показателей перитонита и инфекций, включая возбудителей, лечение и исходы. Они должны вступить в активный диалог со своим отделением микробиологии и командой инфекционного контроля для разработки оптимальных местных протоколов лечения и профилактики.
Каждый диализный центр (отделение) должен оценивать частоту ДП в популяции пациентов ПД. Частота перитонитов не должна превышать 1 эпизода/18 пациенто-месяцев лечения (риск – 0,67 в год) [16].
С целью профилактики инфекционных осложнений ПД следует осуществлять регулярный мониторинг обучения пациента процедуре ПД, соблюдать правила ухода за ПД-катетером, санировать имеющиеся очаги инфекции.
Инвазивные процедуры должны сопровождаться профилактикой антибиотиками и опорожнением брюшной полости от диализата в течение периода времени, необходимого для процедуры.
Местная терапия антибиотиками может быть использована для уменьшения частоты инфекции выходного отверстия катетера и перитонита.
Начальные схемы лечения перитонита должны включать покрытие для бактериальных грамположительных и грамотрицательных организмов, включая представителей Pseudomonas, до получения культуры и чувствительности к антибиотикам.
Пути инфицирования полости брюшины при диализных перитонитах представлены в табл. 3.

Классификация диализных перитонитов
Возвратный – эпизод, возникший в пределах 4 недель после прекращения терапии предыдущего эпизода, но вызванный другим микроорганизмом.
Рецидивирующий – эпизод, возникший в пределах 4 недель после прекращения терапии предыдущего эпизода, вызванный тем же микроорганизмом (или при отрицательных результатах микробиологического исследования).
Повторный – эпизод, возникший более чем через 4 недели после прекращения терапии предыдущего эпизода, вызванный тем же микроорганизмом.
Рефрактерный – отсутствие положительной динамики (отсутствие просветления диализата) в течение 5 дней антибактериальной терапии.
Катетер-ассоциированный – перитонит, протекающий одновременно с инфекцией МВК или туннельной инфекцией, вызванный тем же возбудителем (или при отрицательных результатах микробиологического исследования).
Диагностика диализного перитонита
Должна основываться на присутствии не менее двух из следующих признаков:
- Симптомы воспаления брюшины (боль в животе, болезненность живота при пальпации, положительные симптомы раздражения брюшины).
- Мутная перитонеальная жидкость с повышенным цитозом (более 100 клеток в 1 мкл) с преимущественным (более 50%) содержанием нейтрофилов.
- Обнаружение бактерий в перитонеальной жидкости при исследовании в мазке или при микробиологическом исследовании.
Принципы лечения инфекционных осложнений представлены в табл. 4.
Приложения
Больной должен осматриваться не реже 1 раза в 2 месяца врачом-нефрологом с записью в амбулаторной карте пациента.
№ 3. Тест перитонеальной эквилибрации (ПЭТ)
Классический ПЭТ проводят утром, используя 2000 мл 2,27%-ного диализирующого раствора. Пациент приходит в клинику, не сливая ночной диализат. В клинике пациенту проводят обмен перитонеальной жидкости: слив ночного диализата и залив 2000 мл 2,27% диализирующего раствора. Сразу после завершения процедуры пациенту в положении лежа предлагают несколько раз перевернуться с боку на бок и сливают небольшой образец диализата (0 проба). Через 2 часа берется новый образец диализата, а также образец крови (проба 2). Через 4 часа берется новый образец диализата (проба 4). Во всех образцах определяются мочевина, креатинин и глюкоза.
Результатом ПЭТ является определение отношения концентрации креатинина диализата к плазме (D/Pcrea) или отношение концентрации глюкозы (D/Pglucose) [18].



