Введение
Высокая распространенность и серьезное медико-социальное значение определяют глобальность проблемы хронической болезни почек (ХБП). По данным M. Naghavi et al. (2013), ХБП напрямую стала причиной 956 тыс. смертей во всем мире и заняла 13-е место среди всех причин смерти [1]. Важная роль ХБП в смертности от сердечно-сосудистых заболеваний (ССЗ) признается всеми исследователями [2, 3]. К наиболее распространенным осложнениям ХБП относятся ССЗ, они регистрируются еще на преддиализной стадии, а на этапе терапии программным гемодиализом создают определенное бремя для клиницистов [4–6]. Данное обстоятельство диктует необходимость выявления и коррекции сердечно-сосудистых нарушений на ранней стадии ХБП в надежде на предупреждение смертности от них в будущем. В связи с этим следует отметить малочисленность исследований, посвященных изучению половых различий в сердечно-сосудистой заболеваемости и их влиянию на прогноз у больных ХБП.
Целью нашего исследования стала оценка сердечно-сосудистых нарушений и цитокинового статуса, их взаимосвязь со скоростью клубочковой фильтрации (СКФ) у мужчин и женщин на преддиализной стадии ХБП.
Материал и методы
В ходе проведенного исследования были обследованы 170 больных в возрасте от 19 до 86 лет, страдавших ХБП с высоким и очень высоким (дополнительным) сердечно-сосудистым риском. Средний возраст обследованных больных составил 56,2±13,9 года. Исследование одобрено этическим комитетом КГМА им. И.К. Ахунбаева (Бишкек) и получено информированное согласие больных на исследование. ХБП диагностировали согласно рекомендациям Научного общества нефрологов России (2012) [6]. СКФ рассчитывали, используя методику F.J. Hoek et al., предложенную в 2003 г. (СКФ=80,35/цистатин С-4,32) [7]. Все обследованные больные (n=170) были подразделены на две группы: женщины (n=77) и мужчины (n=93). Критериями включения в исследование служили наличие у пациентов диагноза ХБП и их информированное согласие. В исследование не были включены пациенты с врожденными и приобретенными пороками сердца, циррозом печени и 5Д стадией ХБП, а также принимавшие высокие дозы глюкокортикоидов, страдавшие лихорадкой, тиреотоксикозом, паранеопластическими процессами, и беременные женщины. Измерение артериального давления (АД), роста (см), массы тела (кг) и расчет индекса массы тела (ИМТ, кг/м2) проводили по общепринятой методике.
Всем больным определили уровень общего холестерина (ОХС), мочевой кислоты, С-реактивного белка (СРБ), калия, кальция, натрия, цистатина С и креатинина сыворотки крови. Кроме того, исследовали содержание интерлейкина-6 (ИЛ-6) (пг/мл) и ИЛ-10 в сыворотке крови методом твердофазного иммуноферментного анализа с использованием набора реагентов ЗАО «Вектор-Бест» (Новосибирск, Россия). Учет результатов исследования осуществлен на сканере ChroMate Microplate Reader (США, 2015).
Для выявления признаков поражения сердечно-сосудистой системы проводили эхокардиографическое (ЭхоКГ) исследование на аппарате «Vivid q» (США, 2014) и регистрацию центрального (систолического) АД с помощью прибора «АнгиоСкан», Россия) [8]. Протокол ЭхоКГ исследования включал измерение диаметра выносящего отдела аорты, линейного размера левого предсердия (ЛП, см), конечного систолического размера (КСР, см), конечного систолического объема (КСО, мл), конечного диастолического размера (КДР, см), конечного диастолического объема (КДО, мл), фракции выброса (ФВ, %) левого желудочка (ЛЖ) и ударного объема ЛЖ (мл). Оценивали толщину межжелудочковой перегородки (ТМЖП, см) и задней стенки ЛЖ (ТЗСЛЖ, см). ФВ ЛЖ определялась по способу Simpson, а массу миокарда ЛЖ (ММЛЖ, г) рассчитывали по методике R.B. Devereux et al. [9, 10]: ММЛЖ=0,8-{1,04-(КДР+МЖП+ЗСЛЖ)3-КДР3}+0,6. Для оценки гипертрофии ЛЖ (ГЛЖ) рассчитывали индекс массы миокарда ЛЖ (ИММЛЖ, г/м2) [11]. За ГЛЖ принимали величины ИММЛЖ 95 г/м2 и более для женщин, 115 г/м2 и более – для мужчин. Индекс относительной толщины стенки (ОТС) ЛЖ рассчитывали по формуле: 2Н/D=(МЖПд+ЗСЛЖд)/КДР. В зависимости от показателя ИММЛЖ и величины ОТС ЛЖ были выделены следующие варианты изменения геометрии ЛЖ [11]: нормальная геометрия ЛЖ (ОТС<0,42; нормальный ИММЛЖ), концентрическое ремоделирование (ОТС≥0,42; нормальный ИММЛЖ), концентрическая гипертрофия (ОТС≥0,42; ИММЛЖ больше нормы), эксцентрическая гипертрофия (ОТС<0,42; ИММЛЖ больше нормы). Исследование структурных изменений сонных артерий (СА) проведено на аппарате General Electric «Vivid q» Dimension (M4S-RS) линейными (8L-RS) датчиками в В-режиме (США, 2017). При этом оценивали общую СА на проксимальном и дистальном отделах, толщину комплекса интима-медиа (КИМ, мм) ОСА. Измерение толщины КИМ проводилось трижды, в расчет была взята средняя толщина КИМ, т.е. среднее арифметическое между толщиной КИМ правой (d) и левой (s) общей СА. За утолщение принимали увеличение толщины КИМ более 0,9 мм, за атеросклеротическую бляшку – увеличение толщины КИМ более 1,5 мм [12]. Критерием субклинического и клинического атеросклеротического поражения общей СА считали среднее значение толщины КИМ от 0,9 до 1,3 и ≥1,5 мм соответственно [12].
Статистическая обработка полученных данных произведена с использованием пакета статистических программ Statistica 10.0. Данные представлены в виде медианы (25–75 процентилей). Различия между группами оценены с помощью критериев Манна–Уитни (в случае непараметрического распределения признака) и t-критерия Стьюдента (при наличии признаков с нормальным распределением). Корреляционный анализ проведен по критерию Пирсона (для переменных с нормальным распределением) и коэффициент Спирмена (для переменных с непараметрическим распределением). Статистически значимыми различия считались при значениях р<0,05.
Результаты
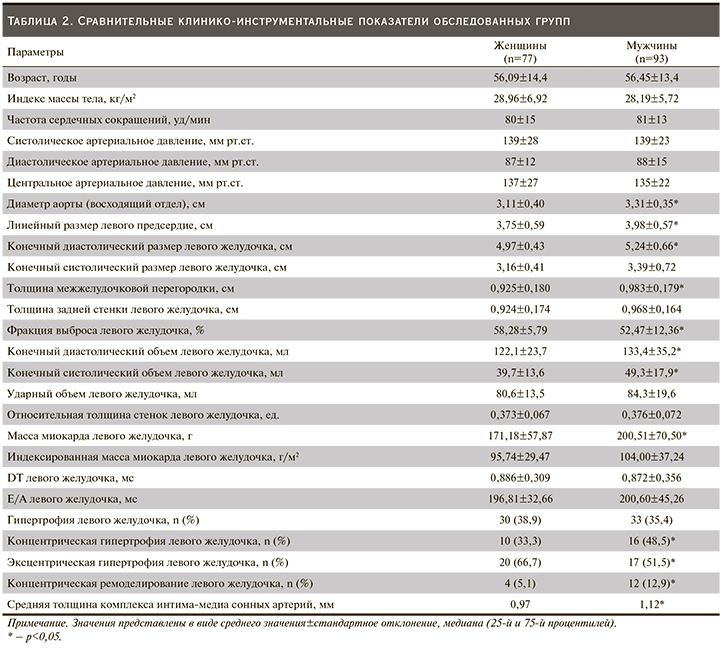
Наличие почечной недостаточности, т.е. снижение СКФ менее 60 мл/мин/1,73 м2, имело место у 84 (49,4%) обследованных больных. Численность больных ХБП С2 и С3А стадиями заболевания была наиболее многочисленной и составила 67 (39,4%) и 37 (21,7%) соответственно. Напротив, доля лиц с С5 стадией ХБП оказалась малочисленной – 13 (7,6%). За исключением С4 стадии, обследованные больные по градациям ХБП были схожими (табл. 1). В когорте мужчин достоверно чаще выявлялась С4-стадия ХБП (p<0,05). Не было достоверных различий по нозологическим структурам заболевания, ассоциированных с ХБП. Лица с хронической обструктивной болезнью легких (ХОБЛ) встречались чаще в группе мужчин, чем женщин: 19 (20,4%) против 7 (9,1%) (p<0,05). Средний возраст обследованных больных, величина ИМТ, частота сердечных сокращений, уровни систолического, центрального и диастолического АД в исследуемых группах были идентичными (табл. 2).

При анализе показателей ЭхоКГ выявлены следующие различия. Так, в группе мужчин диаметр выносящего тракта аорты 3,31±0,35 против 3,11±0,40 см (p<0,05), линейный размер ЛП 3,98±0,57 против 3,75±0,59 см (p<0,05), КДР ЛЖ 5,24±0,66 против 4,97±0,43 см (p<0,05), ТМЖП 0,983±0,179 против 0,925±0,180 см (p<0,05) и ММЛЖ 200,51±70,50 против 171,18±57,87 гр (p<0,05) оказались достоверно выше, а ФВ ЛЖ 52,47±12,36 против 58,28±5,79% (p<0,05) существенно ниже по сравнению с лицами женского пола. Объемные показатели ЛЖ (КДО и КСО), за исключением УО, также были существенно выше у мужчин (p<0,05). Скоростные индексы ЛЖ, такие как Е/А и DT, а также величина ОТС в изучаемых группах были равнозначными (p>0,05). Анализ типов структурных изменений ЛЖ продемонстрировал, что частота встречаемости ГЛЖ в исследуемых группах была схожей (табл. 2). При оценке вариантов структурной модификации ЛЖ установлено, что у мужчин существенно чаще выявляется концентрическая гипертрофия – 16 (48,5%) против 10 (33,3%) (р<0,05), и концентрическое ремоделирование ЛЖ – 12 (12,9%) против 4 (5,1%) (р<0,05) по сравнению с женщинами. Однако число женщин с эксцентрической ГЛЖ было достоверно выше, чем у мужчин, и составило 20 (66,7%) против 17 (51,5%) (р<0,05). Тогда как у мужчин по сравнению с женщинами регистрировалось статистически значимое увеличение толщины КИМ ОСА (р<0,05).
Нами не было выявлено достоверных различий по уровню натрия и кальция сыворотки крови между женщинами и мужчинами (p>0,05). Содержание ОХС и калия сыворотки крови было существенно выше у женщин (табл. 3), концентрация мочевой кислоты, напротив, у мужчин (p<0,05). Межгрупповой анализ по цитокиновому статусу показал достоверно более высокие значения медианы и интерквартильного диапазона ИЛ-10 сыворотки крови: 6,122 (2,381–7,204) против 4,167 (1,761–7,500) пг/мл (p<0,05) у лиц мужского пола по сравнению с женщинами. Различия по уровню ИЛ-6 в исследуемых группах выявлено не было (табл. 3). Важно отметить, что у мужчин концентрации цистатина С и креатинина крови были достоверно выше по сравнению с женщинами: 1,34 (1,07–2,06) против 1,20 (0,94–1,57) мг/л (p<0,05) и 96,5 (74,0–149,0) против 75,7 (61,0–103,6) мкмоль/л (p<0,05) соответственно, а величина СКФ – существенно ниже: 55,6 (34,6–70,7) против 62,3 (46,6–80,6) мл/мин (p<0,05).

Корреляционный анализ, проведенный между показателями центрального АД, ИММЛЖ, ОТС ЛЖ, средней толщиной КИМ ОСА, концентрацией ИЛ-6 и -10 сыворотки крови, выявил достоверные прямые и обратные взаимосвязи. В частности, обратная взаимосвязь выявлена между величиной СКФ и значениями ТМЖП, ТЗСЛЖ, ОТС ЛЖ и ИММЛЖ в группе как женщин, так и мужчин (табл. 4). Однако у мужчин выявлена тесная отрицательная взаимосвязь СКФ с центральным АД (r=-0,364; р=0,001) и КИМ ОСА (r=-0,342; р=0,001), чего у женщин отмечено не было. Напротив, в группе женщин получена тесная корреляционная связь между величиной СКФ и концентрацией ИЛ-10 сыворотки крови (r=-0,243; р=0,023).
Обсуждение
В настоящее время существенно расширились представления о кардиоренальных взаимоотношениях в клинике внутренних болезней [13–15]. Особое значение в развитии снижения функциональной способности почек в последние годы отводят венозному застою и повышению центрального венозного давления [16]. Они приводят к снижению фильтрационного давления в капиллярах клубочков и способствуют замедлению СКФ [17]. Это безусловно приводит к дополнительному развитию гемодинамических нарушений, нейрогуморальной активации, эндотелиальной дисфункции, атеросклерозу и воспалению [18, 19]. Роль воспаления на всех этапах прогрессирования ХБП весьма велика. Изложенные механизмы двусторонних взаимоотношений (дисфункции почек и сердца) полностью нашли подтверждение в нашем исследовании (табл. 2, 3). Так, несмотря на сходство исследуемых групп по возрасту и параметрам гемодинамики, у мужчин размеры выносящего тракта аорты, ЛП, КДР, КДО и КСО ЛЖ оказались существенно выше, а ФВ ЛЖ – значимо ниже (табл. 2). Выявленные сдвиги ассоциировались с замедлением СКФ и ростом концентрации цистатина С и креатинина сыворотки крови (табл. 3). К тому же у мужчин частота неблагоприятных вариантов структурной перестройки ЛЖ оказалась выше, хотя показатели встречаемости ГЛЖ и величины ИММЛЖ в изучаемых группах достоверно не различались.
При прогрессировании кардиоренальных взаимоотношений и дальнейшем снижении ФВ ЛЖ у больных ХБП ренальный кровоток уменьшается, что приводит к снижению СКФ, повреждению базальной мембраны клубочков и потере ее заряда селективности [17, 18]. Это вызывает активацию воспалительных и вазоактивных генов, секрецию медиаторов воспаления.
В дальнейшем в интерстициальное пространство привлекаются моноциты и Т-лимфоциты, что в свою очередь ведет к активации фибробластов, синтезу внеклеточного матрикса и развитию интерстициального фиброза и нефросклероза [19]. Активации фибробластов также способствует вазоконстрикции около канальцевых сосудов с развитием ишемии. Секретируемые клетками интерстициального пространства цитокины ускоряют прогрессирование не только ХБП, но и ССЗ [20]. В ранее проведенном экспериментальном исследовании установлена тесная связь между концентрацией ИЛ-6 и ММЛЖ [21]. А в более поздних работах обобщены молекулярно-генетические аспекты изменения сердечных структур и их связь с цитокинами сыворотки крови [22]. В нашем исследовании выявленные изменения со стороны сердца и функции почек сопровождались достоверным ростом концентрации ИЛ-10 сыворотки крови у мужчин (табл. 3). Однако стоит отметить, что корреляционный анализ выявил тесную связь между повышением уровня ИЛ-10 и снижением СКФ только у женщин. В норме цитокины если и содержатся в сыворотке крови, то в концентрациях, не достаточных для проявления их биологических эффектов. Накопленные данные последних лет свидетельствуют о значительных вариациях цитокиновых показателей, связанных с различными экологическими условиями проживания, образом и качеством жизни, уровнем медицинского обслуживания, а также с возрастом обследуемых, что обусловливает необходимость определения нормального уровня цитокинов периферической крови для каждого региона, пола и возрастной группы с учетом генетических особенностей [23]. ИЛ-10 вызывает противовоспалительные эффекты, однако значительное его повышение ассоциировано с гиперчувствительностью немедленного типа и развитием ряда патологических состояний [24].
Обсуждая вопросы, касающиеся структурной перестройки миокарда ЛЖ у больных ХБП, стоит отметить, что концентрическая ГЛЖ является прогностически неблагоприятным типом структурно-функциональной перестройки сердца, с которым связано наибольшее число сердечно-сосудистых осложнений (ССО) [25]. Отдельные исследователи [26, 27] показали, что при наличии концентрической ГЛЖ вероятность развития ССО очень высока по сравнению с эксцентрическим типом ГЛЖ [28]. Перегрузка объемом и дилатация полостей сердца лежат в основе возникновения эксцентрического варианта ГЛЖ, который наблюдался у 20 (66,7%) женщин и 17 (51,5%) мужчин (табл. 2). Половые особенности структурно-функциональных изменений ЛЖ и ренальной дисфункции у лиц с ХБП были отражены в ранее проведенных нами исследованиях [29, 30].
Важно отметить, что при увеличении толщины КИМ ОСА у мужчин вероятность развития транзиторной ишемической атаки или церебрального инсульта увеличивается примерно в 2 раза [31]. В исследовании SMART (Second Manifestation of Arterial Disease) показана ассоциация увеличения КИМ ОСА с высоким риском ишемического инсульта [32]. Полученные данные в нашей работе (табл. 2, 3) сопоставимы с результатами недавно проведенных исследований, где повышение концентрации цитокинов (ИЛ-10) ассоциируется с утолщением КИМ [33, 34]. В настоящем исследовании мы продемонстрировали, что в группе мужчин, больных ХБП, выявлялись достоверные структурные изменения геометрии ЛЖ, ассоциированные с ростом уровня ИЛ-10 сыворотки крови и снижением азотовыделительной функции почек.
Заключение
Таким образом, полученные данные свидетельствуют о наличии у мужчин, больных ХБП, взаимного и негативного влияния цитокинов на развитие кардиоренальных взаимоотношений.

