Актуальной задачей современной нефрологии является уточнение механизмов активации и рекрутирования лейкоцитов из циркулирующей крови в очаг воспаления, что позволило бы приблизиться к возможности ограничения развития воспалительной реакции на самых ранних этапах. Существуют многочисленные доказательства, подтверждающие критическую роль адренергических механизмов в регуляции воспаления [1–3]. Известно, что адренергические рецепторы экспрессируются на поверхности тромбоцитов (Тц) и лейкоцитов, а их связывание с лигандами обеспечивает регуляцию адгезии и трансэндотелиальной миграции клеток крови из сосудистого русла [4, 5]. Внеклеточные нуклеотиды также признаны важным стимулятором лейкоцитов, запускающим множественные ответы через пуриновые P2-рецепторы мембраны, которые представлены P2X-ионотропными и G-белок-связанными P2Y-рецепторами [6]. Экспрессия рецепторов P2X1, P2X4, P2X5 и P2X7, а также P2Y-1,-2,-4,-6,-11 подтверждена на лейкоцитах человека; изменение активности Р2-рецепторов клеток крови признается триггером развития воспалительной реакции [7–9]. Значимость адрено- и пуриновых рецепторов позволяет рассматривать их в качестве перспективной таргетной мишени противовоспалительной терапии [10]. Однако в этом контексте видится существенная проблема – сложность анализа взаимодействия Тц и лейкоцитов при одновременной стимуляции α-, β-адренергических и Р2Х-, Р2Y-пуринергических рецепторов, инициирующих различные внутриклеточные сигнальные пути. Одним из способов решения этой проблемы служит проведение исследований in vitro на цельной крови, поскольку не только открывается возможность анализа механизмов взаимодействия Тц и лейкоцитов при изолированном действии лигандов, но и появляется надежный индикатор такого взаимодействия, как число образовавшихся ТЛА, обеспечиваюших активацию и рекрутирование лейкоцитов в зону воспаления.
Цель исследования – изучить участие α2-, β2-адренорецепторов и пуриновых Р2-рецепторов в формировании ТЛА у пациентов с хроническим обструктивным пиелонефритом (ХОПН).
Материал и методы
В исследование включены 43 пациента с ХОПН, у которых диагноз был верифицирован на основании жалоб, анамнеза заболевания, объективного осмотра, результатов клинико-лабораторных и инструментальных методов исследования. В фазе ремиссии ХОПН обследованы 26 больных, в фазе рецидива – 17. Формирование ТЛА моделировали in vitro путем добавления к 490 мкл периферической крови 10 мкл раствора, содержащего агонист в конечной дозе ЕС50.
В качестве агониста a2-, β2- адренорецепторов использовали адреналин – неселективный адреномиметик, эффект которого связан с активацией симпато-адреналовой системы (САС) вследствие повреждения конкрементом слизистой оболочки мочевыводящих путей (МВП). При одновременной активации a2- и β2-адренорецепторов воспроизводится суммарный эффект, связанный с агрегацией и дизагрегацией Тц. Выбор АДФ в качестве агониста P2Y-рецепторов клеток крови обусловлен участием в развитии воспалительной реакции Тц, которые, секретируя АДФ, могут дополнительно рекрутировать Тц (аутокринный механизм) и стимулировать лейкоциты (паракринный механизм взаимодействия). Изучение участия фактора активации тромбоцитов (ФАТ) в формировании ТЛА продиктовано тем, что: а) он является медиатором воспаления; б) секретируется лейкоцитами для активации Тц. Количество интактных и стимулированных ТЛА (на 100 лейкоцитов) оценивали после окраски мазков крови по методу Романовского–Гимзе. Все клинические исследования выполнены по согласованию с комиссией по биоэтике ГОО ВПО «Донецкий национальный медицинский университет им. М. Горького». Статистическую обработку результатов проводили в пакетах MedStat и MedCalc. При анализе межгрупповых различий в зависимости от характера распределения признаков учитывали критерий Стьюдента и Вилкоксона. Различие оценивали как статистически значимые при p<0,05.
Результаты
Для достижения поставленной цели необходимо ответить на следующие исследовательские вопросы:
1. Различается ли формирование ТЛА in vitro у здоровых волонтеров (контрольная группа) при стимуляции Тц адреналином, АДФ и ФАТ?
Базальный уровень ТЛА (формирование агрегатов в циркулирующей крови in vivo в физиологических условиях) находился в пределах 4,364±0,367%. При стимуляции Тц адреналином выявлена тенденция к повышению количества агрегатов на 23,7% (р>0,05). АДФ воспроизводил статистически значимый прирост ТЛА относительно базального уровня на 83,3% (р=0,001) и эффекта адреналина на 48,1% (р=0,021). Для ФАТ эти показатели составили соответственно 79,1% (р<0,01) и 44,8% (р=0,005). Индуцирующее влияние АДФ и ФАТ на клетки крови совпадало соответственно 8,000±1,923 и 7,818±0,536% (р>0,05).
Таким образом, у здоровых волонтеров: а) стимулирующий эффект адреналина на клетки крови существенно не влиял на формирование ТЛА; б) моделирование in vitro паракринных механизмов взаимодействия Тц и лейкоцитов путем введения АДФ и ФАТ в цельную кровь свидетельствует о сопоставимости влияния Тц на лейкоциты и лейкоцитов на Тц при формировании ТЛА; в) активация α2-адренорецепторов клеток крови не сопровождалась амплификацией внутриклеточного сигнала посредством паракринных механизмов взаимодействующих лейкоцитов и Тц, в противном случае индуцирующее влияние адреналина на формирование ТЛА в цельной крови было бы выше, чем у агонистов АДФ и ФАТ.
2. Различается ли содержание ТЛА в циркулирующей крови (базальный уровень ТЛА) у пациентов в фазе ремиссии и рецидива ХОПН?
Результаты морфометрического исследования мазков крови свидетельствуют, что количество ТЛА в фазе ремиссии ХОПН соответствует таковому в контрольной группе (р=0,384). В фазе рецидива ХОПН содержание ТЛА в цельной крови превышает базальный уровень агрегатов в контрольной группе и в фазе ремиссии примерно в 2,2 раза (р<0,001). Вероятно, в фазе рецидива ХОПН интенсивное рекрутирование лейкоцитов крови достигается посредством включения механизмов, не проявляющих себя у здоровых лиц и пациентов с ремиссией заболевания. Выяснение данных механизмов активации клеток крови при формировании ТЛА в разных фазах ХОПН позволит приблизиться к пониманию причин рецидива острого воспаления в МВП.
3. Различается ли формирование ТЛА при стимуляции Тц и лейкоцитов у пациентов в фазе ремиссии ХОПН?
Установлено, что количество ТЛА, образовавшихся при введении адреналина в цельную кровь, возросло по сравнению с контрольной группой на 29,6% (р=0,049) и на 79,5% (р=0,003) относительно их количества до стимуляции (см. таблицу).
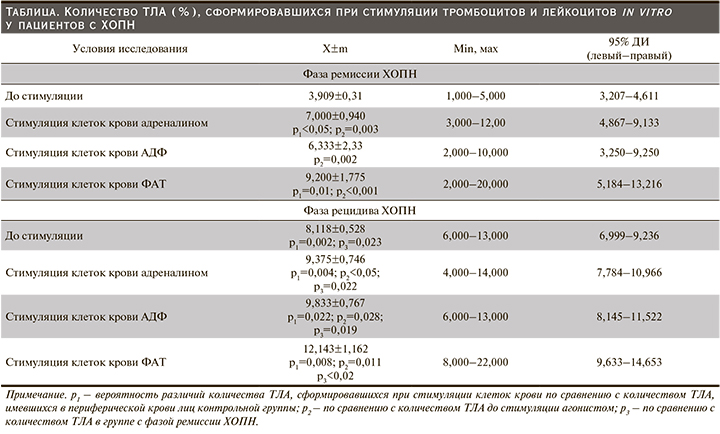
Следовательно, рекрутирование лейкоцитов посредством ТЛА при хроническом воспалении в МВП обеспечивается системным механизмом активации САС, причем степень воспроизводимости количества агрегатов связана с гиперреактивностью α2-адренорецепторов клеток крови.
При стимуляции клеток крови АДФ количество ТЛА повысилось на 62,4% (р=0,002) относительно их численности до стимуляции, что свидетельствует об участии пуриновых рецепторов клеток крови во взаимодействии лейкоцитов и Тц. В то же время отсутствие значимой разницы ТЛА, сформировавшихся при воздействии АДФ на цельную кровь, у пациентов в фазе ремиссии ХОПН и у лиц контрольной группы свидетельствует о нормореактивности Р2Y-рецепторов Тц и лейкоцитов. Не выявлена существенная разница между количеством ТЛА, сформировавшихся при воздействии АДФ и адреналина. Вероятно, адреналин не воспроизводит амплификацию сигнала α2-адренорецептора в клетках крови, которая была бы возможной при включении паракринных механизмов.
Добавление в цельную кровь ФАТ сопровождалось увеличением количества ТЛА на 135% (р<0,001) относительно их численности до стимуляции, что подтверждает участие ФАТ-рецепторов в активации Тц при ремиссии ХОПН. Поскольку количество ТЛА, сформировавшихся в фазу ремиссии ХОПН при инкубации крови с ФАТ, превышало на 17,6% (р=0,010) численность ТЛА в контрольной группе, образованных в аналогичных условиях, можно констатировать, что повышение реактивности ФАТ-рецепторов клеток крови при наличии хронического воспаления в МВП и участие лейкоцитов, секретирующих ФАТ, в активации Тц и формировании ТЛА. Тем самым подтверждается функционирование паракринного механизма, связанного с активацией лейкоцитов. Обращает на себя внимание, что количество ТЛА, сформировавшихся в фазу ремиссии ХОПН при инкубации крови с ФАТ на 31,4% (р=0,008), превышает содержание агрегатов, образовавшихся при воздействии адреналина. Таким образом, паракринная стимуляция Тц активными лейкоцитами при формировании ТЛА воспроизводила более выраженный эффект, чем системный механизм, обеспечивающий одновременную активацию лейкоцитов и Тц посредством адреналина. Выявлена тенденция более выраженного формирования ТЛА при воздействии на клетки крови ФАТ по сравнению с АДФ (на 45,3%; р>0,05), что отражает преобладание паракринного влияния лейкоцитов на Тц.
В процессе анализа полученных результатов обнаружена корреляционная связь между количеством ТЛА, образовавшихся при инкубации клеток крови с АДФ и ФАТ (r=0,590; р=0,022), а также адреналина и АДФ (r=0,187; р=0,038); связь между индуцирующим влиянием адреналина и ФАТ не обнаружена (r=0,145; р>0,05). По сути, при реализации хронического воспаления в МВП поддерживается взаимная стимуляция лейкоцитов и Тц на основе паракринной регуляции. Активация САС может быть фактором риска рецидива ХОПН, поскольку адреналин может стимулировать Тц, которые при этом будут модулировать функциональную активность лейкоцитов.
4. Различается ли формирование ТЛА при стимуляции Тц и лейкоцитов у пациентов в фазе рецидива ХОПН?
Установлено, что количество ТЛА, образовавшихся при инкубации клеток крови с адреналином, возросло по сравнению с контрольной группой на 73,6% (р=0,002) и на 15,5% (р=0,049) относительно их числа до стимуляции. Следовательно, рекрутирование лейкоцитов при остром воспалении в МВП происходит на фоне гиперреактивности a2-адренорецепторов и может воспроизводиться адреналином. Стимуляция клеток крови посредством АДФ сопровождалась повышением количества ТЛА на 22,9% (р=0,022) и 21,1% (р=0,028) по сравнению с их содержанием в контрольной группе и до стимуляции данным агонистом. Если сопоставить реактивность агонистов по приросту количества ТЛА относительно их уровня до стимуляции, то ведущую роль играет ФАТ, поскольку количество ТЛА увеличилось на 49,6% (р=0,011).
Таким образом, формирование ТЛА в фазу рецидива ХОПН: а) происходит при участии активированных лейкоцитов и Тц, паракринные механизмы которых обеспечивают взаимодействие клеток крови для реализации острого воспаления в МВП; б) активация ФАТ-рецепторов Тц посредством агониста секретируемого лейкоцитами более эффективна в плане формирования ТЛА, чем активация P2Y-рецепторов лейкоцитов, с помощью пуринов (АТФ и АДФ), секретируемых из плотных гранул Тц.
Суть развивающихся причинно-следственных связей, участвующих во взаимодействии Тц и лейкоцитов при действии адреналина, АДФ и ФАТ можно прояснить, анализируя соответствующие корреляционные связи. Так, выявлена сильная связь между количеством ТЛА, индуцированных ФАТ и адреналином (r=0,787; р<0,001), и отсутствием таковой при анализе воздействия адреналина и АДФ на клетки крови (r=0,223; р>0,05); корреляция средней силы (r=0,550; р=0,012) обнаружена между индуцирующим влиянием ФАТ и АДФ. По сути данных фактов можно констатировать преимущественное воздействие адреналина на лейкоциты (проявление системной активации клеток крови при развитии острого воспаления в МВП), которые могут стимулировать Тц. В свою очередь активированные Тц секретируют АДФ и стимулируют пуриновые рецепторы лейкоцитов, тем самым усиливается влияние адреналина на лейкоциты (амплификация сигнала с α2-адренорецептора).
По сравнению с ремиссией ХОПН отмечается более выраженный проагрегантный эффект АДФ (количество сформировавшихся ТЛА в фазу рецидива заболевания на 55,3% больше) и сопоставимые эффекты адреналина и ФАТ (превышение уровня ТЛА соответственно на 33,9 и 32%). Таким образом, развитие острого воспаления в МВП (рецидив ХОПН) происходит на фоне возрастающей активации пуриновых и адренергических рецепторов Тц и лейкоцитов.
Обсуждение
В настоящее время a-адренорецепторы лейкоцитов рассматриваются как индукторы воспалительной реакции, поскольку соответствующие агонисты индуцируют увеличение продукции медиатора воспаления ФНО-a [11] и обеспечивают регуляцию адгезии клеток крови [12]. Полученные результаты подтверждают, что опосредованное α2-адренорецепторами увеличение экспрессии молекул адгезии на Тц вносит существенный вклад в формирование ТЛА.
Установлено, что функциональная активность β2-адренорецепторов мононуклеарных клеток снижается у пациентов с хроническими воспалительными заболеваниями [13]. Причем связывание катехоламинов с b2-адренергическими рецепторами на полиморфноядерных лейкоцитах человека ингибирует клеточные ответы, стимулируемые хемокинами. L.A. Grisanti et al. [14] продемонстрировали критическую роль β-аррестин2/AP-1-зависимой передачи сигналов β2-адренорецептора в регуляции экспрессии рецептора хемокина CCR2 и рекрутировании лейкоцитов в острой фазе воспаления. Стимуляция β-адренорецептора увеличила экспрессию CCR2 и миграционную чувствительность лейкоцитов к хемокину CCL2.
Влияние катехоламинов на выработку цитокинов и экспрессию молекул адгезии нейтрофилами человека критически оценивается M. Wahle et al. [15]. В исследованиях in vitro показано, что инкубация нейтрофилов с адреналином не сопровождалась повышением уровня секретируемого интерлейкина-8 (ИЛ-8); снижалась экспрессия молекул адгезии CD15 и CD44 и только экспрессия молекул CD54 увеличивалась. Логичным выглядит утверждение, будто влияние катехоламинов на синтез нейтрофилами ИЛ-8 и экспрессию CD15, CD44 и CD54 ограничено. С данным утверждением можно было бы согласиться, если бы в нейтрофилах повышалась концентрация ионов Са2+, а не цАМФ. Именно повышение уровня цАМФ в лейкоцитах наводит на мысль о преимущественной стимуляции β2-адренорецепторов, нивелирующих эффект α2-адренорецептора. Приведенные данные демонстрируют критическую роль катехоламинов в стимуляции α- и β-адренорецепторов клеток крови при развитии воспалительной реакции и подтверждают, что использование антагонистов a2-адренорецептора и/или агонистов β2-адренорецептора представляет собой перспективный метод лечения пациентов, имеющих острый или хронический воспалительный процесс [16].
Рекрутирование воспалительных клеток к участкам повреждения тканей и/или инфекции контролируется множеством сигнальных процессов, влияющих на межклеточные взаимодействия между эндотелиальными клетками сосудов в посткапиллярных венулах и циркулирующими лейкоцитами. В последние годы обсуждается участие P2Y-пуринергических рецепторов в активации эндотелиальных клеток при воспалении. Однако механизмы регуляции высвобождения АТФ из эндотелия остаются неясными. A.W. Lohman et al. [17] представили данные, согласно которым АТФ-пропускающий канал паннексин-1 (Pannexin-1) открывается посредством ФНО-α. Этот процесс включает активацию рецепторов 1-го типа для ФНО-α, стимуляцию киназ семейства Src (SFK) и SFK-зависимое фосфорилирование паннексина-1. Таким образом, во время острого системного воспаления эндотелиальные клетки секретируют АТФ и тем самым могут стимулировать адгезию и миграцию лейкоцитов через венозную стенку.
Пуриновый рецептор P2Y1 индуцирует активацию эндотелиальных клеток, сопровождающуюся адгезией лейкоцитов. Подтверждение этого факта можно найти в работах [18], которые показали, что агонист P2Y1-рецепторов (2MeSATP) увеличивал адгезию лейкоцитов к эндотелиальным клеткам и продукцию ФНО-α. Представленные данные подтверждают возможность модуляции эндотелиальных клеток через P2Y1-пуринергический рецептор. Так, результаты исследований R.T. Amison et al. [19] показали, что антагонисты P2Y1-рецептора, но не P2Y12- и P2X1-рецепторов ингибировали миграцию лейкоцитов. В сущности, это свидетельствует о том, что образование ТЛА и P-селектин-зависимая миграция полиморфно-ядерных клеток зависимы исключительно от рецепторов тромбоцитов P2Y1. Стимуляция P2Y1-рецепторов тромбоцитов приводила к повышению активности Rho-ассоциированной киназы (RhoA) и следовательно, к стимуляции P2Y1, что было необходимо для хемотаксиса лейкоцитов in vitro. Вероятно, P2Y1-рецептор может использоваться в качестве потенциальной мишени для контроля хронического воспаления.
Заключение
В фазе ремиссии и рецидива ХОПН формирование ТЛА и рекрутирование лейкоцитов крови из циркулирующей крови в очаг воспаления достигаются посредством включения системного (влияние адреналина) и паракринных механизмов (секреция АТФ, АДФ и ФАТ). Достигаемый эффект зависит от активности a2-, β2-адренорецепторов, Р2Y-пуриновых и ФАТ-рецепторов Тц и лейкоцитов. Дальнейшие исследования позволят не только подойти к пониманию регуляции оптимального соотношения разных видов лейкоцитов при развитии острого воспаления, но и обосновать новые возможности управления фазой рецидивирования ХОПН.

