Введение
Третий новый коронавирус, вызывающий тяжелую респираторную инфекцию (коронавирусная болезнь-2019, COVID-19), был впервые обнаружен в Ухане (Китай) в декабре 2019 г. По состоянию на август 2020 г. во всем мире было зарегистрировано 23 млн подтвержденных случаев заболевания, из которых 800 тыс. пациентов умерли. Клинический спектр симптомов, возникающих в результате заражения коронавирусом 2, ассоциированным с тяжелым острым респираторным синдромом (SARS-CoV-2), широк и может варьироваться от бессимптомной реакции и развития легкой инфекции верхних дыхательных путей до критического состояния. В первых отчетах о госпитализированных пациентах в Ухане была описана высокая доля лиц с атипичной пневмонией и признаками острого респираторного дистресс-синдрома (ОРДС), нуждавшихся в экстренной медицинской помощи [1, 2]. Первичная легочная патология, по-видимому, развивалась в результате острого диффузного альвеолярного повреждения, вызванного прямым вирусным цитопатическим воздействием. В связи с этим патогенез ОРДС при COVID-19 следует рассматривать как результат не сколько генерализованной воспалительной реакции, сколько прямого влияния вируса.
В первые месяцы пандемии регистрировалась невысокая частота COVID-19-ассоциированного острого повреждения почек (COVID-19-ОПП) [2–7]. Тем не менее все больше данных свидетельствуют об ее увеличении, особенно среди пациентов, находящихся в отделении реанимации и интенсивной терапии (ОРИТ) [8–19]. Этот показатель значительно варьируется в разных литературных источниках, однако его доказанная распространенность составляет в среднем >20% госпитализированных больных и >50% пациентов в ОРИТ [8–19]. Как и при других формах внебольничной пневмонии, ОПП при COVID-19 признано частым осложнением заболевания [20]. Как и ОПП, вызванное другими причинами, COVID-19-ОПП связано с развитием и обострением сопутствующей патологии, неблагоприятными исходами, а также с более широкой потребностью в ресурсах здравоохранения. Однако, несмотря на значительный прогресс в понимании и лечении других форм ОПП, о патогенезе и лечении COVID-19-ОПП известно относительно мало.
Учтя недостаток знаний об оптимальной стратегии профилактики и лечения этого клинического состояния, 25-я рабочая группа ADQI сосредоточила свои усилия на обзоре литературы, касающейся COVID-19-ОПП, включая его эпидемиологию и патофизиологию, а также на сравнении текущего понимания ОПП с его другими формами с целью разработки рекомендаций по диагностике, профилактике и лечению COVID-19-ОПП. Экспертами также были предложены показания к проведению ЗПТ и оценена роль других экстракорпоральных методов лечения.
Методы
Группа экспертов 25-го комитета консенсуса ADQI была создана по инициативе ее председателей (M.K.N., L.G.F., R.L.M., C.R. и J.A.K.) с целью обсуждения вопросов, касающихся ОПП, связанного с COVID-19. В нее вошли клиницисты и исследователи, специализирующиеся в области нефрологии и реанимации из Северной и Южной Америки, Европы и Азии. Конференция проводилась в течение 4 недель – с 23 мая по 13 июня 2020 г. – с еженедельными виртуальными встречами по достижению консенсуса. Эти встречи проводились в соответствии с установленным ADQI регламентом, а для достижения консенсуса был использован модифицированный метод Delphi [21].
Участники конференции были разделены на пять рабочих групп, которым было поручено рассмотреть ключевые вопросы по ОПП в обсуждаемой когорте пациентов: патофизиологию и влияние лечения на почки; эпидемиологию и диагностику; профилактику и ведение; ЗПТ, особенно в условиях повышенного спроса, и использование других форм экстракорпоральной гемокоррекции в отношении пациентов с COVID-19 с наличием или отсутствием ассоциированного ОПП.
Члены рабочих групп разработали основные положения, провели систематические обзоры литературы и достигли консенсуса, подкрепленного доказательствами, где это было возможно, сформулировав программу исследований для решения важных вопросов, на которые пока нет ответов. Поиск литературы проведен с использованием ресурсов Национального института здравоохранения (NIH) и PubMed. По возможности делегатов просили указать уровень доказательности утверждений положений консенсуса с использованием уровней доказательности Оксфордского центра доказательной медицины [22].
Эксперты представили результаты работы на видеоконференции во время четырех пленарных заседаний для обсуждения положений рекомендаций и предложений по их коррекции. Согласованные позиции документа легли в основу финальной версии консенсуса, одобренной всеми участниками рабочих групп.
ПАТОФИЗИОЛОГИЯ И ЭФФЕКТЫ ЛЕЧЕНИЯ
Прямые патогенетические механизмы
Какие прямые патогенетические механизмы участвуют в развитии COVID-19-ОПП?
1. Гистопатологических данных недостаточно. Вместе с тем у пациентов с COVID-19 был описан широкий спектр морфологических проявлений, соответствовавших ряду причин ОПП, в т.ч. тем, которые обычно обнаруживаются у пациентов в тяжелом состоянии.
2. SARS-CoV-2 может проявлять вирусный тропизм и напрямую приводить к повреждению почек.
3. Эндотелиальная дисфункция, коагулопатия и активация комплемента, вероятно, являются наиболее важным механизмом развития ОПП в группе пациентов с COVID-19.
4. Роль системного воспаления и иммунной дисфункции в развитии COVID-19-ОПП все еще не ясна.
Обоснование
В настоящее время гистопатологических сведений, относящихся к COVID-19-ОПП, недостаточно, вместе с тем имеющиеся данные позволяют полагать, что к развитию ОПП при COVID-19 приводят многочисленные причины (рис. 1). При посмертном исследовании 26 пациентов, умерших от COVID-19-ОПП, при световой микроскопии были обнаружены признаки выраженного острого повреждения канальцев [23]. Кроме того, при электронной микроскопии в этом и другом патологоанатомическом исследованиях сообщалось о наличии вирусных частиц как в эпителии канальцев, так и в подоцитах, что указывало на прямое действие вируса на почки [23, 24].
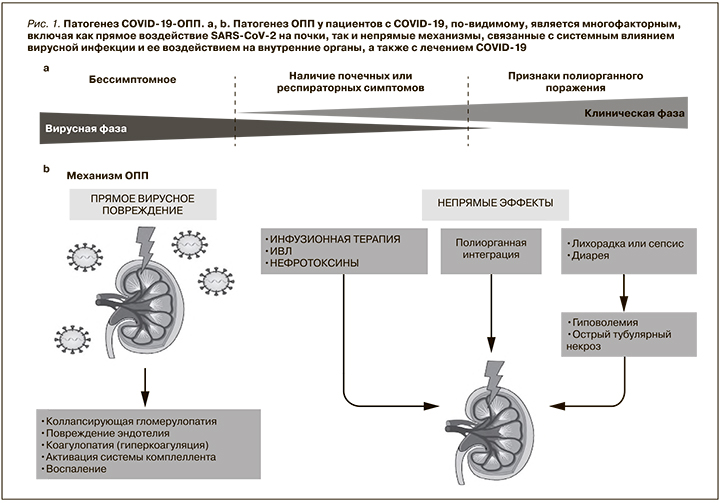
В нескольких работах у пациентов с COVID-19 и поражением почек была описана коллапсирующая гломерулопатия. Этот морфологический вариант фокального сегментарного гломерулосклероза связан с рядом факторов, включая вирусную инфекцию, особенно среди пациентов африканского происхождения, у которых наблюдается высокий риск наличия аллелей APOL1, который служит генетическим фактором риска коллапсирующей гломерулопатии независимо от причины [25–28]. Стоит отметить, что в представленных отчетах пока нет единой позиции в отношении патологических изменений, связанных с COVID-19. Так, например, при оценке нефробиоптата тяжелобольного пациента с COVID-19 обнаружено обширное острое повреждение канальцев. При этом полученные результаты ПЦР в реальном времени замороженной ткани почки, мочи и сыворотки крови были отрицательными на SARS-CoV-2, также не было обнаружено доказательств прямой вирусной инвазии [29].
В исследовании, проведенном в Германии, ученые не нашли морфологических изменений в почках пациентов, умерших от COVID-19, хотя неясно, у скольких из них было ОПП [30]. В другой работе изучение аутопсийного материала не привело к выявлению вируса в тканях почек [31]. Эти результаты контрастируют с таковыми другого исследования, в котором при микродиссекции аутопсийного материала обнаружены вирусные РНК и белок во всех компартментах почек, преимущественно в клетках клубочкового аппарата [32]. Данные еще одного патологоанатомического исследования пациентов с респираторной инфекцией COVID-19 продемонстрировали связь между тропностью SARS-CoV-2 к почечной ткани, тяжестью заболевания (т.е. с риском преждевременной смерти) и развитием ОПП [33]. В то же время представляет научный интерес оценка роли тромбоза и микроангиопатии в почках пациентов с COVID-19 (как это было зарегистрировано в легких), однако этот вопрос требует дальнейшего изучения [34, 35].
Пока неизвестно, но вероятно, что определенные генетические особенности могут повыщать риск развития ОПП при COVID-19. Рецептор-связывающий домен S-белка SARS-CoV-2 получает доступ к клетке-хозяину посредством связывания с мембраносвязанным АПФ2 – белком, который встречается в разных тканях организма, в т.ч. в эпителиальных клетках канальцев почек и подоцитах [36, 37]. Ряд авторов отмечают, что полиморфизм АПФ2, вероятно, может изменять способность вируса проникать в клетки. Как упоминалось выше, носительство генотипа APOL1 также может влиять на восприимчивость к COVID-19. И хотя сами по себе аллели риска APOL1 не связаны с высоким риском повреждения почек, вирусная инфекция SARS-CoV-2 в этой группе повышает риск его развития [38, 39]. Однако выяснение этих ассоциаций требует дальнейшего исследования.
Эндотелиальная дисфункция представляет собой ключевой фактор риска коагулопатии, ассоциированной с COVID-19, и характеризуется высоким уровнем D-димера и микрососудистым повреждением. Другие наследственные или приобретенные протромботические состояния, такие как тромботическая тромбоцитопеническая пурпура и атипичный гемолитико-уремический синдром, также могут приводить к формированию эндотелиальной дисфункции, коагулопатии и прямой вирус-опосредованной активации системы комплемента [40, 41]. Важно отметить, что активация комплемента и тромботическая микроангиопатия являются значимым механизмом повреждения почек, однако их роль в развитии ОПП при COVID-19 до сих пор не установлена.
Инфекция SARS-CoV-2 проявляется системным воспалительным ответом, получившим название «цитокиновый шторм», который может быть патогенетическим механизмом полиорганной дисфункции, ассоциированной с COVID-19. Однако природа этого явления остается до конца не ясной [42]. При других формах респираторных заболеваний, вызванных коронавирусами SARS-CoV и MERS-CoV, повышенные уровни провоспалительных цитокинов вызывали более выраженное поражение легких [43–45].
Однако у пациентов с COVID-19 обнаруженные уровни циркулирующего ИЛ-6 были значительно ниже, чем у пациентов, получавших терапию Т-клетками с химерными антигенными рецепторами (CAR-T-терапию); почти в 10 тыс. раз ниже, чем у пациентов с синдромом высвобождения цитокинов, и более чем в 20 тыс. раз ниже, чем у пациентов с сепсисом [46, 47]. Сравнительные данные демонстрируют умеренное повышение уровня цитокинов при COVID-19, что делает маловероятным развитие прямого патогенного эффекта у большинства пациентов.
Альтернативным объяснением этого феномена может быть следующее: умеренное повышение цитокинов отражает тяжесть течения основного заболевания, а не представляет собой «шторм» воспалительных процессов как таковых. Важно отметить, что методы определения цитокинов плазмы крови недостаточно стандартизированы, в связи с чем сравнение их уровней в различных исследованиях может быть не достаточно информативным. В связи с чем уровни цитокинов следует оценивать в более крупных когортах пациентов с COVID-19 с оценкой количества и активности иммунных клеток. Таким образом, понимание роли врожденной и приобретенной иммунной дисфункции у пациентов с ОПП представляет научный интерес.
Непрямые патогенетические механизмы
Какие непрямые патогенетические механизмы задействованы в развитии COVID-19-ОПП?
1. Системные эффекты COVID-19 и интенсивная терапия могут способствовать развитию ОПП.
2. Полиорганная дисрегуляция, вероятно, является важным механизмом развития ОПП у пациентов с COVID-19.
3. Преморбидный фон (факторы риска, сопутствующая патология) способствуют развитию ОПП, действуя как модификаторы прямых патогенетических механизмов.
Молекулярные паттерны, связанные с повреждениями (ДАПМ), – представляют собой эндогенные молекулы, которые могут вызывать воспаление, часто передавая сигналы через специфические рецепторы, такие как Toll-подобные рецепторы. Источником ДАМП зачастую являются поврежденные или погибающие клетки (например, миоглобин, амфотерин HMGB1, мочевая кислота).
Обоснование
Помимо прямых патофизиологических механизмов COVID-19-ОПП может развиваться на фоне системных эффектов SARS-CoV-2 и критического состояния пациента (рис. 1). Так, выраженная лихорадка, а также диарея, связанная с поражением ЖКТ, приводят к значительной потере жидкости, гиповолемии и становятся важным потенциальным фактором развития ОПП. Пациенты с тяжелым течением могут подвергаться воздействию нефротоксинов в рамках оказания им специализированной медицинской помощи, в частности, на фоне приема антибиотиков, способных вызывать повреждение канальцев почек или острый тубулоинтерстициальный нефрит (ОТИН) [48, 49]. Более того, пациенты, у которых развиваются вторичные инфекции (независимо от того, являются ли они бактериальными, грибковыми или вирусными), подвергаются повышенному риску вторичного сепсис-ассоциированного ОПП [50].
В то же время пациенты с тяжелой пневмонией, связанной с COVID-19 и/или ОРДС, подвержены высокому риску ОПП, ассоциированному с проведением механической ИВЛ. В частности, при ОРДС, связанном с COVID-19, применяют тактику повышения положительного давления конца выдоха (ПДКВ), что вызывает увеличение внутригрудного давления, потенцирует венозную почечную гипертензию и может снижать скорость клубочковой фильтрации. Состояние может усугубляться, если на фоне перегрузки жидкостью у пациента повышено еще и давление в брюшной полости [51]. Кроме того, все формы вентиляции с положительным давлением могут повышать симпатический тонус, что вызывает вторичную активацию ренин-ангиотен-альдостероновой системы (РААС) [52,53]. К пациентам с ОРДС после выхода из шока зачастую применяется ограничительная инфузионная стратегия. Однако в условиях COVID-19 у них изначально может наблюдаться относительный дефицит жидкости вследствие ее потери при лихорадке, диарее и других причинах, что необходимо учитывать для избежания гиповолемии.
Полиорганная интеграция (organ crosstalk) представляет собой сложную и взаимную биологическую связь между органами, опосредованную сигнальными факторами, включая цитокины, факторы роста, а также высвобождение из поврежденных тканей ДАМП. Подобная интеграция способна вызывать развитие ОПП при ОРДС [54, 55]. Так, повреждение легких у пациентов с COVID-19 может быть тяжелым и внезапным и приводить к высвобождению не только ДАМП, но и цитокинов, хемокинов, вазоактивных веществ, индуцируя ОПП. Источником ДАМП могут выступать и другие ткани, например высвобождение миоглобина из мышц при рабдомиолизе на фоне COVID-19 [56].
Имеющиеся данные свидетельствуют о том, что пожилой возраст, хроническая болезнь почек (ХБП), сахарный диабет, артериальная гипертензия, ожирение, сердечная недостаточность и хроническая обструктивная болезнь легких служат неблагоприятным предиктором развития ОПП и ухудшают прогноз заболевания. Перечисленные факторы ассоциированы с повышенным «иммунным старением», как следствие – с склонностью к низкоинтенсивному воспалению, хотя, каким образом это влияет на почки в условиях COVID-19, пока не установлено [57].
Механизмы восстановления
Каковы потенциальные механизмы восстановления после COVID-19-ОПП?
1. Пока не ясно, отличается ли восстановление после COVID-19-ОПП от других форм ОПП. Для того чтобы оценить отдаленные последствия прямого влияния вируса SARS CoV-2, его вклад в развитие фиброза почек и процессы восстановления, необходимы дополнительные исследования.
Обоснование
В литературе имеются сообщения о развитии легочного фиброза у пациентов после выздоровления от COVID-19 [58]. И хотя мы еще не знаем, возникает ли фиброз почек у пациентов, выздоровевших от COVID-19-ОПП, развитие фиброза и трансформация в ХБП у пациентов, восстанавливающихся после других форм ОПП, предполагают, что этот сценарий вероятен. Более того, потеря функционирующих нефронов после острого повреждения может ускорить фибротические процессы в ткани почек. С целью оценки восстановления функции почек рекомендуем наблюдение за этой группой больных в течение 2–3 месяцев после выписки из стационара в зависимости от тяжести COVID-19-ОПП и потребностей пациента [59].
Эпидемиология и диагностика
Заболеваемость и диагноз
Какова распространенность COVID-19-ОПП и как его выявить?
Рекомендации
1. Время появления симптомов ОПП, госпитализация, подтверждение инфекции, оценка тяжести заболевания и объема медицинской помощи должны учитываться при определении тактики ведения пациента (уровень доказательности не присвоен).
2. Рекомендуем использовать в клинической практике консенсус «Инициатива по улучшению глобальных исходов лечения пациентов с ОПП» (KDIGO), включающий уровень креатинина сыворотки (SCr) и объем диуреза (для постановки диагноза и стадии ОПП) (уровень доказательности: 1A).
3. Предлагаем использовать специфичные тесты наряду с оценкой функции почек для характеристики клинической картины, течения и исходов ОПП (уровень доказательности: 2Б).
Обоснование
Распространенность ОПП значительно варьируется в разных исследованиях, причем более высокие показатели зарегистрированы в странах за пределами Китая (табл. 1). ОПП у пациентов с COVID-19 может быть как при поступлении, так и развиваться во время госпитализации, при этом чаще наблюдается у тех, кому требуется введение в ОРИТ. Следует отметить, что во многих опубликованных отчетах о пациентах с COVID-19 не содержалось информации об определении и стадиях ОПП, восстановлении функции почек и последующем наблюдении. Также редко проводилось различие между ОПП «de novo» и ОПП на фоне имеющейся ХБП. Кроме того, частота госпитализаций пациентов с COVID-19 варьировалась между странами и внутри стран, что отражало национальные и региональные особенности систем здравоохранения, политику госпитализации и рекомендованных протоколов оказания медицинской помощи (например, госпитализацию в ОРИТ).
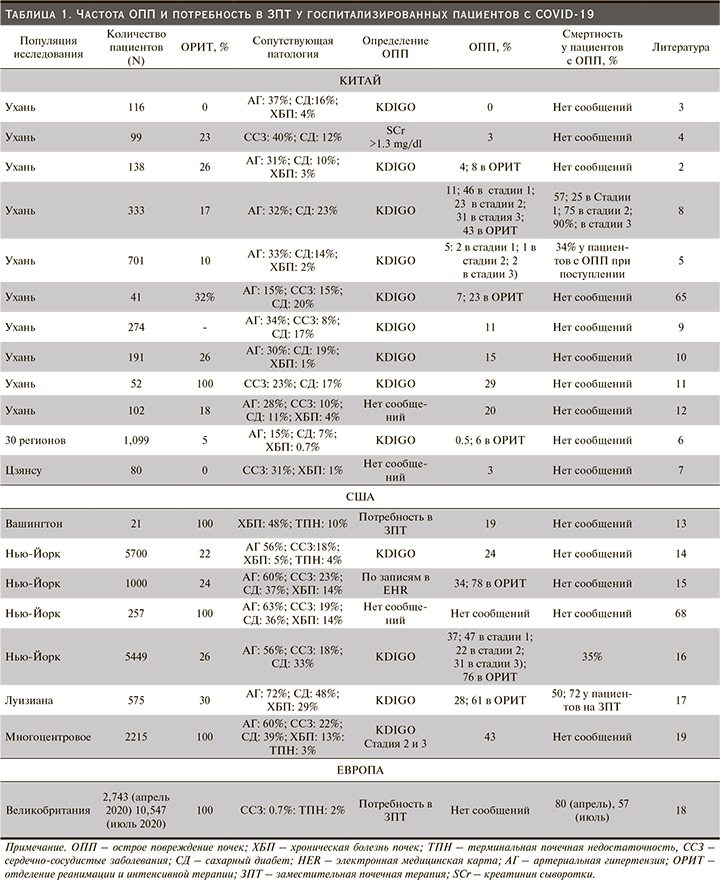
Перечисленные факторы усложняют сравнение показателей частоты COVID-19-ОПП, основанных исключительно на количестве госпитализированных пациентов. Так, в Великобритании первоначальная частота ОПП в апреле 2020 г. (определенная по потребности в ЗПТ) составляла 20% среди стационарных больных с зарегистрированной смертностью более 80%, тогда как те же показатели за июль 2020 г. были 27 и 57% соответственно [60] (табл. 1). При анализе этих данных необходимо было принять во внимание, что более свежая информация о пациентах с более короткой продолжительностью пребывания на койке не репрезентативна для всей когорты и демонстрирует скорее неполное последующее наблюдение за пациентами, чем отражение улучшения исходов ОПП. Подобные неточности следует учитывать при изучении общих показателей ОПП и потребности в ЗПТ.
Рекомендуем использовать критерии KDIGO для верификации диагноза ОПП [61], чтобы обеспечить возможность сравнения полученных результатов между разными исследованиями. Повышение частоты выявления ОПП с их применением может повыщать выживаемость пациентов [61,62]. С учетом этих критериев эпидемиология COVID-19-ОПП (табл. 1) сопоставима с аналогичными показателями при других формах внебольничной пневмонии [20].
Отсутствие сведений о догоспитальном уровне SCr зачастую препятствует возможности своевременно идентифицировать ХБП, лежащую в основе острого клинического состояния. Это создает определенные сложности в дифференциальной диагностике ОПП, определении стадии процесса, подчеркивает важность оценки исходного уровня SCr. В одном исследовании, в котором эта информация была доступна, продемонстрировано: 35% пациентов с COVID-19-ОПП имели сопутствующую ХБП [17]. Для улучшения понимания вопроса эпидемиологии и природы COVID-19-ОПП исследователи, сообщая о частоте ОПП, должны сопоставлять время его возникновения с появлением симптомов COVID-19, госпитализацией, подтверждением инфекции SARS-CoV-2, тяжестью заболевания и уровнем оказания медицинской помощи.
Хотя об объеме диуреза сообщается нечасто, у двух трети пациентов с ОПП в дебюте наблюдается низкая концентрация натрия в моче, у большинства – олигурия на старте ЗПТ [16, 17]. У пациентов с COVID-19-ОПП зачастую отмечаются отклонения от нормы биомаркеров ОПП и показателей общего анализа мочи, что можно использовать в диагностике этой патологии [5, 8, 16, 17]. Например, в одном исследовании показано, что среди 32% пациентов, госпитализированных по поводу COVID-19, у 42,1% была выраженная протеинурия, а также лейкоцитурия (36,5%) и гематурия (40,9%) [16].
В другой работе при оценке анализа мочи 442 госпитализированных китайских пациентов с COVID-19 в 43,9% (30% ≥2+ на индикаторной полоске) случаев была обнаружена протеинурия и у 11,3% – выраженная гематурия [5]. Исследование мочевого осадка может быть эффективным диагностическим инструментом в различных клинических сценариях, в которых нередко встречается несколько потенциальных причин ОПП. Это играет важную роль не только в дифференциальной диагностике, например, острого тубулярного некроза и преренального ОПП (при этом могут потребоваться особые меры предосторожности, связанные с изучением биоматериала пациентов с COVID-19), но и в выборе тактики лечения [63].
При этом роль мочевых маркеров острого повреждения (или стресса) в диагностике COVID-19-ОПП остается неясной. В одной работе изучалась активность тканевого ингибитора металлопротеиназы-2 (TIMP-2) и белка-7, связывающего инсулиноподобный фактор роста (IGFBP-7)
у пациентов с COVID-19-ОПП. Было установлено, что при высоком уровне [TIMP-2]x[IGFBP-7] потребность в ЗПТ у них была выше, чем при низком уровне [TIMP-2]x[IGFBP-7] [64]. В том же исследовании продемонстрировано, что повышенный уровень альфа1-микроглобулина в моче госпитализированных пациентов связан с последующим развитием ОПП [64]. Сообщалось также, что у пациентов с COVID-19-ОПП уровень системных маркеров воспаления, особенно ферритина, С-реактивного белка, прокальцитонина и лактатдегидрогеназы, был выше, чем у пациентов с COVID-19 и нормальной функцией почек [17].
Факторы риска
Каковы факторы риска ОПП у пациентов с COVID-19?
Рекомендации
1. Предлагаем стратифицировать пациентов по риску ОПП на основании сопутствующих заболеваний и демографических данных. Информация о наличии ХБП в анамнезе и других сопутствующих заболеваниях, а также демографические данные должны быть получены для определения риска COVID-19-ОПП (табл. 2) (уровень доказательности: 2C).

2. При оценке пациентов с COVID-19 необходимо учитывать факторы риска ОПП, ассоциированного с внебольничной или госпитальной пневмонией, тяжесть течения заболевания, процесс лечения и показания к госпитализации или переводу в ОРИТ (уровень доказательности не присвоен).
Обоснование
Стратификация риска необходима для оптимизации мониторинга и начала профилактики и/или раннего лечения у пациентов, которым это принесет наибольшую пользу. Сведения из Китая и США показывают, что мужской пол, пожилой возраст, негроидная раса, сахарный диабет, ХБП, гипертензия, сердечно-сосудистые заболевания, застойная сердечная недостаточность и высокий индекс массы тела связаны с COVID-19-ОПП [8, 16, 17]. Пациентам с COVID-19, страдавших ОПП, чаще требовались вазопрессоры и ИВЛ [16, 17]. Однако данных о критериях госпитализации пациентов в ОРИТ, так же как и о связи между лекарственными препаратами и процедурами (хирургическими вмешательствами, введением контрастного вещества) и COVID-19-ОПП пока нет.
Показатели частоты ОПП значительно различаются как между географическими регионами, так и между различными системами здравоохранения. В китайских работах сообщается о меньшей распространенности ОПП в Китае [2–6, 8–12, 65 ,66], чем в США [13, 14, 16, 17, 19, 67, 68] и Европе [60]. Эта разница может объясняться различиями в популяционных исследованиях. Так, например, в китайских отчетах у пациентов было меньше сопутствовавших заболеваний, и они были госпитализированы с менее тяжелыми респираторными заболеваниями или ОРДС, чем пациенты из других выборок (табл. 1). На сегодняшний день нет данных о факторах риска COVID-19-ОПП в разные лечебные учреждения (например, сравнение данных из академических клиник и общественных госпиталей или из сельских больниц и городских клиник). И хотя по сообщениям из Нью-Йорка, США и Китая наблюдается значительный рост числа госпитализаций по поводу COVID-19, ни одно многоцентровое исследование не учитывало влияния внутрибольничной инфекции и распределения ресурсов на риск развития ОПП.
Клиническое течение и прогноз
Каково клиническое течение и прогноз COVID-19-ОПП?
Рекомендации
1. Рекомендуем наблюдение за пациентами на предмет развития ОПП в течение госпитализации и восстановительного периода после выписки из стационара (уровень доказательности: 1B).
2. Гистологическое исследование нефробиоптата, особенно в случаях выраженной протеинурии, может помочь в дифференциальной диагностике потенциальных причин ОПП (уровень доказательности не присвоен).
Обоснование
Географические и региональные различия в течении и исходах COVID-19-ОПП признаны и имеют доказательную базу. Однако влияние такого фактора, как ограничение ресурсов, было изучено недостаточно. В целом пациенты с COVID-19-ОПП с большей вероятностью попадут в ОРИТ и скорее им потребуются ИВЛ и вазопрессоры, чем пациентам без ОПП. В нескольких исследованиях изучалась временная взаимосвязь между началом или тяжестью инфекции SARS-CoV-2 и развитием ОПП. В одной работе показано, что примерно у трети пациентов с COVID-19 ОПП было диагностировано при поступлении или оно развивалось в течение 24 часов после госпитализации [16]. В другом исследовании сообщалось о значительной задержке в манифестации ОПП у пациентов с COVID-19 (в среднем 15 дней с момента появления симптомов) [10], что потенциально отличало COVID-19-ОПП от ОПП, вызванного другими системными инфекциями. Отмечалась временная ассоциация COVID-19-ОПП с интубацией, однако выраженность этой связи и ее вклад в прогрессирование заболевания, полиорганную дисфункцию или периинтубационные гемодинамические изменения, до конца не ясны [16, 17].
Имеются данные, демонстрирующие высокую распространенность рабдомиолиза у пациентов с COVID-19-ОПП (7–20%) [8, 17]. Гиперкалиемия выявлена у 23% пациентов с COVID-19-ОПП и зачастую была связана с метаболическим ацидозом [17, 69]. Как упоминалось ранее, у значительной части пациентов, особенно у тех, кто был в критическом состоянии и/или имел манифестированное ОПП, наблюдались гематурия и протеинурия [8, 16, 17, 64]. При гистологической оценке серии аутопсий и биопсий из отчетов о случаях пациентов с выраженной протеинурией обнаружено несколько различных морфологических вариантов поражения почек при COVID-19 по типу коллапсирующей гломерулопатии, повреждения проксимальных канальцев и тромботической микроангиопатии, что может быть использовано при выборе тактики лечения [23–25, 27, 32, 70]. Важно отметить, что ряд факторов, специфичных для COVID-19, в частности использование ИВЛ, применение антикоагулянтов, логистические сложности, включая риск заражения, затрудняют проведение нефробиопсии у пациентов с подозрением на ОПП.
Вопрос продолжительности COVID-19-ОПП изучен недостаточно и только в одном исследовании сообщалось о восстановлении функции почек [8]. COVID-19-ОПП среди госпитализированных пациентов служит независимым фактором риска смерти от всех причин и составляет от 35 до 80%, среди пациентов, которым требуется ЗПТ, достигает 75–90%. [5, 8, 16, 17, 60].
Рекомендации по дальнейшему исследованию
1. В будущих исследованиях необходимо рассмотреть влияние географических различий, особенностей систем здравоохранения и пропускной способности больниц, готовности систем здравоохранения и социальных детерминант к эпидемиологии COVID-19-ОПП, включая анализ того, как эти факторы влияют на факторы риска, лечение и исходы COVID-19.
2. Необходимо включать информацию об удельном весе различных сопутствовавщих заболеваниях у пациентов с ОПП и без него, включая потенциальные факторы риска развития COVID-19-ОПП до и после госпитализации.
3. При постановке диагноза COVID-19-ОПП следует определить его различные фенотипы на основе клинических проявлений, характера повреждения, продолжительности и течения, а также его трансформацию в ХБП.
4. При описании COVID-19-ОПП следует указывать степень тяжести заболевания COVID-19 при диагнозе ОПП и вмешательства, которые использовались для лечения человека.
5. Дальнейшего изучения требует оценка взаимосвязи между маркерами системного процесса (например, ферритина, D-димера и внелегочными проявлениями) и тяжестью поражения легких с развитием, течением и исходами COVID-19-ОПП. Необходимо изучить факторы риска развития тяжелого ОПП (3-я стадия заболевания или необходимость начала ЗПТ) с целью оптимизации подходов к профилактике этого клинического состояния.
6. Для диагностики и оценки прогноза COVID-19-ОПП необходимо изучить механизм, время появления и клиническое значение традиционных маркеров ОПП (протеинурия и гематурия), а также новых биомаркеров и сопоставить полученные данные с системными проявлениями заболевания.
7. При выписке из стационара или из ОРИТ следует оценивать ранние и поздние исходы COVID-19-ОПП: смертность, восстановление функции почек, отдаленные результаты. Эти данные необходимо анализировать в разных странах.
Профилактика и лечение ОПП
Стандартные стратегии лечения
Какие стандартные стратегии оказания медицинской помощи применимы для профилактики и лечения ОПП у пациентов с COVID-19?
Рекомендации
1. Стратегии, основанные на рекомендациях KDIGO и других соответствующих протоколах, подходят для профилактики и лечения COVID-19-ОПП с учетом риска и стадии процесса (табл. 3) (уровень доказательности не присвоен).
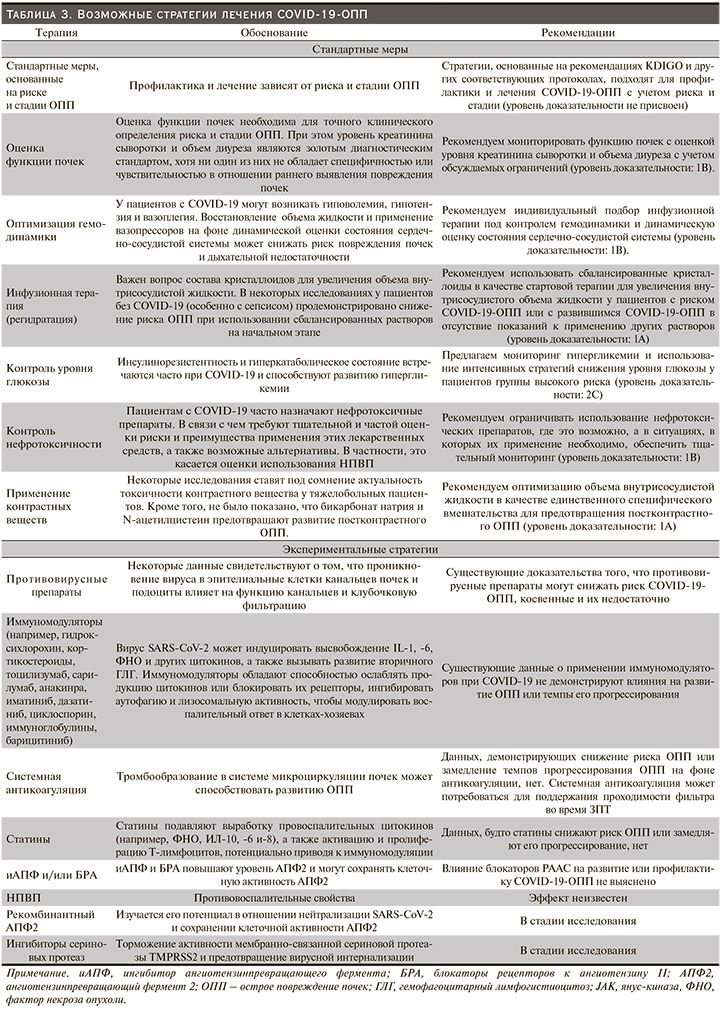
2. Для пациентов с COVID-19, находящихся в критическом состоянии, рекомендуем индивидуальную инфузионную терапию с динамической оценкой гемодинамики и состояния сердечно-сосудистой системы (уровень доказательности: 1B).
3. В качестве стартовой терапии рекомендуем использовать сбалансированные кристаллоидные растворы для увеличения объема внутрисосудистой жидкости у пациентов с риском ОПП или с ОПП в отсутствие показаний к применению других растворов (уровень доказательности: 1А).
4. Рекомендуем по возможности ограничивать применение нефротоксических препаратов и проводить тщательный мониторинг в случаях, когда их применение необходимо (уровень доказательности: 1B).
Обоснование
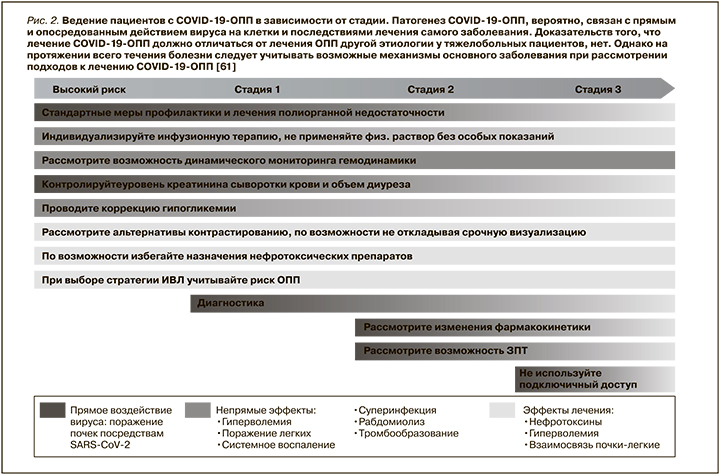
Несмотря на наличие ряда специализированных протоколов ведения больных ОПП в зависимости от этиологии, конкретных доказательств, позволяющих считать, что лечение COVID-19-ОПП у тяжелобольных пациентов должно отличаться от такового при других причинах, в настоящее время нет. Таким образом, большинство мер, предложенных группой экспертов KDIGO и в других клинических рекомендациях, подходят для пациентов с COVID-19 [61, 71] (табл. 3 и рис. 2).
Гиповолемия – частое явление на ранней стадии COVID-19, в связи с чем индивидуализация инфузионной терапии имеет решающее значение [72]. В рандомизированном клиническом исследовании (РКИ) продемонстрировано, что применение в ОРИТ инфузионной терапии и вазопрессоров с динамической оценкой гемодинамики позволило снизить риск ОПП и дыхательной недостаточности у пациентов с септическим шоком [73]. Мы предполагаем, что подобная стратегия может оказаться полезной в снижении риска COVID-19-ОПП у госпитализированных пациентов.
С момента публикации рекомендаций KDIGO по ОПП в 2012 г. [61] появилось больше доказательств важности состава кристаллоидов, используемых для увеличения объема жидкости [74–77]. В исследовании SMART (исследование изотонических растворов и основных нежелательных почечных событий) показано, что по сравнению с физиологическим раствором использование сбалансированных кристаллоидов снижало композитную составную точку, включающую смерть, потребность в ЗПТ или стойкую дисфункцию почек у взрослых тяжелобольных пациентов с наибольшим эффектом у пациентов с сепсисом [78]. Подобный результат был также получен от пациентов в периоперационном периоде, не находившихся в критическом состоянии [75, 76]. Однако по результатам объединенного анализа трех систематических обзоров исследований в группах взрослых и детей не было продемонстрировано снижения частоты ОПП или смертности при применении сбалансированных кристаллоидов по сравнению с физиологическим раствором [79–81]. Учитывая возможный вред, причиняемый использованием 0,9%-ного физиологического раствора, рекомендуем использовать сбалансированные растворы, если нет показаний к применению других (например, 0,9%-ный физиологический раствор при гипохлоремической гиповолемии).
С целью профилактики или уменьшения последствий ОПП, связанного с приемом лекарственных препаратов, появилось несколько стратегий, наиболее важный из которых контроль над их применением. По результатам нескольких одно- и многоцентровых совместных исследований, введение электронных медицинских карт для выявления детей, подвергшихся воздействию ≥3 нефротоксических препаратов, привело к снижению частоты ОПП [40, 82, 83]. Вместе с тем нередко наблюдается применение нескольких нефротоксических препаратов пациентами с COVID-19 и высоким риском ОПП, что представляется важным и требует надлежащего контроля.
Стратегии, связанные с COVID-19
Какие вмешательства в отношении COVID-19 потенциально полезны для профилактики и лечения ОПП?
Рекомендации
1. Пациенты с COVID-19-ОПП должны лечиться в соответствии со стандартами, основанными на рекомендациях KDIGO (уровень доказательности не присвоен).
2. Предлагаем, когда это возможно, применение ИВЛ в отношении пациентов с COVID-19 для снижения риска ОПП (уровень доказательности: 2C).
Обоснование
В отсутствие специального лечения COVID-19-ОПП оно должно соответствовать текущим консенсусным рекомендациям по ОПП (табл. 3). Роль противовирусных препаратов, иммуномодулирующих средств (включая кортикостероиды), ингибиторов РААС, статинов и антикоагулянтов в профилактике и/или уменьшении ОПП остается неизвестной [2, 83–88] (табл. 3). В отношении ациентов с тяжелой формой COVID-19 рекомендуется использовать стратегию защитной механической ИВЛ, как и в случае с другими формами ОРДС. Однако по причинам, указанным выше, чрезмерное ПДКВ может приводить к повышению системного венозного давления и уменьшению перфузии почек с последующим снижением СКФ [54]. Поэтому рекомендуется индивидуальный подбор ПДКВ с учетом его рисков и преимуществ; при этом оптимальная стратегия вентиляции будет зависеть от степени, объема поражения и комплаентности легких [89]. Существующие данные демонстрируют, что прон-позиция при дыхательной недостаточности не влияет на риск ОПП [90].
Следует отметить, что в исследовании ACTT-1 (Адаптивная терапия Covid-19) сообщалось о сокращении времени выздоровления взрослых пациентов, госпитализированных с COVID-19, на фоне терапии ремдесивиром по сравнению с плацебо и свидетельствовало об инфекции нижних дыхательных путей [84]. Кроме того, в исследовании Recovery было продемонстрировано, что применение дексаметазона снижало 28-дневную смертность среди госпитализированных пациентов с COVID-19, причем наибольший эффект наблюдался у пациентов, получавших при рандомизации либо инвазивную механическую ИВЛ, либо только кислородотерапию [84, 91]. Ни в одном из этих исследований не сообщалось о влиянии на функцию почек, однако со временем может появиться более подробная информация.
Патогенез COVID-19-ОПП, вероятно, связан с прямым и опосредованным действием вируса на клетки и последствиями лечения самого заболевания. Доказательств того, что лечение COVID-19-ОПП должно отличаться от такового ОПП другой этиологии у тяжелобольных пациентов, нет. Однако на протяжении всего течения болезни следует учитывать возможные механизмы основного заболевания при рассмотрении подходов к лечению COVID-19-ОПП [61].
Особенности лечения ОПП
Что следует изменить в лечении пациентов с COVID-19, у которых развилось ОПП?
Рекомендации
1. Рекомендуем учитывать изменение фармакокинетики и влияние, оказываемое на почки препаратами, применяемыми в лечении COVID-19, при назначении лекарственных средств и коррекции дозировок (уровень доказательности: 1C).
2. COVID-19 ассоциирован с недостаточностью питания или мальнутрицией, однако остается неясным, требуется ли пациентам с COVID-19-ОПП особый режим питания (уровень доказательности не присвоен).
Обоснование
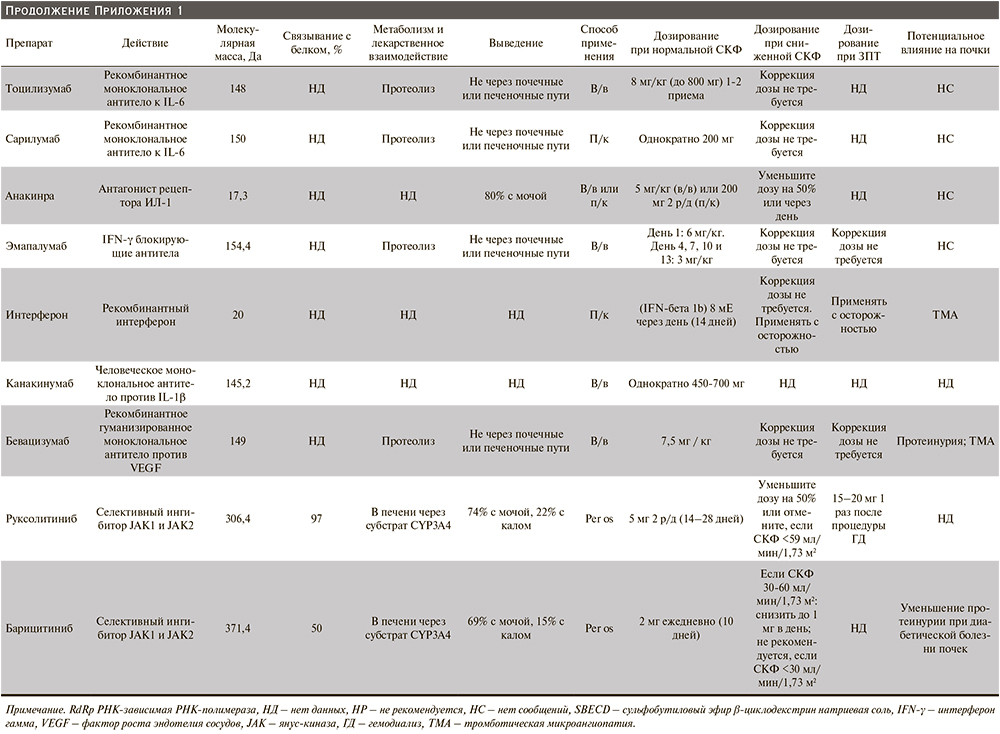
Некоторые препараты или их метаболиты, используемые в лечении пациентов с COVID-19, выводятся и/или метаболизируются почками и требуют коррекции дозы или противопоказаны пациентам с нарушением функции почек или во время ЗПТ. В связи с чем следует принимать во внимание нарушение фармакокинетики у пациентов с ОПП при назначении терапии антибиотиками и антикоагулянтами (Приложение 1).
Пациенты с COVID-19 подвержены риску мальнутриции в результате действия различных факторов, таких как длительная иммобилизация, катаболические изменения и уменьшение приема пищи [53,92], тем не менее специальных исследований по оптимизации питания пациентов с COVID-19-ОПП не проводилось. В связи с чем следует придерживаться текущих согласованных рекомендаций по питанию тяжелобольных пациентов [61, 93–95]. Так, потребление белка следует постепенно увеличивать до 1,3–1,5 г/кг в день пациентам с ОПП, не получающих ЗПТ, до 1,0–1,5 г/кг в день пациентам, находящимся на интермиттирующей ЗПТ, и до 1,7 г/кг в день пациентам, получающим непрерывную ЗПТ (НЗПТ). Следует учитывать, что раннее энтеральное питание считается более предпочтительным, чем парентеральное, при этом прон-позиция служит противопоказанием [61, 96].
Рекомендации по дальнейшему исследованию
1. Определить роль противовирусных препаратов, стероидов и системных антикоагулянтов в развитии и прогрессировании ОПП.
2. Определить фармакокинетику противовирусных и иммуномодулирующих препаратов на разных стадиях ОПП, его трансформации в ОБП, а также при различных видах ЗПТ.
3. Изучить нутритивный статус и энергетические затраты пациентов с COVID-19-ОПП и определить стратегии оптимизации их нутритивной поддержки в зависимости от вида проводимой ЗПТ.
Заместительная почечная терапия
Особенности пациента
Доступны ли адекватные ресурсы ЗПТ, существуют ли индивидуальные особенности у пациента с COVID-19-ОПП в отношении сосудистого доступа, времени начала, модальности или дозы ЗПТ?
Рекомендации
1. Рекомендуем использование ультразвука при выполнении сосудистого доступа с целью проведения ЗПТ на основе рекомендаций KDIGO по ОПП (уровень доказательности: 1A).
2. Выбор локализации сосудистого доступа, время начала и модальность ЗПТ должны основываться на потребностях пациента, врачебной квалификации, доступности персонала и оборудования (табл. 4, 5) (уровень доказательности не присвоен).

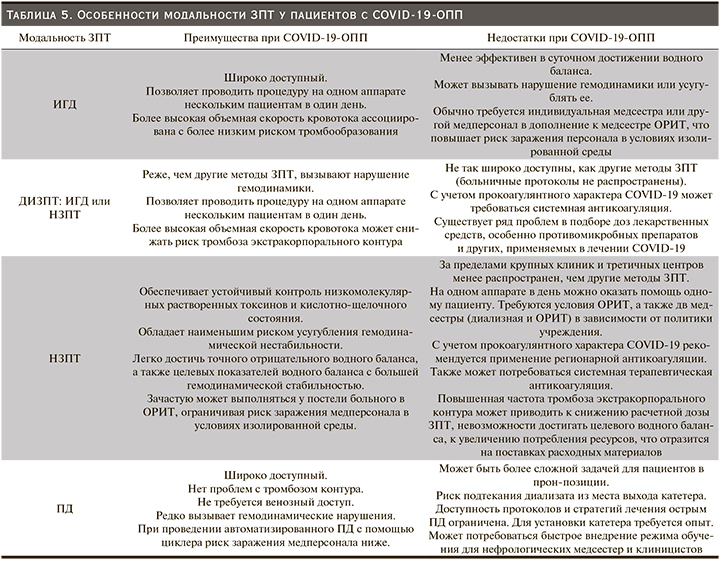
3. Поскольку COVID-19 часто вызывает состояние гиперкоагуляции, при выборе метода НЗПТ предлагаем непрерывный вено-венозный гемодиализ (НВВГД) или непрерывную венозно-венозную гемодиафильтрацию (НВВГДФ) для уменьшения объема ультрафильтрации с целью снижения риска тромбоза экстракорпорального контура (уровень доказательности: 2C).
Обоснование
Ряд клинических исследований и мета-анализов, посвященных изучению вопроса начала ЗПТ тяжелобольных пациентов, не продемонстрировали различий в смертности или восстановлении функции почек в отсутствие неотложных показаний [97–100]. Поэтому решение о начале ЗПТ пациентов с COVID-19-ОПП должно приниматься индивидуально с учетом клинического состояния (например, с целью коррекции гемодинамики у пациентов с тяжелой гипоксемией), а не только на основании стадии ОПП или СКФ [61, 101]. Выбор модальности ЗПТ будет зависеть от региональных особенностей и доступности ресурсов, поскольку данных о явных преимуществах какого-либо конкретного метода ЗПТ пока нет. Однако гемодинамически нестабильными пациентами непрерывная терапия может переноситься лучше, способствовать оптимизации объема внутрисосудистой жидкости и нутритивного статуса, что особенно важно для больных COVID-19 [61].
Выбор дозы ЗПТ должен рассчитываться на основе рекомендаций KDIGO и корректироваться в ответ на изменения клинического, физиологического и/или метаболического статуса [61, 102, 103]. У пациентов с COVID-19 коагулопатия, приводящая к тромбообразованию, может прерывать длительные сеансы ЗПТ и существенно влиять на достижение расчетной дозы, что потребует ее коррекции [104, 105]. При использовании НЗПТ происходит уменьшение объема ультрафильтрации и снижение риска тромбоза экстракорпорального контура [106]. Эффективным альтернативным вариантом ЗПТ для пациентов с COVID-19-ОПП, которым противопоказаны антикоагулянты, может быть перитонеальный диализ (ПД) [107–110].
Выбор между яремным или бедренным сосудистым доступом для пациентов с COVID-19 основан на опыте и предпочтениях клинициста. У пациентов с индексом массы тела >28 кг/м2 внутренние яремные вены (ВЯВ) имеют самый низкий уровень инфицирования [111, 112]. Более высокая частота дисфункции сосудистого доступа наблюдается при катетеризации левой ВЯВ по сравнению с ПЯВ или бедренной веной, что, по всей видимости, служит результатом расположения кончика катетера на недостаточной глубине в этой анатомической области [61, 111, 113]. Использование ультразвука при выполнении сосудистого доступа через ВЯВ повышает вероятность успешного расположения катетера, снижает риск осложнений процедуры и сокращает время на ее выполнение.
Стратегии антикоагуляции
Какова оптимальная стратегия антикоагуляции при проведении ЗПТ у пациентов с COVID-19-ОПП?
Рекомендации
1. Рекомендуем пациентам с COVID-19-ОПП во время процедур экстракорпоральных ЗПТ назначать антикоагулянты (уровень доказательности: 1С).
2. Предлагаем тщательно контролировать работу контура ЗПТ, чтобы обеспечить его максимальную проходимость, поскольку эффективность начальной стратегии антикоагуляции может быть достигнута не всеми пациентами; мы также рекомендуем, чтобы каждый центр разработал стратегию пошагового усиления антикоагуляции при проведении ЗПТ и/или альтернативный вариант (уровень доказательности: 2C).
Обоснование
KDIGO рекомендует использовать антикоагулянты при проведении НЗПТ, кроме случаев, когда это противопоказано или пациент уже получает системную антикоагуляцию [61]. У многих пациентов с COVID-19 развивается состояние гиперкоагуляции, что может приводить к преждевременному выходу из строя экстракорпорального контура ЗПТ [114–117]. Кроме того, по результатам анонимного опроса экспертов ADQI, разработавших настоящий Консенсусный документ, 64% респондентов заявили о высокой частоте нарушений работы экстракорпорального контура или его тромбоза во время ЗПТ пациентов с COVID-19 и определили это как проблему, требующую «серьезного пересмотра протоколов лечения и антикоагуляции» и/или «значительно осложняющую уход за пациентом даже после оптимизации антикоагуляции» по сравнению только с 3 из 25 (12%) экспертов, которые сообщили об отсутствии различий в частоте нарушений работы экстракорпорального контура ЗПТ по сравнению с таковой, наблюдаемой у пациентов без COVID-19.
Ввиду прокоагулянтного характера течения COVID-19 у пациентов, получающих ЗПТ, с целью снижения риска тромбоза экстракорпорального контура чаще использовалась терапевтическая титруемая антикоагуляция. Тем не менее исследований, способных помочь в выборе стратегии антикоагуляции, в настоящее время нет. Некоторые стратегии антикоагуляции могут быть широко использованы при экстракорпоральных вариантах ЗПТ у пациентов с COVID-19, включая регионарную цитратную антикоагуляцию при НЗПТ, терапевтическую титруемую антикоагуляцию нефракционированным или низкомолекулярным гепаринами, прямые ингибиторы тромбина и комбинации этих подходов.
В отношении пациентов с постоянным тромбозом экстракорпорального контура во время НЗПТ, несмотря на антикоагуляцию, следует рассматривать возможность замены модальности ЗПТ на ИГД, ДИЗПТ или острый ПД.
Незапланированные прерывания при выполнении НЗПТ, ДИЗПТ или ИГД из-за недостаточности контура увеличивают скорость потребления одноразовых расходных материалов, риск заражения медсестер и другого персонала, риски недостаточного контроля электролитов, кислотно-щелочного состояния, водного баланса и влияют на фармакокинетику лекарственных средств. Поэтому важно стремиться к максимальному использованию возможностей любого контура ЗПТ, чтобы сохранить расходные материалы, поскольку это может создавать проблему в условиях возможных ограничений поставок, связанных с пандемией. В условиях повышенного спроса на ЗПТ мониторинг срока службы контура НЗПТ имеет первостепенное значение как на индивидуальном, так и на организационном уровне. При низкой эффективности использования контура предлагаем незамедлительно внедрять пошаговый подход к проведению антикоагуляции с целью минимизации потребления расходных материалов и сохранения ресурсов.
Планирование в случае внезапного повышения потребности в ЗПТ
Каковы основные аспекты, на которые нужно обратить внимание при планировании в случае внезапного повышения потребности в ЗПТ?
Рекомендации
1. Необходим скоординированный ответ на увеличение спроса на ЗПТ и/или сбой в поставах расходных материалов на организационном, региональном и национальном уровнях (уровень доказательности не присвоен).
2. Рассмотрите возможность коррекции модальности ЗПТ, а также показаний, антикоагуляции и дозы ЗПТ в качестве местного ответа на дисбаланс предложения и/или спроса, чтобы ограничить потребление дефицитных ресурсов и обеспечить эффективную терапию наибольшему количеству пациентов (уровень доказательности не присвоен).
Обоснование
При любых ситуациях, связанных с быстрым увеличением потребности в ОРИТ, существует вероятность ограничения доступности ЗПТ. Чтобы подготовиться к подобным ситуациям, рекомендуем системам здравоохранения создавать, поддерживать и периодически обновлять план действий «в случае внезапного повышения потребности в ЗПТ» (рис. 3). Резкий рост заболеваемости COVID-19 может вызывать непредвиденную нехватку аппаратов для проведения ЗПТ и/или расходных материалов и растворов для диализа [118]. Кроме того, безопасность регулярных поставок может быть под угрозой, что еще больше усугубит местный дефицит ресурсов [119, 120]. В рамках локального ответа на увеличение потребности в ЗПТ можно расширить применение различных методов ЗПТ (НЗПТ, ДИПЗТ, ИГД и острый ПД) для оказания помощи максимальному числу пациентов. Несколько учреждений сообщали о внедрении острого ПД во время первого резкого прироста числа случаев COVID-19 [108, 110, 121–124]. На подготовительном и раннем этапах реагирования больницы и региональные системы здравоохранения должны вести постоянный учет имеющихся аппаратов ЗПТ, расходных материалов и растворов для диализа, а также делать прогнозы востребованности ЗПТ с целью оптимального использования ресурсов. Кроме того, подготовка кадров и реагирование на рост числа случаев COVID-19 требуют необходимости обучения медсестер для соответствующего обеспечения человеческими ресурсами [125].
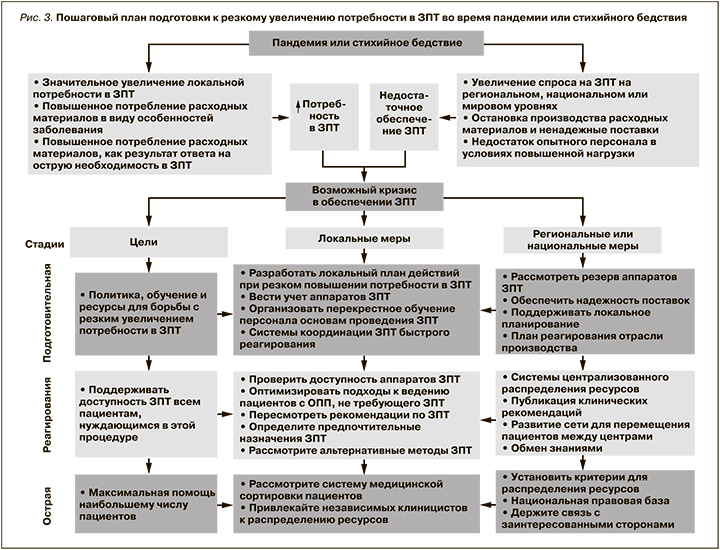
Чрезмерное использование расходных материалов для ЗПТ как из-за повышенного спроса, так и из-за низкой производительности контура может вызывать критический дефицит ресурсов и ставить под угрозу возможность проведения ЗПТ всем пациентам, кому это может быть необходимо. При этом активная коррекция электролитных нарушений, поддержание кислотно-щелочного баланса, борьба с гипергидратацией могут нивелировать потребность в ЗПТ или предотвращать ее начало, тем самым позволяя оптимизировать распределение ресурсов в условиях их дефицита [126, 127]. В зависимости от прогнозируемой нехватки аппаратов ЗПТ или расходных материалов может формироваться стратегия локального реагирования: уменьшение скорости объемного кровотока для снижения потребления цитрата, коррекция интенсивности ЗПТ с целью экономии растворов или запуск более коротких по времени и скоростных процедур ЗПТ с высоким клиренсом для лечения большего числа пациентов на одном аппарате [128]. Наконец, в центрах с соответствующими ресурсами и опытом более ранний переход на ИГД с онлайн-гемодиафильтрацией или острый ПД может оказаться полезным [107, 108, 110].
Несмотря на соответствующее планирование, высокие темпы роста числа случаев COVID-19 могут сделать невозможным оказание помощи всем, кому это может быть необходимо. Однако подробное обсуждение этических и юридических аспектов при этих обстоятельствах выходит за рамки данного консенсусного документа.
Рекомендации по дальнейшему исследованию
1. Разработайте регистр пациентов с тяжелой формой COVID-19-ОПП, чтобы выяснить, влияют ли различия в клинических подходах проведения ЗПТ и производительность контура на клинические исходы.
2. Учитывая особые проблемы, связанные с тромбозом контура при проведении ЗПТ пациентам с COVID-19-ОПП, рекомендуем запланировать и инициировать проспективные РКИ для изучения различных стратегий антикоагуляции при НЗПТ и ДИЗПТ.
3. Рекомендуем разработать программу операционных исследований, включая оценку поставок, с целью изучения локальных, региональных и национальных мер реагирования на дисбаланс спроса и предложения ЗПТ во время пандемии COVID-19 и разработки научно-обоснованных стратегий для их реализации в будущих чрезвычайных ситуациях.
4. Рекомендуем в будущих обсервационных исследованиях изучать последствия отсроченного ЗПТ и применения альтернативных нестандартных методов в ответ на недоступность ЗПТ, чтобы определить, в какой степени меры, разработанные и реализованные во время пандемии, были безопасными и эффективными.
Экстракорпоральное очищение крови (ЭОК)
Биологическое обоснование
Каково потенциальное биологическое обоснование использования («не ренального») ЭОК у тяжелобольных пациентов с COVID-19?
1. Воспалительные цитокины, ДАМП, патоген-ассоциированные молекулярные паттерны (ПАМП), включая эндотоксины и частицы SARS-CoV-2, потенциально способствуют развитию полиорганной недостаточности и повышают смертность среди тяжелобольных пациентов с COVID-19.
2. Было показано, что методы ЭОК удаляют цитокины, ДАМП и ПАМП, включая эндотоксины и циркулирующие вирусные частицы.
Патоген-ассоциированные молекулярные паттерны (ПАМП) представляют собой молекулы, высвобождаемые патогенами (особенно бактериями), которые могут вызывать воспаление, часто передавая сигналы через специфические рецепторы, такие как Toll-подобные рецепторы. Общие ПАМП включают компоненты бактериальной клеточной стенки (например, эндотоксин, липотейхоевые кислоты), нуклеиновых кислот, обычно связанных с вирусами и др.
Обоснование
ЭОК было предложено в качестве возможной адъювантной терапии тяжелобольных пациентов с COVID-19. Метод основан на удалении циркулирующих иммунных медиаторов, как следствие – на предотвращении повреждения органов и уменьшении явлений полиорганной недостаточности [129,130] (рис. 4). Последняя в свою очередь при COVID-19 может быть результатом распространения неконтролируемого иммунного ответа организма, включающего высвобождение различных иммунных медиаторов, таких как цитокины, ДАМП и ПАМП [35, 65, 131, 132]. Подобный вариант неконтролируемого иммунного ответа встречается также при сепсисе и характеризуется гипервоспалением, высвобождением цитокинов, эндотелиальной дисфункцией и гиперкоагуляцией [66, 133–135]. Однако, как обсуждалось ранее, активация цитокинового звена обычно не так выражена при COVID-19, как при синдромах SARS и MERS [43–45], бактериальном сепсисе или у пациентов, получающих CAR-T-терапию [46, 47]. Более того, данных о преимуществах или побочных эффектах ЭОК у пациентов с COVID-19 в настоящее время нет. В связи с чем предлагаем тщательно отбирать пациентов, у которых рассматривается возможность проведения ЭОК.

ЭОК было предложено в качестве возможной адъювантной терапии для тяжелобольных пациентов с COVID-19 на основании того, что удаление циркулирующих иммунных факторов, способных вызывать прогрессирование болезни и/или развитие полиорганной недостаточности, может улучшать исходы заболевания. Следует отметить, что эффективность ЭОК для пациентов с COVID-19 и/или COVID-19-ОПП в клинических исследованиях не оценивалась, в связи с чем должны быть изучены все терапевтические возможности этого метода. ЭОК следует рассматривать в качестве дополнительной терапии к медикаментозному лечению. Однако изменения патофизиологии патологического процесса в течение заболевания могут требовать коррекции подходов к лечению. В связи с этим ЭОК-терапия может быть представлена как одним методом, так и последовательной сменой нескольких методов в зависимости от наличия доказательной базы и патофизиологического обоснования.
Методы ЭОК
Какие методы ЭОК потенциально можно использовать для удаления циркулирующих молекул, участвующих в патофизиологии COVID-19?
1. Метод гемоперфузии может удалять медиаторы воспаления, ДАМП и ПАМП, включая частицы SARS-CoV-2.
2. Терапевтический плазмообмен может удалять медиаторы воспаления и белки, связанные с гиперкоагуляцией.
3. НЗПТ с поверхностно-модифицированными мембранами AN69 или полиметилметакрилатными мембранами может удалять молекулы-мишени путем адсорбции, тогда как НЗПТ с мембранами со средней (МСО) или высокой (HCO) точкой отсечения может удалять молекулы-мишени путем диффузии или конвекции.
Обоснование
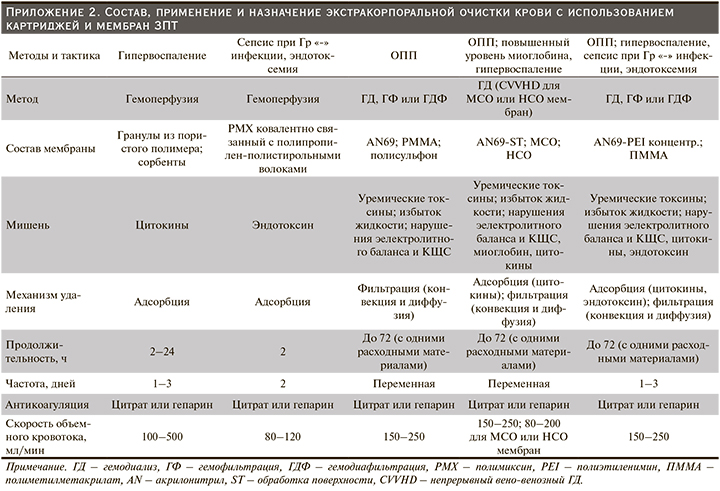
Многие учреждения здравоохранения допустили возможность экстренного применения различных методов ЭОК с целью удаления молекул, потенциально ответственных за развитие иммуновоспалительного ответа от тяжелобольных пациентов с COVID-19. Однако обсуждаемые методы еще не были изучены в этой когорте больных (Приложение 2). Активность сорбентов для гемоперфузии может быть направлена на удаление вирусных частиц, цитокинов и ДАМП у пациентов с высоким уровнем эндотоксинов [136–140]. В небольшом РКИ (EUPHAS) продемонстрировано, что использование гемоперфузии в отношении пациентов с септическим шоком было ассоциировано с улучшением функции органов и увеличением выживаемости [141], однако в более крупном РКИ (EUPHRATES) эти данные не подтвердились [136]. В результате проведенного пост-хок-(post-hoc)-анализа исследования EUPHRATES в подгруппе пациентов с активностью эндотоксина обнаружен возможный терапевтический эффект выживаемости [140]. В другом РКИ установлено, что терапевтический плазмообмен улучшал гемодинамику, вызывал благоприятные изменения цитокинового профиля и улучшал выживаемость пациентов с септическим шоком [142, 143]. Теоретически удаление воспалительных цитокинов во время терапевтического плазмообмена может принодить определенную пользу пациентам с COVID-19 при гипервоспалении и гиперкоагуляции [144]. При проведении НЗПТ с применением MCO и HCO мембран или с адсорбционных мембран могут быть элиминированы цитокины или миоглобин, а также потенциально предупреждено индуцированное миоглобином ОПП [145, 146].
Критерии использования ЭОК
Каковы возможные биологические и/или клинические критерии для начала, мониторинга и прекращения ЭОК у тяжелобольных пациентов с COVID-19?
Рекомендации
1. Не существует консенсуса в отношении использования ЭОК или конкретных пороговых значений для биологических и клинических критериев начала, мониторинга или прекращения ЭОК у тяжелобольных пациентов с COVID-19 (уровень доказательности не присвоен).
Обоснование
При выборе метода ЭОК-терапии следует учитывать принцип работы, патофизиологические особенности и возможные мишени, на которые направлено его действие. Перед выполнением процедуры следует оценивать следующие клинические параметры пациента: температуру тела, гемодинамический статус, потребность в вазопрессорной терапии, респираторный статус и оксигенацию, наличие полиорганной недостаточности, функции сердца и почек, а также лабораторные параметры, такие как число лимфоцитов, концентрация цитокинов, уровни ферритина, лактатдегидрогеназы, D-димера, моноцитарной экспрессии HLA, миоглобина, тропонина, С-реактивного белка, активности эндотоксина, прокальцитонина и результаты посева крови. Однако точные показания к проведению ЭОК пациентам с COVID-19 еще предстоит определить. В одном клиническом исследовании для элиминации эндотоксинов у пациентов с сепсисом ЭОК обычно применялся в течение 48 часов подряд, в то время как в другом незавершившемся исследовании в группе больных COVID-19 изучается возможность применения ЭОК в течение 72 часов для выведения цитокинов [140, 146–149]. Вместе с тем данных относительно сроков начала или продолжительности использования этих методов лечения недостаточно, что требует дальнейшего изучения.
Рекомендации по дальнейшему исследованию
1. В будущих исследованиях следует оценивать способность ЭОК удалять молекулы-мишени и анализировать их кинетику для подтверждения патофизиологического обоснования использования ЭОК в отношении тяжелобольных пациентов с COVID-19.
2. Следует оценивать, связано ли использование ЭОК с улучшением краткосрочных исходов, включая профилактику и уменьшение полиорганной недостаточности?
3. Следует оценивать, возможно ли при применении ЭОК в составе комбинированной терапии или при последовательной смене методов достигнуть значимых биологических и/или клинических конечных точек?
4. Следует изучать способность гемоперфузии предотвращать или смягчать полиорганную недостаточность путем удаления вируса SARS-CoV-2 у пациентов с подтвержденной виремией.
5. Следует разработать биологические и клинические критерии, позволяющие идентифицировать пациентов, которые могут ответить и получить пользу от проведения ЭОК, а также параметры для мониторинга и прекращения терапии.
6. Следует рассматривать терапевтический плазмообмен в качестве альтернативного метода для уменьшения гиперкоагуляции, повышенной вязкости крови и гипервоспаления у пациентов с COVID-19, а также оценивать негативные последствия удаления потенциально полезных молекул (напр., антител против SARS-CoV-2).
7. Следует оценивать удаление лекарственных препаратов и нутриентов во время процедуры ЭОК и любое возможное негативное влияние на исход заболевания.

Выводы
Поражение почек на фоне SARS-CoV-2 встречается чаще, чем это предполагалось изначально, связано с заболеваемостью и смертностью. Патофизиология COVID-19-ОПП, по всей вероятности, многофакторная, что соответствует таковой при других формах ОПП. Показатели распространенности COVID-19-ОПП значительно различаются между исследованиями и регионами, хотя имеющиеся данные свидетельствуют о том, что заболеваемость у госпитализированных пациентов превышает 20%. Многие особенности, такие как факторы риска, вероятные механизмы и исходы заболевания, являются общими для COVID-19-ОПП и ОПП, невирусной этиологии, встречающейся в ОРИТ. Таким образом, многие рекомендации по лечению, а также профилактические меры, описанные в этом консенсусе, считаются общими для обоих. Положения по поводу ЗПТ также похожи, но с рекомендацией проведения более активной антикоагуляции и вероятностью смены режима и модальности ЗПТ в целях экономии ресурсов при резком росте числа случаев COVID-19. Поскольку потенциальный вклад системного воспаления в развитие полиорганной недостаточности при COVID-19, можно также рассмотреть возможность применения методов экстракорпоральной терапии. Следует заметить, что по мере появления новых результатов постоянно публикуются данные о COVID-19-ОПП, что может потребовать пересмотра настоящих рекомендаций.



