Введение
В настоящее время число работ, касающихся цитокинового статуса и его взаимосвязи со структурной перестройкой сердца при почечной недостаточности (ПН), немногочисленно. Скрытая пандемия хронической болезни почек (ХБП) и ее медикосоциальные значения требуют всестороннего изучения механизмов поражения сердечно-сосудистой системы независимо от стадии заболевания [1, 2]. Среди множества факторов риска в возникновении сердечно-сосудистых осложнений (ССО) при ПН особую роль играют провоспалительные цитокины [3].
F. Chow et al. (2004) показали, что прогрессирование ренальной дисфункции (интерстициальный фиброз и нефросклероз) сопровождается накоплением макрофагиальных клеток и моноцитов в почечной паренхиме [4]. В результате поддерживается «воспаление низкой интенсивности», которое в сочетании с метаболическими и гемодинамическими факторами приводит к дальнейшему снижению скорости клубочковой фильтрации (СКФ) [5]. Наиболее частым вариантом поражения сердца при ПН является гипертрофия левого желудочка (ГЛЖ) [6, 7]. Снижение СКФ увеличивает риск развития ГЛЖ в результате гиперактивации ренин-ангиотензин-альдостероновой системы (РААС) и др. [8].
Цель исследования: изучить взаимосвязь цитокинового профиля с типом ГЛЖ при ПН.
Материал и методы
Работа выполнена в клинических отделениях кафедр факультетской терапии КГМА им. И.К. Ахунбаева и терапии № 2 КРСУ им. Б.Н. Ельцина (Бишкек). В исследование были включены 55 пациентов с установленным диагнозом «хроническая болезнь почек» (ХБП) с признаками ПН [9]. Средний возраст обследованных лиц составил 52,7±13,3 года. Согласно протоколу исследования, обследованные больные были разделены на 2 группы: 1-ю составили 20 больных концентрической ГЛЖ, 2-ю группу – 35 больных эксцентрической ГЛЖ. Исходно пациенты исследуемых групп были сопоставимыми по возрасту и гемодинамическим параметрам (табл. 2).
Данная работа одобрена Комитетом по вопросам этики КГМА им. И.К. Ахунбаева. Критерии включения в исследование: наличие ПН и эхокардиографических (ЭхоКГ) признаков ГЛЖ. В исследование не включались лица с терминальной стадией ХБП, находившиеся на почечной заместительной терапии, а также пациенты с клапанными заболеваниями сердца.
Физикальное обследование включало клиническое измерение артериального давления (АД) по методу Короткова, определение индекса массы тела (ИМТ, кг/м2), подсчет частоты сердечных сокращений (ЧСС). Лабораторное исследование включило оценку показателей липидного спектра (общий холестерин – ХС, холестерин липопротеидов низкой плотности – ХС ЛПНП, холестерин липопротеидов высокой плотности – ХС ЛПВП и триглицеридов – ТГ), содержание мочевой кислоты, кальция, калия, натрия, креатинина крови. Дополнительно у всех пациентов определяли концентрацию цистатина С (мг/л), фактора некроза опухоли α (ФНО-α), интерлейкина-10 (ИЛ-10) в плазме крови. Уровни ФНО-α и ИЛ-10 в крови исследовали с применением набора реагентов ЗАО «Вектор-Бест» (Новосибирск, Россия) методом твердофазного иммуноферментного анализа. Учет результатов исследования проводили на сканере ChroMate Microplate Reader (США, 2015). Согласно данным фирмы изготовления набора, верхняя граница нормы ФНО-α и ИЛ-10 составила 6 и 31 пг/мл соответственно.
Тяжесть ПН определялась на основании СКФ, расчет которого проведен по CKD-EPI (на основе креатинина крови) и по формуле F.J. Hoek et al. (на основе цистатина С крови): СКФ=80,35/ЦистС-4,32 [10, 11].
Измерение центрального АД осуществлено на приборе «АнгиоСкан-01» (ООО «АнгиоСкан-Электроникс», Россия) [12]. ЭхоКГ выполнена на ультразвуковом сканере «Vivid Q» (США, 2014) по общепринятой методике. Изучали толщину стенок, размеры полости левого желудочка (ЛЖ), диаметр выходного тракта аорты (см) и левого предсердия (см) через парастернальный доступ по длинной оси ЛЖ. Также измеряли толщину межжелудочковой перегородки (МЖП, см) и задней стенки левого желудочка (ЗСЛЖ, см) в диастолу, определяли конечный диастолический (КДР, см) и конечный систолический размеры (КСР, см) ЛЖ. Систолическая функция ЛЖ оценивалась по его фракции выброса (ФВ, %), рассчитанной по формуле L.E. Teichholz et al. (1976) в отсутствие зон гипо- и акинеза [13]. С целью оценки диастолической функции ЛЖ в режиме импульсной допплерографии измеряли показатели трансмитрального диастолического потока (Е/А) и времени замедления кровотока раннего диастолического наполнения ЛЖ (DT). Масса миокарда ЛЖ (ММЛЖ) рассчитана по формуле R.B. Devereux et al. (1986): ММЛЖ (г)=0,8–{1,04-(КДР+МЖП+ЗСЛЖ)3-КДР3}+0,6 [14]. Критерии и типы ГЛЖ определены в соответствии с рекомендациями ЕОК (Европейского общества кардиологов) от 2018 г. [15]. Величины индексированной массы миокарда ЛЖ (ИММЛЖ) более 115 г/м2 у мужчин и более 95 г/м2 у женщин считали ЭхоКГ-признаками ГЛЖ. Показатель ИММЛЖ рассчитан как отношение массы миокарда ЛЖ к площади поверхности тела пациента. Индекс относительной толщины стенки (ОТС) ЛЖ изучен по формуле: (толщина МЖП+толщина ЗСЛЖ)/КДР ЛЖ. Норма:<0,42 ЕД [1, 5]. Концентрическим тип ГЛЖ считался, если ИММЛЖ больше нормы, ОТС ЛЖ >0,42 ЕД, а эксцентрический тип ГЛЖ – ИММЛЖ – больше нормы, но ОТС ЛЖ <0,42 ЕД. Статистическая обработка материала проведена с помощью компьютерного пакета программ «Statistica 10,0». В зависимости от вида распределения изучаемого показателя применяли различные методы статистического анализа. Значения непрерывных переменных при нормальном распределении представлены как среднее±стандартное отклонение. Для подтверждения гипотезы о наличии различий между двумя независимыми выборками использовался двухвыборочный тест Стьюдента (при нормальном распределении величин) либо тест Манна–Уитни в случае несоответствия распределения величин нормальному закону. Для выявления различий по количественным признакам определяли ранговый непараметрический критерий Краскела–Уоллиса [16]. Для изучения корреляционной связи между попарно взятыми независимыми порядковыми величинами вычисляли коэффициент корреляции Пирсона (r). В качестве порогового уровня статистической значимости было принято значение р<0,05.
Результаты исследования
В настоящее исследование не были включены лица с начальной стадией ХБП. Соотношение больных с 3-й, 4 и 5-й стадиями ренальной дисфункции были схожими. В общей выборке превалировали больные 3Б- и 4-й стадиями ХБП. Контингент обследованных больных, у которых выявлены признаки ПН и ГЛЖ, представлены в табл. 1. Примечательно, что распространенность артериальной гипертензии (АГ), ишемической болезни сердца (ИБС), мочекаменной болезни, сахарного диабета (СД), хронического гломерулонефрита, цереброваскулярных и коморбидных заболеваний была одинаковой. Доля больных хронической обструктивной болезнью легких (ХОБЛ) была больше среди лиц с эксцентрическим типом ГЛЖ и ПН.
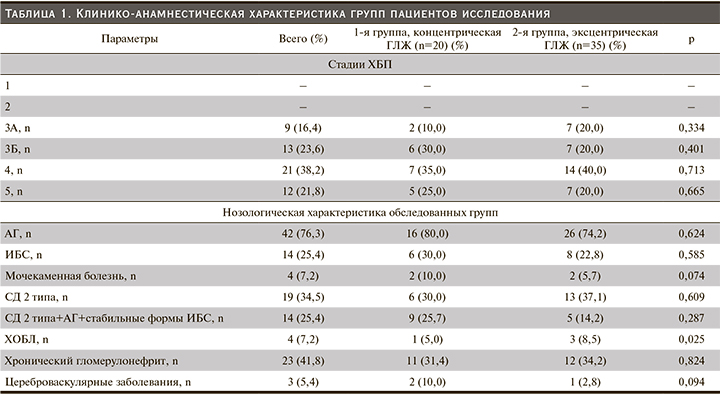
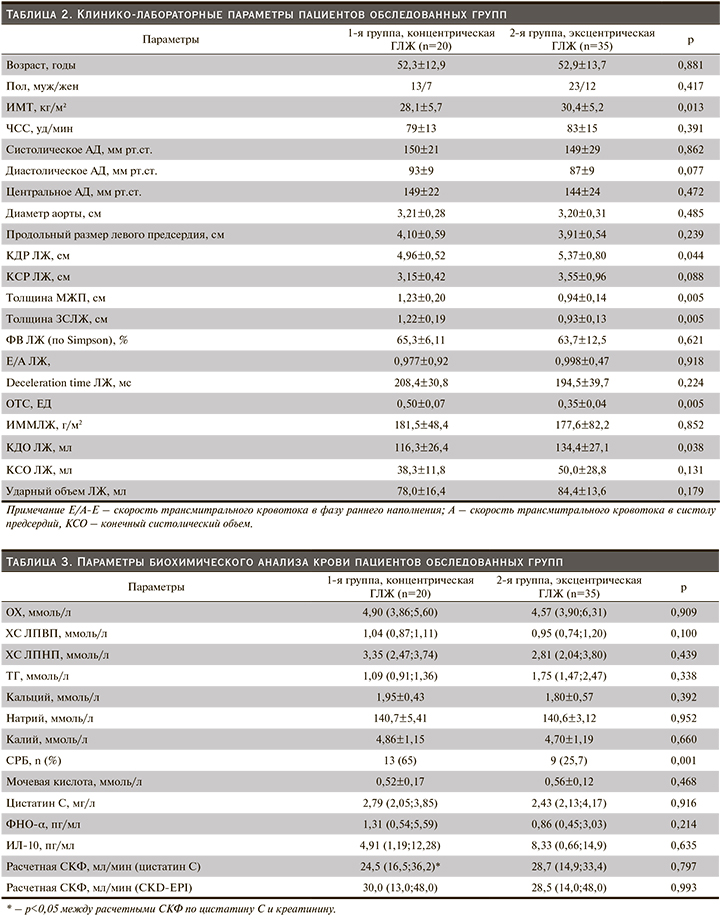
Исходно обследованные больные концентрическим и эксцентрическим типами ГЛЖ по возрасту, полу, ЧСС, уровням систолического, диастолического и центрального АД достоверно не различались (табл. 2). Среднее значение ИМТ было достоверно выше у больных эксцентрическим типом ГЛЖ (р<0,05). Анализ параметров ЭхоКГ показал, что диаметр выходного тракта аорты, размер ЛП, КСР ЛЖ, фракция выброса (ФВ) ЛЖ, индекс Е/А, DT и величина ИММЛЖ были равнозначными (р>0,05). Что же касается линейных размеров ЛЖ, то статистически значимое увеличение КДР (5,37±0,80 против 4,96±0,52 см; р=0,044) и конечного диастолического объема (КДО) ЛЖ (134,4±27,1 против 116,3±26,4 мл; р=0,038) имело место у больных эксцентрическим типом по сравнению с концентрическим ГЛЖ и ПН (табл. 2). В группе больных концентрическим ГЛЖ и ПН наблюдалось достоверное увеличение толщины МЖП (1,23±0,20 против 0,94±0,14 см; р=0,005), задней стенки ЛЖ (1,22±0,19 против 0,93±0,13 см; р=0,005) и ОТС ЛЖ (0,50±0,07 против 0,35±0,04 ЕД; р=0,005). Примечательно, что каких-либо межгрупповых различий по КСО и ударному объему ЛЖ получено не было.
При рассмотрении биохимических показателей (табл. 3) достоверных различий по параметрам липидного спектра крови в исследуемой выборке получено не было. К тому же содержание электролитов крови в обеих группах было схожим. Однако доля пациентов с увеличением уровня С-реактивного белка (СРБ) в крови в группе с концентрическим типом ГЛЖ и ПН была достоверно больше (р<0,05). Средние уровни и медиана показателей мочевой кислоты, цистатина С, ФНО-α и ИЛ-10 крови у обследованных групп больных не различались (табл. 3). Величины СКФ, рассчитанная на основе измерения уровней цистатина С и креатинина крови, были идентичными. Здесь следует отметить, что в группе больных концентрическим типом ГЛЖ и ПН медиана и межквартильный размах расчетной СКФ по цистатину С оказались достоверно ниже: 24,5 (16,5;3 6,2) против 30,0 (13,0;48,0) мл/мин (р=0,048) по сравнению с СКФ, рассчитанной по креатинину крови (табл. 3).
Ввиду немногочисленности выборки (n=55) оценка связи между концентрацией исследуемых цитокинов и ЭхоКГ индексами проведена только в общей группе (табл. 4). Статистически значимая положительная корреляционная связь была обнаружена между концентрацией ФНО-α и величиной ИММЛЖ (r=0,356; р=0,026). Существенная связь отмечена между содержанием ИЛ-10 и ТМЖП (r=0,405; р=0,010), ТЗСЛЖ (r=0,401; р=0,011) и ОТС ЛЖ (r=0,325; р=0,045). Тесной связи между ИЛ-10 и ИММЛЖ получено не было (r=0,306; р=0,058).
Обсуждение
ХБП остается важнейшей медикосоциальной проблемой современной медицины за счет высоких показателей заболеваемости, смертности и инвалидности, прежде всего от ССО [1, 17]. При этом в структуре ССО ведущее место занимает увеличение массы миокарда ЛЖ [6, 7]. Вместе с тем ГЛЖ – независимый фактор риска развития кардиальных осложнений при ПН, что определяет высокую социальную значимость данной патологии [18]. Связь изменения геометрии ЛЖ при увеличении его массы с тяжестью ренальной дисфункции изложены в ранее проведенном нами исследовании [19]. Ассоциация ГЛЖ и неблагоприятных кардиальных событий служит следствием участия воспалительного компонента в обоих процессах [20]. Цитокины, в частности ФНО-α, принимают участие в развитии ГЛЖ [21]. Достоверной разницы в содержании ФНО-α и ИЛ-10 у больных концентрическим и эксцентрическим типами ГЛЖ с ПН нами обнаружено не было (табл. 3). ФНО-α является провоспалительным цитокином, в основном синтезируемым моноцитами и макрофагами [22].
В настоящее время доказано, что этот цитокин ассоциирован не только с формированием иммунного ответа, но и с развитием атеросклероза, эндотелиальной дисфункцией, инсулинорезистентностью, нарушениями коагуляционного каскада [23]. Показано, что ФНО-α стимулирует рост фибробластов и запускает развитие интерстициального фиброза. Особо следует отметить, что биологическая активность ФНО-α осуществляется через специфические рецепторы, миелоидного (ФНО, R-I) и эпителиального (ФНО, R-II) ФНО-α [24]. Рецепторы к ФНО-α обнаружены во всех органах и тканях, кроме эритроцитов [24]. Факт непосредственного отношения ФНО-α к возникновению ГЛЖ получен в исследовании Л.К. Добродеевой и соавт. (2004) [25]. В когортном исследовании R.L. Amdur et al. (2016) установлено, что при ПН наряду с гиперфибриногенемией, гипоальбуминемией повышение концентрации ФНО-α ассоциируется с перспективным ухудшением азотовыделительной функции почек [26]. По данным M. Tonelli et al. (2005), более высокий уровень СРБ с увеличением экспрессии рецепторов второго типа (R-II) ФНО-α связан с прогрессированием ПН [27]. Y. Takei et al. (2009) доказали тесную связь между ГЛЖ и содержанием растворимых рецепторов ФНО-α первого типа (R-I) [28]. Схожие результаты исследования получены в работе T. Gohda et al. (2017), когда была обнаружена важная роль рецепторов первого типа (R-I) ФНО-α в прогрессировании ССО [29]. В возникновении ССО и повышении смертности значительное влияние оказали повышение уровня ФНО-α и экспрессия рецепторов R-II [30]. На наш взгляд, разнонаправленное влияние ФНО-α на развитие ССО при ПН обусловлено неоднородной выборкой, широкой вариацией возраста и влиянием фармакотерапии на цитокиновый профиль в отмеченных клинических исследованиях. Как показано в табл. 1, контингент обследованных нами больных также не был однородным. Нам удалось в общей выборке установить связь между концентрацией ФНО-α и ИММЛЖ (табл. 4). Важно отметить, что в проведенном нами исследовании в группе больных концентрическим типом ГЛЖ и ПН число лиц с увеличением уровня СРБ сыворотки крови были достоверно больше. Этот факт подтверждает, что, несмотря на далеко зашедшую стадию патологического процесса, субклиническое воспаление сохраняет свое влияние на развитие ГЛЖ при ПН (табл. 3). Как отмечено выше, медиана концентрации ФНО-α в исследуемых группах была схожей (табл. 3). Неблагоприятная роль увеличения числа рецепторов ФНО-α в развитии ССО у больных ПН продемонстрирована в проспективном исследовании [30]. N.Y. Alwahaibi et al. (2016) провели сравнительный анализ содержания цитокинов у больных, страдавших ПН, находившихся на гемодиализе, иммуносупресивной терапии, и здоровых лиц [31]. Достоверно высокие концентрации отмечены среди больных, получавших лечение программным гемодиализом и иммуносупрессивными препаратами. Заслуживает внимания полученные нами несколько противоречивые данные о наличии тесной связи между концентрацией ИЛ-10 и толщиной стенок ЛЖ (табл. 4) у больных концентрическим и эксцентрическим типами ГЛЖ и ПН. В нашем исследовании показано, что клинически значимое увеличение уровня ИЛ-10 наблюдалось у больных эксцентрическим типом ГЛЖ и ПН (табл. 3). ИЛ-10 – важный цитокин [32], оказывающий главным образом противовоспалительное действие. ИЛ-10 служит защитным фактором для эндотелия сосудов, т.к. он ослабляет эффекты ангиотензина II, активированного продуктами оксидативного стресса [32], и восстанавливает активность синтазы оксида азота, подавленную индукторами эндотелиальной дисфункции [33, 34]. Каких-либо межгрупповых различий по СКФ в проведенном нами исследовании отмечено не было (табл. 3). К тому же нам не удалось установить корреляционных связей между концентрациями цитокинов и СКФ. Возможно, малый объем выборки не дал нам возможности продемонстрировать внутригрупповые связи цитокинов с типами ГЛЖ. В предыдуших одномоментных исследованиях [35] нами установлена роль цитокинов и их взаимосвязь с сердечно-сосудистыми нарушениями у больных на начальной стадии ХБП. Полученные нами данные свидетельствуют о необходимости более активного изучения цитокинового профиля у больных ПН на разных стадиях заболевания, особенно при наличии ГЛЖ.

Выводы
У пациентов с ПН и гипертрофией ЛЖ нарастание ИММЛЖ ассоциируется с повышением концентрации ФНО-α, а увеличение толщины стенок ЛЖ – с ИЛ-10.



