Острая почечная недостаточность (ОПН) часто развивается у больных в критическом состоянии и ассоциируется с высокой летальностью, которая на протяжении последних трех десятилетий остается в диапазоне 28–90 %. Исход зависит от этиологии и тяжести ОПН, характера основной и сопутствующей патологии, возраста больных и ряда других факторов [1]. В связи с потребностью в стандартизации подходов к оценке ОПН предложена новая классификация RIFLE (ADQI, 2002), в которой термин ОПН заменен на «острое почечное повреждение» (ОПП); степень тяжести оценивается соответственно пяти стадиям ОПП: риск (Risk), повреждение (Injury), недостаточность (Failure), потеря (Loss), терминальная хроническая почечная недостаточность (End stage renal disease) [2].
Пациенты с ишемической болезнью сердца (ИБС) относятся к группе риска развития ОПП. При ИБС, в частности при остром инфаркте миокарда (ОИМ), нередко отмечается снижение сердечного выброса: развитие ОПП при этом обусловлено снижением скорости клубочковой фильтрации (СКФ) вследствие неадекватной перфузии почек. Усугубить данную ситуацию могут диуретики, которые часто бесконтрольно применяются при терапии сердечно-сосудистых заболеваний, что приводит к почечным потерям жидкости [1].
 Пациенты с ИБС, подвергающиеся оперативному вмешательству – реваскуляризации коронарных сосудов: стентированию, аортокоронарному шунтированию (АКШ), маммарокоронарному шунтированию (МКШ), относятся к группе высокого риска развития ОПП. Наиболее выраженное падение СКФ характерно для пациентов с ИБС, страдающих сахарным диабетом, артериальной гипертензией (АГ), поражением сосудов различной этиологии. Анестетики, вызывая периферическую дилатацию, также могут вносить свой вклад в развитие ОПП. Операции на сердце в условиях искусственного кровообращения, в частности АКШ, чреваты развитием гемолиза, гемоглобинурии и ренальным ОПП. Одной из причин преренальной ОПП может послужить прием ингибиторов ангиотензин-превращающего фермента (иАПФ) и блокаторов рецепторов ангиотезина II (БРА), широко назначаемых пациентам для коррекции АГ и/или ХСН, вследствие дилатации эфферентных артериол почечных клубочков. Применение рентгеноконтрастных веществ пациентами с ИБС также может приводить к развитию контраст-индуцированной нефропатии по типу ОПН на ХПН.
Пациенты с ИБС, подвергающиеся оперативному вмешательству – реваскуляризации коронарных сосудов: стентированию, аортокоронарному шунтированию (АКШ), маммарокоронарному шунтированию (МКШ), относятся к группе высокого риска развития ОПП. Наиболее выраженное падение СКФ характерно для пациентов с ИБС, страдающих сахарным диабетом, артериальной гипертензией (АГ), поражением сосудов различной этиологии. Анестетики, вызывая периферическую дилатацию, также могут вносить свой вклад в развитие ОПП. Операции на сердце в условиях искусственного кровообращения, в частности АКШ, чреваты развитием гемолиза, гемоглобинурии и ренальным ОПП. Одной из причин преренальной ОПП может послужить прием ингибиторов ангиотензин-превращающего фермента (иАПФ) и блокаторов рецепторов ангиотезина II (БРА), широко назначаемых пациентам для коррекции АГ и/или ХСН, вследствие дилатации эфферентных артериол почечных клубочков. Применение рентгеноконтрастных веществ пациентами с ИБС также может приводить к развитию контраст-индуцированной нефропатии по типу ОПН на ХПН.
Наличие исходно сниженной функции почек у таких пациентов значительно увеличивает вероятность развития ОПП в послеоперационном периоде [3]. Стойкое снижение СКФ значительно ухудшает прогноз при остром коронарном синдроме. Для больных инфарктом миокарда (ИМ) с подъемом сегмента ST, не-Q ИМ и нестабильной стенокардией СКФ в диапазоне 30–60 мл/мин увеличивала риск смерти в 2,09 раза, а СКФ < 30 мл/мин – почти в 4 раза [4]. У больных со стойким ухудшением функции почек более чем в 7 раз возрастает интраоперационная сердечно-сосудистая смертность при АКШ [5].
Целью исследования явилось выявление у больных ИБС факторов риска развития ОПП и анализ ее исходов после оперативной реваскуляризации сердца.
Материал и методы
Под наблюдением находились 56 пациентов с ИБС, стенозирующим атеросклерозом коронарных артерий (62,8 ± 3,9 года), подвергшихся оперативной реваскуляризации коронарных сосудов в плановом или экстренном порядке: аортокоронарному шунтированию (АКШ) и/или маммарнокоронарному шунтированию (МКШ) или стентированию коронарных артерий в Межрегиональном клинико-диагностическом центре Казани с 2005 по 2012 г. Пациенты были разделены на 2 группы: 1-ю (наблюдения) составили 28 пациентов от 48 до 81 года (69 ± 1,7), М/Ж = 1/1, у которых после коронароангиографии и/или оперативного вмешательства развилось ОПП; 2-ю группу (сравнения) − 28 пациентов 38−74 лет (56,8 ± 1,7), М/Ж = 6/1 с сохранной функцией почек после реваскуляризации коронарных сосудов. В исследование не включены пациенты с контраст-индуцированной ОПН. В контрольную группу вошли 30 практически здоровых лиц в возрасте 49,3 ± 3,5 лет, М/Ж = 3/1.

Протокол обследования включал изучение жалоб, анамнеза; клиническое обследование, измерение уровня систолического и диастолического давления (САД и ДАД); общий анализ мочи с оценкой осмотической плотности мочи, протеинурии и осадка; определение уровня креатинина в сыворотке крови с расчетом СКФ по формуле Кокрофта–Голта (рСКФ); липидов – холестерина (ХС), триглицеридов (ТГ), липопротеидов низкой (ЛПНП) и высокой плотности (ЛПВП); ультразвуковое исследование почек с расчетом объема по формуле А.И. Дергачева (1995), оценкой эхогенности; ультразвуковую допплерографию (УЗДГ) сосудов почек.
Результаты и обсуждение
В группе наблюдения ОПП развилась после экстренного стентирования коронарных артерий у 10 (35, 7 %) пациентов, поступивших в стационар по неотложным показаниям с ОИМ; после планового стентирования коронарных артерий у 18 пациентов, поступивших в стационар со стенокардией напряжения III−IV функционального класса (ФК) и/или прогрессирующей стенокардией: после операции АКШ в сочетании с МКШ – у 13 (46,4 %) пациентов и после операции АКШ – у 5 (17,9 %). В группе сравнения все пациенты поступили с ИБС, прогрессирующей стенокардией напряжения. Длительность ИБС в наблюдаемой группе составила 9,1 ± 1,2 года, в группе сравнения – 5,4 ± 1,3 года (р < 0,05). У 23 (82,1%) пациентов в каждой из групп выявлен постинфарктный кардиосклероз (ПИКС).
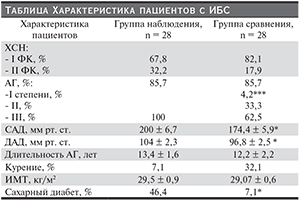
 Характеристика пациентов основной и контрольной групп представлена в таблице. АГ (ВОЗ, 1999) имели 85,7 % пациентов обеих групп, причем в группе наблюдения 100 % больных III степени, в группе сравнения – I степени 4,2%, II – 33, 3 %, III – 62,5 %. Уровень САД при поступлении составил в группах соответственно 200 ± 6,7 и 174,4 ± 5,9 мм рт. ст. (р < 0,05), уровень ДАД – 104 ± 2,3 и 96,8 ± 2,5 мм рт. ст. (р < 0,05).
Характеристика пациентов основной и контрольной групп представлена в таблице. АГ (ВОЗ, 1999) имели 85,7 % пациентов обеих групп, причем в группе наблюдения 100 % больных III степени, в группе сравнения – I степени 4,2%, II – 33, 3 %, III – 62,5 %. Уровень САД при поступлении составил в группах соответственно 200 ± 6,7 и 174,4 ± 5,9 мм рт. ст. (р < 0,05), уровень ДАД – 104 ± 2,3 и 96,8 ± 2,5 мм рт. ст. (р < 0,05).
Все больные принимали гипотензивные препараты: ингибиторы ангиотензин-превращающего фермента (ИАПФ) или блокаторы рецепторов к ангиотензину (БРА) – 13 пациентов группы наблюдения (46,4%) и 9 (32,1%) – группы сравнения, в т. ч. в комбинации с другими гипотензивными препаратами – 12 человек (42,8 %) и 6 (21,4 %) соответственно. Остальные больные принимали препараты других фармакологических групп. Уровень САД в предоперационном периоде составил в группе наблюдения 155 ± 10,5, ДАД 89 ± 6,7 мм рт. ст., p > 0,05; в группе сравнения – 143,0 ± 9,2 и 84,0 ± 7,1 мм рт. ст. соответственно, p > 0,05. Гипотензивные препараты до операции не отменялись, в связи с чем проанализировать зависимость развития ОПП от приема или отмены ИАПФ или БРА не представилось возможным.
Сахарным диабетом страдали 13 из 28 (46,4 %) пациентов группы наблюдения, из них 5 (38,5 %) – диабетической нефропатией. Во 2-й группе сахарным диабетом страдали 2 (7,1%) пациента, диабетическая нефропатия не выявлена.
До операции протеинурия выявлена лишь у пациентов с диабетической нефропатией. Относительная плотность мочи в группе наблюдения (1017,2 ± 1,2) не отличалась от таковой в группе сравнения (1017,2 ± 0,9), р > 0,05, но в обеих группах была ниже, чем в контрольной группе (1020 ± 1,1). В период ОПП в наблюдаемой группе у 10 (35,7 %) пациентов в моче была протеинурия (максимально до 1 г/л): изолированная – у 4 (40 %), в сочетании с эритроцитурией – у 5 (50 %), в сочетании с эритроцитурией и лейкоцитурией – у 1 (10 %). После разрешения ОПП протеинурия не определялась ни у одного пациента. В группе сравнения протеинурии и изменений в осадке мочи до и после операции не выявлено.
Исходный уровень СКФ (до операции) в группе наблюдения (63,0 ± 3,3 мл/мин) был ниже, чем в группе сравнения (88,6 ± 3,3), р < 0,005. У 11 (39,3 %) пациентов СКФ была < 60 мл/мин, что позволило установить у этих пациентов хроническую болезнь почек (ХБП) III стадии. Объем почек в группе наблюдения (129,5 ± 4,8 мм3) оказался меньше, чем в группе сравнения (144,1 ± 2,7 мм3), р < 0,05. Эхогенность паренхимы почек была повышена в обеих группах. Снижение СКФ менее 60 мл/мин у 39,3 % больных, уменьшение объема почек и повышение эхогенности паренхимы почек у пациентов группы наблюдения свидетельствовали о наличии ХБП и нефросклероза, несмотря на отсутствие в анамнезе заболеваний почек и изменений в моче.
При оценке липидного профиля (рис. 1) разницы в уровне холестерина (ХС), липопротеидов высокой плотности (ЛПВП) и триглицеридов (ТГ) между группами не выявлено. В группе наблюдения уровень ЛПНП был выше, чем в группе сравнения.
Согласно классификации ОПП (RIFLE), у 14 (50 %) из 28 больных ИБС с развившимся ОПП установлены следующие стадии ОПП: риска – у 6 (21,4 %) пациентов, повреждения – у 16 (57,2 %), недостаточности – у 6 (21,4 %). Летальный исход развился у 7 (25 %) пациентов с ОПП, реконвалесценция – у 21 (75 %).
 Мы проанализировали исходы ОПП у больных наблюдаемой группы в зависимости от исходной СКФ в двух подгруппах: 1-й – более 60 мл/мин (17 больных) и 2-й – менее 60 мл/мин (11 больных). В первой подгруппе с сохранной функцией почек ОПП завершилось летальным исходом для 4 (23,5 %) из 17 пациентов, во второй подгруппе – для 3 (27,2 %) из 11 больных, р > 0,05. Острый гемодиализ в стационаре проведен всем пациентам с неблагоприятным исходом и 3 (27,2 %) пациентам с разрешившимся ОПП. Выписаны из стационара с ОПП в стадии полиурии или восстановления почечных функций 11 (39,3 %) человек.
Мы проанализировали исходы ОПП у больных наблюдаемой группы в зависимости от исходной СКФ в двух подгруппах: 1-й – более 60 мл/мин (17 больных) и 2-й – менее 60 мл/мин (11 больных). В первой подгруппе с сохранной функцией почек ОПП завершилось летальным исходом для 4 (23,5 %) из 17 пациентов, во второй подгруппе – для 3 (27,2 %) из 11 больных, р > 0,05. Острый гемодиализ в стационаре проведен всем пациентам с неблагоприятным исходом и 3 (27,2 %) пациентам с разрешившимся ОПП. Выписаны из стационара с ОПП в стадии полиурии или восстановления почечных функций 11 (39,3 %) человек.
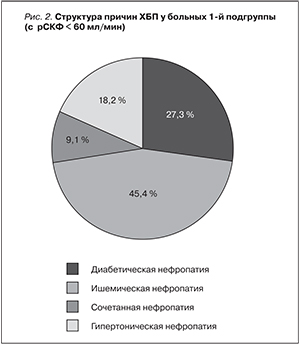
Для анализа роли исходной функции почек в качестве фактора риска ОПП пациентов с ИБС разделили на 2 подгруппы: в первую вошли 11 пациентов (67,1 ± 2,9 года; М/Ж = 7/4) с уровнем креатинина сыворотки крови от 85 до 194 мкмоль/л (137,7 ± 9,8 мкмоль/л); во вторую подгруппу – 17 больных (70,3 ± 2,2 года; М/Ж = 7/10) с уровнем креатинина от 65 до 119 мкмоль/л (92 ± 3,4); разница в уровне креатинина между подгруппами была достоверной, р < 0,005. Расчетная СКФ до операции в подгруппах составила соответственно 46,2 ± 3,2 и 88,2 ± 1,8 мл/мин (р < 0,001) и позволила разделить пациентов с ОПП на две подгруппы: первая – с ХБП III ст. и вторая подгруппа – больные с исходно сохранной функцией почек. У пациентов 1-й подгруппы в анамнезе заболевания почек отсутствовали, однако при обследовании у 39,3 % больных в стационаре выявлены гипертоническая, ишемическая, диабетическая или сочетанная нефропатии, которые явились причиной ХБП (рис. 2).
Возраст пациентов в подгруппах (67,1 ± 2,9 и 70,3 ± 2,3 года соответственно, р = 0,381) не различался. В 1-й подгруппе преобладали мужчины (М/Ж = 7/4), во 2-й – женщины (Ж/М = 10/7). Достоверных различий между подгруппами по числу лиц с абдоминальным ожирением не выявлено: ИМТ у пациентов первой подгруппы (27,9 ± 1,2 кг/м2) не отличался от такового у больных второй подгруппы (30,7 ± 1,2), р > 0,05. АГ наблюдалась также с одинаковой частотой в обеих группах – у 91 % пациентов 1-й и у 82,3 % 2-й подгрупп (р > 0,05). Различий в подгруппах по уровню ДАД, длительности заболеваний (ИБС и АГ) не выявлено. Различия между подгруппами были только по уровню САД при поступлении (соответственно 230,0 ± 6,8 и 182,0 ± 8,7 мм рт. ст., р = 0,000), ЛПНП и ЛПВП в отсутствие различий в уровне ХС и ТГ (рис. 3).
При оценке осмотической плотности мочи разницы между подгруппами не выявлено (1019 ± 1,4 и 1015 ± 1,9 соответственно), р > 0,05. О признаках нефросклероза в 1-й подгруппе свидетельствовали снижение рСКФ и уменьшение объема почек по сравнению со 2-й подгруппой (соответственно 111,2 ± 8,7 и 139,7 ± 5,2 мм3), р < 0,01.
Проведенный корреляционный анализ развившегося ОПП с вероятными 13 факторами риска: возрастом, длительностью ИБС и АГ, ХСН, курением, уровнями САД и ДАД, ИМТ; уровнями ХС, ЛПВП, ЛПНП, ТГ; исходной (до операции) СКФ, показал, что достоверная сильная положительная корреляционная связь выявлена лишь с исходной СКФ (r = 0,76, р < 0,001). Поскольку сниженная СКФ была обусловлена наличием заболеваний почек, лишь небольшая часть из которых была диагностирована до госпитализации (все больные – с диабетической нефропатией), а большинство (72,7 %) впервые выявлено в МКДЦ (ишемическая, гипертоническая и сочетанная нефропатии), можно сделать вывод о необходимости активного целенаправленного догоспитального обследования почек больных ИБС на предмет раннего выявления и лечения возможной патологии.
Поскольку у большинства наблюдаемых пациентов выявлено сочетание факторов риска, мы провели многофакторный регрессионный анализ влияния анализируемых факторов риска на развитие ОПП. Доказано развитие ОПП с вероятностью 71,94 % при комбинации следующих факторов (степень влияния указана по мере убывания): исходная функция почек (Кj = 17,6 %), уровни САД (Кj = 11,3%) и ДАД (Кj = 7,92 %), длительность АГ (Кj = 7,45 %), уровень ЛПВП (Кj = 6,74 %), ТГ (Кj = 5,4 %), длительность ИБС (Кj = 4,82 %), ИМТ (Кj = 3,87 %), ЛПНП (Кj = 3,64 %), возраст пациентов (Кj = 2,25 %), ХС (Кj = 0,95 %). Не выявлено влияния на развитие ОПП фактора ХСН, возможно, из-за отсутствия в группе наблюдения тяжелой ХСН (III степени) и фактора курения, поскольку у части пациентов на момент обследования данный фактор отсутствовал из-за отказа от курения в связи с заболеванием, а ретроспективно оценить стаж и интенсивность курения не представилось возможным из-за неточности сведений о длительности и интенсивности курения. В данное исследование не вошли все возможные факторы риска, наличие которых может еще более повысить вероятность развития ОПП.
Основным фактором риска развития ОПП у больных ИБС со стенозирующим атеросклерозом коронарных артерий, подвергшихся оперативному вмешательству, является исходно сниженная функция почек (менее 60 мл/мин). При сочетании у больного ИБС нескольких факторов риска: длительность ИБС и АГ, высокая степень АГ, нарушение липидного обмена с повышением ЛПНП, возраст пациентов, избыточная масса тела, – вероятность развития ОПП возрастает до 71,94 %. Исходно сниженная функция почек у 39,3 % больных ИБС группы наблюдения была обусловлена ишемической, гипертонической и смешанной нефропатиями, которые протекали латентно и были диагностированы только в кардиохирургическом отделении. Пациенты с ИБС относятся к группе риска развития ХБП, обусловленной гипертонической и/или ишемической нефропатией, а также к группе высокого риска развития ОПП и летального исхода (25 %) после операций реваскуляризации коронарных сосудов. Полученные результаты говорят о необходимости догоспитального исследования почек пациентов с ИБС с целью раннего выявления и лечения обнаруженной патологии, а при решении вопроса о выборе консервативного или оперативного лечения – учитывать высокий риск развития ОПП и неблагоприятного исхода после оперативной реваскуляризации коронарных сосудов.



