Изучению кардиоренального синдрома посвящено в последние годы значительное число исследований, в т. ч. крупных, например MRFIT [1]. Внимание клиницистов сконцентрировано в первую очередь на поражении клубочкового аппарата почки, что обусловлено тесной взаимосвязью гломерулосклероза с атеросклерозом и значимым повышением риска сердечно-сосудистых и почечных осложнений, а также ухудшением отдаленного прогноза [2–5]. Не менее важной, чем почечный клубочек, структурой является тубулоинтерстициальная ткань почки (ТИТ), которая выполняет ряд
важных функций и, по мнению ряда исследователей, вовлекается в патологический процесс при cердечно-сосудистых заболеваниях зачастую раньше клубочкового аппарата. Для сердечно-сосудистых заболеваний характерно развитие первичной хронической тубулоинтерстициальной нефропатии (ТИН) (наиболее частой причиной которой является артериальная гипертензия), а именно подгруппы ТИН, вызванных ишемическими сосудистыми заболеваниями, объединенных по общей морфологической картине – наличию дегенерации канальцев, интерстициального фиброза, инфильтрацией мононуклеарными воспалительными клетками. Вовлечение сосудистого компонента, которое развивается гораздо позже при первичной ТИН, в свою очередь вносит вклад в ее прогрессирование [6].
Интерстиций почки включает внесосудистое межканальцевое пространство почечной паренхимы, имеющее клеточные элементы и межклеточное пространство (табл. 1). Лимфатические сосуды также во многом относят к интерстицию. Таким образом, интерстиций со всех сторон окружен базаьными мембранами канальцев, а также сосудов, и столь тесный анатомический контакт с остальными структурами (в особенности между канальцами и сосудами, которые в некоторых точках имеют
общую базальную мембрану) обусловливает возникновение патологического каскада реакций при повреждении одного из образований.
Как видно из табл. 2, интерстиции можно разделить на кортикальный и медуллярный, каждый из которых имеет несколько подтипов и собственные особенности строения.
Относительный объем интерстиция в коре почки составляет приблизительно 7 %, из них 3 % – интерстициальные клетки и 4 % – экстрацеллюлярное пространство. Сосудистый компонент составляет еще 6 %, остальное (85 % и более) занято канальцами.
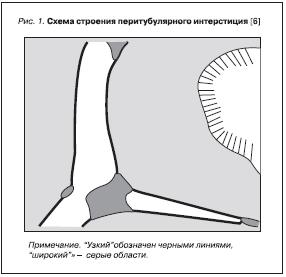
Перитубулярный интерстиций занимает пространство между канальцами, клубочками и капиллярами, субкапсулярные интерстициальные пространства являются их частью. Перитубулярный интерстиций разделяют на “узкий” и “широкий” (рис. 1).
“Узкий” интерстиций составляет 0,6 % объема коры почки, занимая одну-две трети перитубулярной капиллярной поверхности в коре. Оставшуюся часть составляют бόльшие по размеру области “широкого” интерстиция неправильной формы, занимающие приблизительно 3,4 % объема коры. Функциональная нагрузка на “узкий” и “широкий” интерстиции, очевидно, отличается, но четкие различия пока не установлены [8].
Важным различием узкого интерстиция является то, что стенка капилляров, обращенная к узкому интерстицию, значительно в большей степени (примерно в 2 раза больше) фенестрирована по сравнению со стороной, обращенной к широкому интерстицию. Именно в узком интерстиции
происходит непосредственное взаимодействие между капиллярами и близлежащим канальцем (54 % общей поверхности перитубулярных капилляров в коре, в то время как только 26 % поверхности канальцев непосредственно соприкасается с перитубулярными капиллярами) [9, 10].
Периартериальный интерстиций богат жидкостным компонентом, окружает интраренальные артерии и содержит лимфатические сосуды почки [11–13]. Периартериальный листок проходит вдоль интраренальных артерий на протяжении афферентной артерии, далее он становится более разреженным. Данный вид интерстиция свободно контактирует с перитубулярным.
Гломерулярный и экстрагломерулярный мезангии – особый вид интерстиция, поскольку его клетки как бы встроены в обильный экстрацеллюлярный матрикс, соединенный с интерстициальными пространствами коры. Выброс трансфомирующего фактора риска (TGF) в ответ на изменение
объема и состава интерстициальной жидкости, возможно, происходит в первую очередь в мезангиальное пространство. Мезангиальные и экстрагломерулярные мезангиальные клетки по своему происхождению схожи с гладкомышеными клетками сосудов, поэтому ряд исследователей рассматривают их как разновидность периваскулярных клеток.
Медуллярный интерстиций, как показано в табл. 2, разделяется на три типа, однако самым особенным типом является интерстиций внутренней медуллы, поскольку именно здесь интерстиций занимает большую часть общего объема ткани. Лимфатические сосуды во всей медулле отсутствуют. Таким образом, относительный объем интерстиция варьируется в различных областях почки. Например, количество перитубулярного интерстиция у экспериментальных животных варьируется от 7–9 % от объема всей паренхимы в коре и до 30–40 % во внутренней медулле. При измерении функционального
объема интерстиция в почке крыс его величина составила 13,1 %, что значительно превосходит результаты измерения стереотаксическим методом (3–5 %). В связи с этим можно сделать вывод о том, что функционально интерстиций включает не только перитубулярные пространства. Париартериальные соединяющие листы также могут считаться компонентом интерстиция, занимающим до 50 % его объема.
Почечный интерстиций, очевидно, не является пассивным пространством, в котором находятся истинные почечные функциональные единицы – нефроны и сосуды. Интерстициальные структуры активно участвуют практически во все обменных процессах, протекающих между канальцами и сосудами почечной паренхимы. Интерстиций влияет на клубочковую фильтрацию опосредованно через канальциево-клубочковую обратную связь, также регулируя рост и дифференцировку
паренхиматозных клеток, во многом определяя эластичность перитубулярных сосудов. Клеточные элементы интерстиция продуцируют ряд гормонов с местным и системным действиями, играющими важную роль как в норме, так и при развитии почечного повреждения [14].
Традиционные представления о механизмах поражения ТИТ при АГ предполагают, что процесс почечного поражения начинается с вовлечения артерий среднего и мелкого калибра (в виде гипертрофии миоинтимы и медии, дегенерации гиалина и склероза), что в свою очередь приводит к трансмиссии повышенного системного АД на капилляры клубочка и гломерулоскерозу, ишемии последующих структур нефрона, канальцевой атрофии и интерстициальному фиброзу. Исследования W. Kriz et al. (2005) [12] продемонстрировали дополнительные мезанизмы поражения ТИТ при первичном вовлечении клубочков. Дегенеративные и воспалительные процессы вызывают формирование клеточных мостов и фибротическую адгезию между сосудистым клубочком и Боуменовой капсулой, что вызывает отклонение части клубочкового фильтрата в перигломерулярную область.
Тем не менее некоторые исследователи в качестве первого этапа поражения почки при АГ считают именно вовлечение канальцев и интерстиция. Так, показано повышение экскреции с мочой маркеров поражения канальцев (N-ацетил-бетаD-глюкозаминидазы) у пациентов с нелеченой первичной
АГ без очевидных признаков сосудистого или клубочкового повреждения [15]. Предполагают, что в реализации процесса воспаления при ТИТ вовлечены цитокины, факторы роста, вазоактивные молекулы и свободные радикалы кислорода, которые вносят вклад в развитие поражения почечных клубочков и сосудов. Некоторые авторы утверждают, что поражение ТИТ не является одним из проявлений манифестации гипертензивной нефропатии, а представляет собой приоритетный
механизм ее развития [16].
Чтобы проанализировать механизм поражения интерстиция, рассмотрим естественные изменения интерстиция при старении. Хорошо известно, что старение ассоциировано с постепенным снижением СКФ на 1 мл/мин в год начиная примерно с 30-летнего возраста. Кроме того, старение сопряжено с неизбежным развитием гломерулосклероза и интерстициального фиброза. Достаточное количество
исследований посвящено клеточным механизмам возрастного гломерулосклероза; о тубулоинтерстициальном фиброзе (ТИФ) по-прежнему известно значительно меньше. S.E. Thomas et al. (1998) [17] в эксперименте у стареющих крыс (24 месяца) воспроизвели ТИФ, характеризующийся
повреждением канальцев и фокальной пролиферацией канальцевых эпителиоцитов, а также активацией миофибробластов, макрофагов с повышением интенсивности иммунного окрашивания к адгезивным белкам – остеопонину и ICAM-1, депозицией коллагена IV типа. У этих крыс выявлено также повышение интенсивности окрашивания на эндотелиальную NO-синтазу (eNOSIII) в эпителиальных клетках канальцев и инфильтрация мононуклеарными клетками областей тубулоинтерстициального повреждения с относительным снижением количества перитубулярных капилляров (выявленное по снижению окрашивания к RECA-1 и OX-2) в сравнении с молодыми крысами. Области фиброза и гипоцеллюлярности связаны со снижением апоптоза клеток канальцев и интерстиция в сравнении с молодыми (3-месячными) крысами (25,4 +/- 5,3 vs 3,5 +/- 2,5 TUNEL-позитивные клетки/0,25 мм2 у старых vs молодых крыс, p = 0,0001). Таким образом, ТИФ при старении – активный процесс, связанный с интерстициальным воспалением и активацией фибробластов. Прогрессирующая потеря клеток в области фиброза может быть связанной с усиленным апоптозом.
В связи с этим тубулоинтерстициальное повреждение может быть последствием ишемии, развивающейся вследствие поражения перитубулярных капилляров и нарушения экспрессии eNOS.
Таблица1. Элементы почечного интерстиция [6, 7].
Таблица 2. Классификация интерстиция почки [7].
Рисунок 2. Потенциальный механизм развития хронической ТИН, вызванной первичным поражением канальциевого аппарата (серые ячейки) или вторично вследствие патологии клубочкового аппарата (белые ячейки) [21].
В пользу правомочности подобных представлений свидетельствуют также результаты других исследований [18]. На модели ишемического повреждения канальцев гломерулосклероз,
ассоциированный с облитерацией микрососудистого русла, развился на 2-й неделе после введения антител и не разрешался до 11-й недели. Тубулоинтерстициальное повреждение было умеренным на 2-й неделе и постепенно усугублялось до 11-й, коррелируя с уменьшением количества перитубулярных капилляров. Иммуногистохимический анализ показал прирост гипоксии в коре до усиления поражения ТИТ и последующего снижения числа капилляров. Предшествующее наличие гипоксии подтверждает ее роль в прогрессировании поражении ТИТ. Для изучения снижения кровотока в пораженной почке были определены капилляры с неизмененным кровотоком. В группе контроля микрососудистое русло почки отчетливо окрашивалось лектином, в то время как связывание лектина перитубулярными капиллярами в пораженной почке было значительно снижено, что подтверждает гипоперфузию. Прижизненный микроскопический анализ подтвердил, что кровоток в перитубулярных капиллярах снизился примерно на 40 % в сравнении с контролем. Таким образом, уменьшение кровотока в перитубулярных капиллярах индуцировало хроническую гипоксию на этой экспериментальной модели в раннем возрасте, за чем следовало прогрессирующее поражение ТИТ и снижение числа перитубулярных капилляров.
Очень важно, что индуцированные гипоксией изменения ТИТ могут предшествовать развитию АГ. Так, при индукции хронической гипоксии путем помещения в гипербарическую камеру на 24 дня у гипертензивных крыс было установлено, что поражение микрососудистого русла (в первую очередь афферентной артериолы) и почечного тубулоинтерстиция развивается заметно раньше, чем удается зарегистрировать вовлечение почечных клубочков. Очевидно, что вовлечение этих структур может предрасполагать к развитию персистирующей артериальной гипертензии [19].
Механизм гипертензивного повреждения почек также подробно охарактеризован при вазоренальной АГ: так, подробно описаны изменения состава мезангиального матрикса, интенсивность его пролиферации, выраженность инфильтрации и тубулоинтерстиция у крыс с клипированными почечными артериями (одной или двумя) [20]. Неклипированнные почки от крыс с АГ и интактных животных изучались на 7-й, 14, 21 и 28-й дни после клипирования почечных артерий. У крыс с клипированными почечными артериями на 7-й день отмечен подъем систолического АД (154 ± 3 против 111 ± 4 мм рт. ст. у интактных животных, p < 0,001). В группе животных с вазоренальной АГ отмечена ранняя экспансия интерстиция с увеличением его объема – в среднем на 37 %; только к
21-му дню после клипирования почечных артерий появились соответствующие признаки поражения сосудов и клубочков. Иммунофлюоресцентный анализ показал раннее интерстициальное накопление коллагенов типов I, III, IV, V, VI, а также фибронектина. Напротив, в клубочках при этом повышение
содержания коллагенов I, III, IV, V типов, ламинина и фибронектина было умеренно выраженным или отсутствовало; отложение коллагена VI типа было констатировано значительно позже при сформировавшейся артериальной гипертензии. Окрашивание на антиген клеточного ядра как маркер клеточной репликации при этом стало более интенсивным в канальцевом эпителии, но не в интерстициальных и клубочковых клетках. Уже на 7-й день в кортикальном интерстиции была отмечена нарастающая инфильтрация макрофагами. Таким образом, вазоренальная АГ с почечной ищемией приводит к ранней пролиферации канальцевых клеток, вовлечению мононуклеарных клеток и депозиции матриксных белков первично именно в почечном интерстиции.
Предполагают также ведущую роль хронического повреждения эпителиальных клеток канальцев в патогенезе ТИН, что схематически представлено на рис. 2. Это повреждение может быть прямым, развиваясь под действием токсинов вследствие канальцевой обструкции или ишемии, или непрямым, опосредованным иммуновоспалительными реакциями. Исследования на экспериментальных моделях и у человека подтверждают важную последних. Четко установлено, что в почечных канальцах может наблюдаться выраженная активация альтернативного пути связывания комплемента с последующим привлечением воспалительных клеток и высвобождением соответствующих цитокинов [21]. В свою очередь поврежденные эпителиальные клетки также начинают секретировать цитокины и экспрессировать поверхностные маркеры, например молекулы адгезии, затрудняющие их взаимодействие с остальными клетками и предрасполагающие к избыточной депозиции интерстициального матрикса, а также образованию фиброзной ткани; таким образом – к прогрессированию ТИН [14, 21].
Эпителий почечных канальцев имеет мезенхимальное происхождение, поэтому он может иметь некоторые общие фенотипические характеристики с фибробластами. Очевидно, что при определенных обстоятельствах фенотипическое сходство канальцевых эпителиоцитов с фибробластами может усиливаться, в связи с чем они начинают экспрессировать ряд экстрацеллюлярных матриксных белков, в т. ч. проколлагены типа I и III, а также фибронектин и ламинин. По-видимому, нельзя исключать также и возможность наличия на территории почечного тубулоинтерстиция определенного количества недифференцированных мезенхимальных клеток, которые могут активироваться и непосредственно модулировать фиброгенез [22].
Процесс эпителиально-мезенхимальной трансдифференциации (ЭМТ) условно подразделяют на 4 составляющих, включающих утрату адгезивных свойств, экспрессию de novo альфа-актина гладкомышечными клетками, разрушение базальной мембраны канальцев и собственно нарастающую клеточную трансформацию из эпителиального в мезенхимальный фенотип. Процесс ЭМТ регулируется рядом факторов, которые стимулируют (TGF-β, эпителиальный фактор роста, интерлейкин-1, ангиотензин II, матриксная металопротеиназа-2, коллаген II типа) или ингибируют (костный морфогенетический белок-7, фактор роста гепатоцитов) клеточную трансдифференцировку.
Триггером ЭМТ может быть гипоксия, которая также индуцирует апоптоз канальцевых клеток.
Межклеточные механизмы ЭМТ включают фосфорилирование Smad-2 и Smad-3, формирующих комплекс с Smad-4 и транслоцирующихся внуть ядра, где они индуцируют транскрипцию TGF-β-индуцируемых генов. Кроме того, TGF-β активирует другие пути регуляции воспаления и фиброза, в
частности p38 MAPK и RhoA [23]. Фиброз – универсальная составляющая прогрессирования всех хронических заболеваний почек, в итоге приводящая к терминальной почечной недостаточности (ТПН). Именно выраженность фиброза ТИТ считают наиболее точным предиктором необратимой потери почечной функции и прогрессирования хронической почечной недостаточности [24]. Механизмы регуляции почечного, в т. ч. тубулоинтерстициального, фиброгенеза меняются в
зависимости от его стадии (табл. 3) [23].
Таблица 3. Ключевые этапы тубулоинтерстициального фиброгенеза
Одним из важных составляющих тубулоинтерстициального повреждения является оксидативный стресс, реализующийся при нарушении баланса между продукцией активных радикалов кислорода (АРК) и актиоксидантной защиты. Так, показано, что при экспериментальной АГ в условиях блокады эндотелиальной NO-синтазы интенсивность перекисного окисления липидов в наибольшей степени нарастает именно в структурах почечных канальцев; усиливал ее ангиотензин II, блокировал – витамин Е. Активное перекисное окисление липидов в почечном тубулоинтерстиции предшествовало ухудшению функции почек [25].
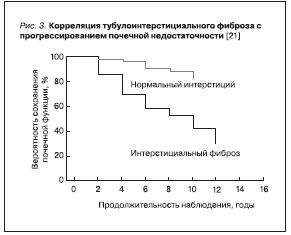
Повреждение ТИТ представляет собой одну из ключевых детерминант формирования хронической почечной недостаточности: первые аргументы в пользу этого были получены еще в конце 1960-х гг. [26] при обследовании пациентов, страдающих хроническим гломерулонефритом, и в дальнейшем были подтверждены при наблюдении за пациентами, страдающими различными морфологическими формами его, в т. ч. мезангиопролиферативным, мезангиокапиллярным гломерулонефритом, а также мембранозной нефропатией [21]. Показано, что степень ТИФ не только коррелирует с исходной
(в момент выполнения биопсии почки) выраженностью нарушений клубочковой и канальцевой функций, но и позволяет прогнозировать темп развития ТПН (рис. 3).
В настоящее время не вызывает сомнений, что при некоторых хронических нефропатиях, например диабетической, степень нарастания интерстициального фиброза прямо коррелирует со снижением клиренса эндогенного креатинина [27]. В основе этого клинического феномена лежит т. н. феномен атубулярных клубочков, определенное время сохраняющих функциональную полноценность, но
не реализующих свои функции из-за глобального фиброза почечного тубулоинтерстиция. Таким образом, относительно сохранная клубочковая структура не подразумевает нормальное функционирование нефрона. Это во многом объясняет преимущество использования оценки состояния
ТИТ при АГ при изучении почечной функции и оценке прогноза пациента.



