Введение
Из ранее проведенных исследований известно, что одной из значимых проблем, с которой сталкиваются интернисты при лечении декомпенсации кровообращения (ДК), – это снижение функции почек. Прежде всего при ДК страдает натрийуретическая функция почек. Это обусловлено применением больших доз петлевых диуретиков с коротким периодом полувыведения. Как известно, их применение приводит к «рикошет»-синдрому, что способствует возникновению субклинического воспаления и в дальнейшем приводит к фиброзу тубулоинтерстициальной ткани (ТИТ) почек. Вышесказанное способствует избыточной задержке натрия, гиперактивации ренин-ангиотензин-альдостероновой системы (РААС), что приводит к удлинению периода ДК и увеличению смертности пациентов. На настоящий момент достаточно трудно определить натрийурез у пациентов с ДК, т.к. прямое определение натрия не отражает истинного натрийуреза у пациентов, находящихся на мочегонной терапии. Поэтому целью исследования стало изучение натрийуретической функции почек пациентов с систолической сердечной недостаточностью в период декомпенсации кровообращения.
Материал и методы. Исследование выполнено в рамках Павловского регистра [1]. Регистр был сформирован в 2009 г. и включил 1001 пациента с декомпенсацией ХСН, из них 42% мужчин и 58% женщин, средний возраст которых составил 69,4±11,8 года. В исследование были включены пациенты с систолической сердечной недостаточностью, амбулаторно находившихся на постоянной терапии, включая диуретическую, поступившие в стационар по поводу декомпенсации хронической сердечной недостаточности (ХСН). Критерий исключения: сниженная скорость клубочковой фильтрации (СКФ) – ниже 15 мл/мин/1,73 м2. Из анализа были исключены пациенты, умершие с 1-го по 7-й день госпитализации.
Для изучения натрийуретической функции почки данной когорты пациентов использован альтернативной маркер низкого уровня натрийуреза – фракционная экскреция мочевой кислоты. Определение фракционной экскреции мочевой кислоты проведено при поступлении и через 7 дней; определение проводилось методом ИФА в суточной моче и крови с дальнейшим расчетом фракционной экскреции мочевой кислоты (FE UA) по формуле:
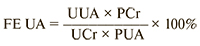
где UUA – уровень мочевой кислоты в моче, UCr – уровень креатинина в моче, PUA – уровень мочевой кислоты в плазме, PCr – уровень креатинина плазмы.
При FE UA<12% уровень натрийуреза считался менее 30 ммоль/л в сутки.
Семидневный интервал был выбран в связи с тем, что, по данным биоимпеданосметрии, у абсолютного большинства пациентов количество свободной жидкости за тот период снизилось на 70–80% от исходного, а также наступила клинически значимая положительная динамика – регресс отеков, снижение функционального класса сердечной недостаточности по тесту 6-минутной ходьбы.
 Таким образом, анализировались два полярных состояния: декомпенсация и стабилизация состояния.
Таким образом, анализировались два полярных состояния: декомпенсация и стабилизация состояния.
Методы статистической обработки
Для статистической обработки полученных данных использовали программное обеспечение Statistica.10. Нормальность распределения определена с помощью критерия Шапиро–Уилка. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M)±стандартное отклонение (SD) или медиана, 25-й и 75-й процентили. Сравнение непрерывных величин проведено с помощью критерия Вилкоксона. Сравнения нескольких зависимых групп проведено ранговым дисперсионным анализом Фридмана. Анализ зависимостей проводился с помощью коэффициентов корреляции Спирмена и конкордации Кендалла. Статистически значимыми признавали значения р<0,05.
Результаты
Критериям включения соответствовало 127 больных. Абсолютное большинство пациентов имели выраженную одышку и отеки нижних конечностей. Клиническая характеристика пациентов представлена в табл. 1. Средний возраст включенных в исследование пациентов составил 70±11 лет, при этом 66% пациентов были старше 70 лет. Дефицит массы тела менее 10% имели 4,2% пациентов, у 32% ИМТ составил больше 30 кг/м2, у 9% пациента уровень систолического давления был ниже 110 мм рт.ст., у 29% пациентов уровень гемоглобина был ниже 110 г/л, гипонатриемия (Naплазмы≤135 ммоль/л) отмечена у 9%. Значительное снижение фракции выброса (ФВ) менее 30% зарегистрировано у 32,8% пациентов, тахикардия более 100 ударов в минуту отмечена в 32% случаев, При этом ЧСС выше 130 ударов в минуту имели 4 (2,2%) пациента. Мерцательная аритмия была у 38% пациентов, из них у 24% – постоянной формы. Медиана задержки жидкости составила 7,4 л, мода – 11 литров, при этом уровень диуреза в среднем составил 890±320 мл.
В табл. 1 представлены препараты, полученные пациентами. На функцию почек, как известно, оказывают прямое влияние иАПФ, сартаны и диуретики. Абсолютное большинство пациентов получали эналаприл, причем дозу, превышающую 50% от терапевтической. Петлевой диуретик фуросемид получали 70% пациентов, причем 6 пациентов – в дозе, превышающей 100 мг. Всем пациентам в стационаре проведена терапия, согласно рекомендациям ОССН от 2013 г. Коррекция дозы диуретика на повышение в течение первых семи дней после госпитализации для достижения клинического эффекта понадобилась 32% пациентов. Средняя доза петлевого диуретика на 7-й день госпитализации составила 32±17 мг. Следует отметить, что 96% пациентов в день госпитализации были переведены на парентеральное введение диуретиков, к 7-му дню 43% были переведены вновь на пероральный прием препарата.
Сравнение исходного натрийуреза и через 7 дней лечения значимой динамики не показало, т.к. на фоне применения высоких доз диуретиков судить об истинном натрийурезе невозможно.
Всем пациентам (n=127) была определена FE UA (табл. 2). При поступлении медиана FE UA составляла 11%. Стоит отметить, что 25-й перцентиль составил 10%, что свидетельствует об увеличенной реабсорбции натрия и натрийурезе менее 30 ммоль/л в сутки для абсолютного большинства пациентов. На седьмой день госпитализации FE UA составила 15 % [13; 15], что говорит об увеличение натрийуреза.
Результаты исследования показали, что уровень экскреции натрия не претерпел существенных изменений в интервале декомпенсация–стабилизация состояния (корреляции отсутствовали), а уровни FE UA (рис. 1), в отличие от натрийуреза, подвержены достоверной положительной корреляции (r=0,28; p<0,05) между EF UA на момент поступления и через 7 дней. Анализ медиан натрийуреза 1-х и 7-х суток показал их рост с 178±108 до 236±126 ммоль/л соответственно, но не достиг статистической значимости (p=0,2), при этом FE UA 1-х и 7-х суток претерпела рост с 11±1,8 до 15,0±1,9%, что было статистически значимо (p<0,001).
При дальнейшем анализе значимости FE UA была выявлена тесная связь между уровнями FE UA и свободной жидкости, измеренными биоимпедансным методом (r=0,59 p<0,05).
В то время как взаимосвязь натрийуреза с уровнем свободной жидкости была обратной и недостоверной (r=-0,014; p>0,05). Стоит отметить, что отсутствие тесной связи уровня натрийуреза и объема свободной жидкости справедливо только для пациентов с тяжелой ХСН в стадии декомпенсации, получавших высокие дозы мочегонных. Эти данные не распространяются на здоровых людей, не получающих мочегонные препараты, у которых связь изучаемых параметров – обязательный компонент гомеостаза.
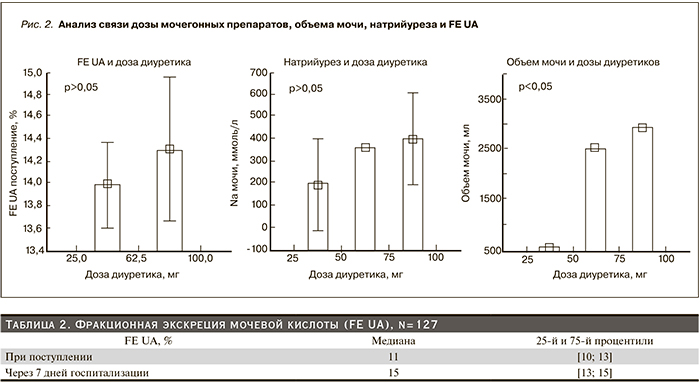
 На рис. 2 представлен анализ взаимосвязи дозы мочегонных препаратов, объема мочи, натрийуреза и FE UA. Прослеживается тесная взаимосвязь между повышением дозы диуретика и ростом анализируемых показателей. Статистически значимые различия были выявлены для уровня натрийуреза 256±141ммоль/л и объема мочи 1698± 492 л (p<0,05), также был отмечен рост EF UA на 3±0,3%, но не достигший статистически значимых различий с исходными значениями, что позволяет сделать вывод об отсутствии значимого влияния диуретика на экскрецию мочевой кислоты.
На рис. 2 представлен анализ взаимосвязи дозы мочегонных препаратов, объема мочи, натрийуреза и FE UA. Прослеживается тесная взаимосвязь между повышением дозы диуретика и ростом анализируемых показателей. Статистически значимые различия были выявлены для уровня натрийуреза 256±141ммоль/л и объема мочи 1698± 492 л (p<0,05), также был отмечен рост EF UA на 3±0,3%, но не достигший статистически значимых различий с исходными значениями, что позволяет сделать вывод об отсутствии значимого влияния диуретика на экскрецию мочевой кислоты.
Исходя из того что объем свободной жидкости детерминирован метаболизмом натрия, а экскреция мочевой кислоты рассматривается как маркер реабсорбции натрия, в качестве маркера изменения натрийуреза возможно использование именно уровня FE UA.
Обсуждение
Проблему диагностики нарушений натрийуреза впервые стали изучать у пациентов с гипонатриемией. Определение типа гипонатриемии (гипо-, эу-, гиперволемическая) выявило, что снижение суточного натрийуреза ниже 30 ммоль/л у пациентов с гипонатриемией и выраженной задержкой жидкости свидетельствует о гиперволемическом нарушении натриевого гомеостаза [2], в то время как у пациентов с эуволемическим нарушением натриевого гомеостаза концентрация натрия в моче превышает 30 ммоль/л. Таким образом, уровень 30 ммоль/л стал диагностически значимым параметром, позволяющим оценивать натрийурез. В настоящее время ведется поиск маркеров, не подверженных влиянию диуретической терапии и позволяющих оценивать натрийуретическую функцию почек. Несомненно, 24-часовая диагностика экскреции натрия и фракционная экскреция натрия могли бы занять ведущие место в диагностике нарушений натриевого гомеостаза у пациентов с ДК, однако при применении диуретиков их результаты становятся клинически не информативными. В 1992 г. было предложено использовать в качестве альтернативного маркера фракционную экскрецию мочевины [3]. Применение этого маркера позволяет оценивать функцию проксимального канальца почек и при этом пренебрегать влиянием диуретика. Чувствительность метода, по данным авторов [4], составляет около 90–96% в диагностике острого почечного повреждения. Однако большей специфичностью в отношении именно изменений натрийуреза обладала фракционная экскреция мочевой кислоты 1,0 и чувствительность 0,86 [5]. Диагностическая ценность этого маркера доказана в ряде исследований [5–7].
У здорового человека EF UA составляет в среднем 10%, у пациентов с натрийурезом, значительно превышающим 30 ммоль/л в сутки, EF UA значительно больше 12%, тогда как у пациентов с натрийурезом менее 30 ммоль/л в сутки EF UA меньше 12%, как правило, меньше 8% [8]. Вышеизложенное позволило нам предположить, что данный маркер может быть информативным для диагностики изменения натрийуреза у пациентов с ДК, находящихся на диуретической терапии. Так, если EF UA<12%, то натрийурез значительно меньше 30 ммоль/л в сутки, что позволяет предполагать у таких пациентов значительно возросшую реабсорбция натрия, тогда как при EF UA>12% натрийурез значительно больше 30 ммоль/л в сутки, что позволяет предполагать неизмененный уровень реабсорбции.
В выполненном нами исследовании показано, что мониторирование уровня натрийуреза на момент госпитализации и через 7 дней диуретической терапии не выявило прогностических закономерностей, в отличие от EF UA. Рост экскреции EF UA свидетельствовал об успехе проведенной мочегонной терапии, сопровождался увеличением объема мочи и снижением уровня свободной жидкости. Так как реабсорбция натрия связана с реабсорбцией уратов в проксимальном канальце, можно предполагать, что у пациентов, не изменивших уровень EF UA, сохраняется повышенная реабсорбция натрия как при мочегонной терапии, так и при ее отмене или снижении дозы препарата, что, бесспорно, способствует быстрому развитию декомпенсации ХСН.
На сегодняшний день из доступной нам литературы удалось обнаружить только одно исследование, посвященное изучению EF UA как маркера функции почек. В исследовании M. Saeed и соавт. [9] изучалась прогностическая роль таких маркеров, как фракционная экскреция мочевой кислоты и отношение мочевины к креатинину. В исследование были включены 140 пациентов с сердечной недостаточностью, наблюдаемых амбулаторно. Всем производилось однократное измерение EF UA и мочевины/креатинина. По результатам этого исследования EF UA не зарекомендовала себя как маркер поражения почек, в отличие от мочевины/креатинина. Такой результат мы объясняем тем, что уровень экскреции определяли не в динамике, а однократно. Разовое измерение уровня экскреции мочевой кислоты не может рассматриваться как информативный скрининговый метод. Клинически и прогностически значима только динамика экскреции мочевой кислоты в ответ на мочегонную терапию. Полученные нами данные позволяют считать, что рост экскреции мочевой кислоты – прогностически благоприятный параметр: чем выше становился уровень экскреции мочевой кислоты, тем выше натрийурез.
В ряде исследований пациентов с гипонатриемией изучалась и была доказана диагностическая ценность альтернативных маркеров низкого натрийуреза – мочевой кислоты [10].
В проведенном нами исследовании гипонатриемия развилась у 9 пациентов (уровень натрия ≤135 мкэквл/л), интересно отметить, что у этих пациентов рост уровня экскреции мочевой кислоты превышал 19%, что позволяет высказаться об уровне экскреции мочевой кислоты как о предикторе развития гипонатриемии.
Наше исследование показывает, что EF UA может быть использована как альтернативный маркер натрийуреза, особенно диагностически значимого его низкого уровня.
Преимущества определения EF UA заключаются в достаточной его простоте и малой инвазивности, тогда как для определения натрийуреза стандартным методом необходим сбор мочи и подсчет ее объема в течение суток, что вызывает определенные сложности у пациентов. Следует отметить сложность определения натрийуреза у пациентов с ДК, т.к. назначенные им мочегонные препараты в значительной степени изменяют натрийурез [11, 12]. Для определения натрийуретической функции почек этой когорте требуется отмена мочегонной терапии на несколько дней, что является недопустимым, особенно для пациентов с тяжелой ХСН в период декомпенсации. Как показало наше исследование, при определении уровня EF UA эффект мочегонных нивелирован, что дает возможность определить натрийурез у пациентов с ДК. Большое значение EF UA имеет как маркер натрийуреза у пациентов, бесконтрольно принимающих мочегонные препараты, особенно в больших дозировках, т.к. это приводит к выраженному снижению натрийуреза и воспалению в ТИТ почек, а затем как следствие – к его фиброзу.
Определение EF UA как альтернативного маркера низкого уровня натрийуреза позволит корректировать диуретическую терапию больных ХСН, особенно в период ДК, где зачастую требуется увеличение доз диуретиков. Также своевременное определение низкого натрийуреза при помощи альтернативного маркера – EF UA, позволит уменьшить частоту ДК, длительность ДК, а возможно, и предотвратить развитие декомпенсации ХСН еще на догоспитальном этапе.



