Введение
Часто встречаемое в клинической практике сочетание застойной сердечной недостаточности, хронической почечной недостаточности (ХПН) и анемии, объединенных в кардиоренальный анемический синдром, позволяет ряду авторов рассматривать повреждение почек в качестве вероятной причины развития анемии у кардиологических больных [1–5].
Почки участвуют в патогенезе хронической сердечной недостаточности (ХСН) на всех этапах, оказывая влияние на системную гемодинамику. Это в значительной степени обусловлено центральным местом почек в регуляции обмена натрия и воды, синтеза и метаболизма ключевых медиаторов (ангиотензина II, альдостерона, натрийуретических пептидов) [6]. В условиях прогрессирующего падения сердечного выброса дисбаланс в соотношении прессорных/депрессорных систем с преобладанием вазоконстрикторных реакций приводит к снижению кровотока в приносящих артериолах, почечного перфузионного давления и скорости клубочковой фильтрации (СКФ) [7]. Одновременно с нарушением функции в почках развиваются структурные изменения, заканчивающиеся формированием нефросклероза. Деструкция почечных клеток и почечный фиброз могут стать причиной снижения продукции эритропоэтина почками (ЭПО).
Вероятно, наблюдаемые закономерности стали основанием для предположения о наличии прямой связи между уровнем клубочковой фильтрации и количеством ЭПО, производимого фибробластами коры и внешней медуллы почек [8]. Существует мнение, будто СКФ может служить интегральным показателем, определяющим уровень его синтеза в почках [9]. Однако в клинических исследованиях, наоборот, отмечено повышение содержания ЭПО в крови больных с увеличением функционального класса (ФК) ХСН [10, 11]. Кроме того, при ХСН помимо нейрогуморальных и гемодинамических нарушений имеет место постоянная активация иммунной системы, обусловливающая сохранение повышенных концентраций сывороточных провоспалительных цитокинов, в первую очередь фактора некроза опухолей α (ФНО-α), способного снижать воспроизводство ЭПО в организме [6]. Следовательно, возникает вопрос: насколько значения СКФ и ЭПО у больных ХСН тесно связаны между собой, поскольку публикуемые данные часто противоречивы [12, 13]?
Цель исследования
Оценить возможность использования расчетной СКФ в качестве универсального критерия при выборе показаний к ЭПО-терапии больных ХСН.
Материал и методы
В исследование включены 256 больных верифицированной ХСН II–IV ФК NYHA на фоне ишемической болезни сердца (ИБС) или сочетания ее с артериальной гипертензией (в 226 случаях). Верификация ХСН осуществлялась в соответствии с Национальными рекомендациями ОССН [14]. Об ишемическом генезе заболевания свидетельствовали приступы стенокардии напряжения II–IV ФК у 223 больных. Инфаркт миокарда в прошлом перенесли 113 больных (признаки рубцовых изменений миокарда на электрокардиограммах, зоны гипо- и акинезии при эхокардиографическом исследовании, анамнестические данные). Аритмический вариант ИБС отмечен в 33 случаях. Мужчин было 132, женщин – 124. Средний возраст больных в целом – 70,0±11,0 лет, при этом у мужчин он составил 67,0±9,0 лет, у женщин – 72,5±9,5. Критериями исключения служили гематологические (лейкозы, миелодиспластический синдром), инфекционные и иммуновоспалительные заболевания, злокачественные новообразования, ранее установленная ХПН, применение эритропоэзстимулирующих препаратов или железа. Основные количественные показатели красной крови оценивали на автоматическом гематологическом анализаторе МЕГ-6400К (Россия): количество эритроцитов и гемоглобина (Hb) в одном литре крови, величину гематокрита (Hct), эритроцитарные индексы – среднее содержание гемоглобина в одном эритроците (МСН), средний объем эритроцита (МСV). Анемию диагностировали по критериям ВОЗ при уровне Hb <130 г/л у мужчин и <120 г/л у женщин. Уровень креатинина (Кр) в сыворотке крови определяли на автоматическом биохимическом анализаторе «Sapphire 400» (Япония) псевдокинетическим двухточечным методом (набор реактивов ВИТАЛ). Значения >133,0 мкмоль/л у мужчин и >124,0 мкмоль/л у женщин рассматривали как признак поражения почек [15].
С учетом зависимости концентрации сывороточного Кр от многих факторов рассчитывали СКФ по формуле MDRD. Данная формула может быть использована больными ХСН и другими сердечно-сосудистыми заболеваниями [16]. Хроническую болезнь почек устанавливали по расчетной CКФ <60 мл/мин/1,73 м2, сохранявшейся на протяжении 3 и более месяцев [17]. Кроме того, одномоментно в сыворотке крови больных измеряли на иммуноферментном анализаторе «Personal LAB» (Италия) методом двухсайтового твердофазного иммуноферментного анализа уровень ЭПО (набор реактивов «Biomerica EPO ELISA», содержащий два вида мышиных моноклональных антител к определенным участкам человеческого ЭПО) и концентрацию ФНО-α (набор реактивов «BioSource hTNF-α ELISA» – моноклональные антитела к человеческому ФНО-α).

Уровень С-реактивного белка (С-РБ) в сыворотке крови определяли на полуавтоматическом биохимическом анализаторе «Stat fax 1904 Plus» (США) иммунотурбидиметрическим методом. Статистическая обработка результатов выполнена в пакете программ Statistica 6.0. Проверка соответствия выборок нормальному закону распределения проведена методами Колмогорова–Смирнова и Шапиро–Уилка. Для представления нормально распределенных количественных признаков использованы среднее значение признака и среднеквадратичное отклонение. При поиске связей между переменными рассчитан коэффициент корреляции Пирсона «r». Для оценки статистической значимости корреляции использован критерий Стьюдента. Корреляцию считали статистически значимой при р<0,05. Построение графиков результатов наблюдений осуществлено методом полиномиальной регрессии.
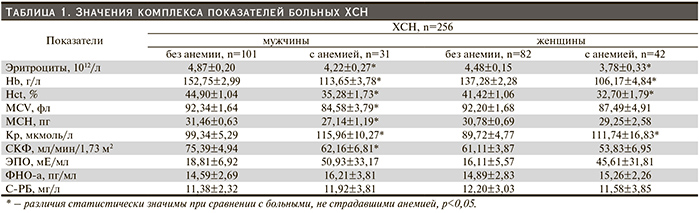
Результаты. Больных ХСН первоначально разделили на гендерные группы, в каждой из которых по состоянию периферического отдела эритрона выделили подгруппы: 1-я – без анемии, 2-я – с анемией. В группе женщин анемия выявлена у 42 из 124 (33,9%), а в группе мужчин у 31 из 132 (23,5%). Анемия носила преимущественно нормоцитарный нормохромный (20 мужчин и 30 женщин) или гипохромный характер (4 мужчины и 5 женщин). В остальных случаях была микроцитарной гипохромной. У больных 2-й подгруппы оказались достоверно сниженными не только эритроцитарные параметры, но и эритроцитарные индексы. Последнее в большей мере относилось к мужчинам (табл. 1). При сравнении уровней сывороточного Кр в гендерных группах обнаружены также статистически значимые различия между больными 1-й и 2-й подгрупп (табл. 1). Значения СКФ <60 мл/мин/1,73 м2 получены от 105 из 256 больных (41,0%). Данный критерий хронической болезни почек выявлен у 36 (27,3%) мужчин и у 69 (55,6%) женщин. В 15 и 29 случаях соответственно она сочеталась с анемией. Однако только у мужчин по значениям СКФ получены статистически значимые различия 1-й подгруппы со 2-й (табл. 1). Диапазон колебаний уровня сывороточного ЭПО у всей совокупности больных ХСН составил от 1,44 до 532,23 мЕ/мл. В 14,5% (37 из 256) случаев содержание гормона в крови превышало 30 мЕ/мл. Среди них половина страдала анемией (8 женщин и 10 мужчин). Поэтому отличия 1-й от 2-й подгрупп не были статистически значимыми ни у женщин, ни у мужчин (табл. 1). Следует отметить, что повышенные и высокие уровни ЭПО в крови отмечены у 5 мужчин и 5 женщин, имевших наряду с анемией и почечную дисфункцию. Наличие системной воспалительной реакции в организме больных ХСН подтверждали повышенные концентрации сывороточного ФНО-α (от 8,82 до 97,13 пг/мл), зарегистрированные в 242 (94,5%) случаях. Одновременно с увеличением его содержания в крови у 143 больных определялись повышенные уровни С-РБ (от 8 до 45,1 мг/мл). Значения обоих показателей 1-й и 2-й подгрупп статистически значимо не различались (табл. 1).
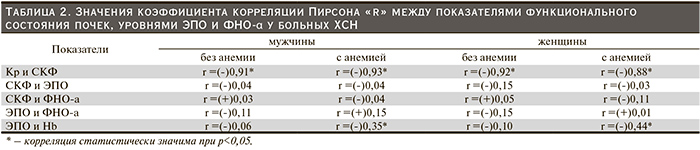
Корреляционный анализ изменений сывороточных уровней ЭПО, Кр, расчетной СКФ, концентрации ФНО-α и Hb в крови больных позволил выявить следующие закономерности (табл. 2). В обеих гендерных группах уровни ЭПО у больных с нормальными показателями периферической красной крови и с анемией не коррелировали статистически значимо с величиной СКФ. Не обнаружено также статистически значимой корреляции последней и концентрации сывороточного ФНО-α. То же относилось и к ЭПО–ФНО-α. Значения коэффициента корреляции ЭПО–Нb у мужчин и женщин с анемией указывали на наличие устойчивой зависимости между этими параметрами в отличие от больных, имевших нормальные показатели периферической красной крови. Графически поведение исследуемых показателей в группах представлено на рис. 1 и 2.
Обсуждение
Хроническую болезнь почек диагностируют у 20–40% больных ХСН [18–20]. Полученные нами данные относительно частоты случаев снижения функции почек при рассматриваемой патологии в целом соответствуют этим результатам. Вместе с тем у более чем половины больных поддерживалось нормальное течение эритропоэза, поскольку эритропоэтическая функция оставалась сохраненной. Хотя уровни ЭПО не превышали 13,99 мЕ/мл, тем не менее обеспечивали преобладание стимулирующего влияния на эритропоэз в балансных соотношениях с ФНО-α (рис. 1, 2).
У женщин, страдавших ХСН, сочетание анемии и почечной дисфункции наблюдалось чаще (29 из 42). Однако в большинстве таких случаев (19 из 29) уровень ЭПО, циркулирующего в крови больных, поддерживался в пределах физиологической нормы (от 5 до 30 мЕ/мл) [21] или был повышенным (у 5). Среди обследованных мужчин с ХСН, хронической болезнью почек и анемией сниженных значений сывороточного ЭПО не отмечено, а заметный рост синтеза гормона в ответ на гипоксию имел место у 5 из 15 больных.
У больных с анемией обеих гендерных групп выявлена статистически значимая обратная корреляционная связь между ЭПО и Нb (табл. 2). При этом 18 из 73 больных ХСН с анемией обеих гендерных групп имели уровни гормона в крови, превышающие 30 мЕ/мл. У 8 они превысили 100,0 мЕ/мл.
В числе последних больных выделялись двое, у которых при концентрации Hb 96–103 г/л содержание ЭПО достигло 488,14–532,23 мЕ/мл на фоне сниженных значений расчетной СКФ до 30,9–35,8 мл/мин/1,73 м2 и имеющегося воспаления (ФНО-α – 23,07 и 26,89 пг/мл). Дополнительная продукция ЭПО почками в ответ на гипоксию должна была бы активировать эритропоэз. Однако, несмотря на столь высокий уровень сывороточного ЭПО, ожидаемой интенсивной стимуляции костного мозга не наблюдалось, кислородтранспортная функция крови оставалась сниженной.
Аналогичные результаты получены на модели посттрансфузионной полицитемии у крыс, где по мере ее развития снижалась чувствительность резидуальных макрофагов костного мозга к рекомбинантному человеческому ЭПО, препятствующая формированию морфо-функциональных единиц эритропоэза – эритробластических островков [22] de novo в культуре [23], и замедляющая прохождение клеточного цикла эритроидных клеток в их эритроидной «короне» [24]. В другом эксперименте на животных введение больших доз ЭПО в течение нескольких недель приводило к отсутствию ответа эритроидного ростка костного мозга на ЭПО [25]. Описаны случаи малой эффективности больших доз препаратов рекомбинантного ЭПО при лечении анемии у больных ХСН и хронической болезнью почек [26].
Резистентность к ЭПО пытаются объяснить несколькими причинами: связанной с воспалением продукцией цитокинов, повреждением рецепторов к ЭПО в костном мозге, цитолизом вновь образованных незрелых эритроидных клеток [26, 27]. Однако как у мужчин, так и у женщин в обеих обследованных нами подгруппах зарегистрированы практически одинаковые концентрации сывороточных ФНО-α и С-РБ (табл. 1). Отсутствие статистически значимой корреляции между уровнем ЭПО и концентрацией ФНО-α в крови (табл. 2) позволяет утверждать, что недостаточная для стимуляции эритропоэза высокая продукция ЭПО при имеющейся сниженной кислородной емкости крови не могла быть напрямую связана с хронической воспалительной реакцией.
В нашем исследовании случаи выраженной ЭПО-резистентности привлекают внимание не только чрезмерно высокими уровнями сывороточного ЭПО (>400 мЕ/мл), но и неблагоприятным исходом на стационарном этапе – смертью двух из трех больных от основного заболевания (IV ФК ХСН, фракция выброса левого желудочка <30,0%). О подобном совпадении сообщали и другие исследователи [28, 29].
До настоящего времени нет единого мнения в отношении уровня СКФ, при котором эритропоэтическая функция почек остается сохранной. По результатам одних исследователей анемия на фоне ХПН развивается при снижении СКФ до 30–40 мл/мин [30], другие указывают на более раннее появление анемии при уровне СКФ 60–70 мл/мин [31]. У обследованных нами больных ХСН синтез ЭПО в ответ на гипоксию (циркуляторную в сочетании с гемической) не прекращался и был весьма активен при выраженном снижении СКФ до 25,8 мл/мин/1,73 м2. Об этом свидетельствовал его уровень в крови, составивший 176,86 мЕ/мл.
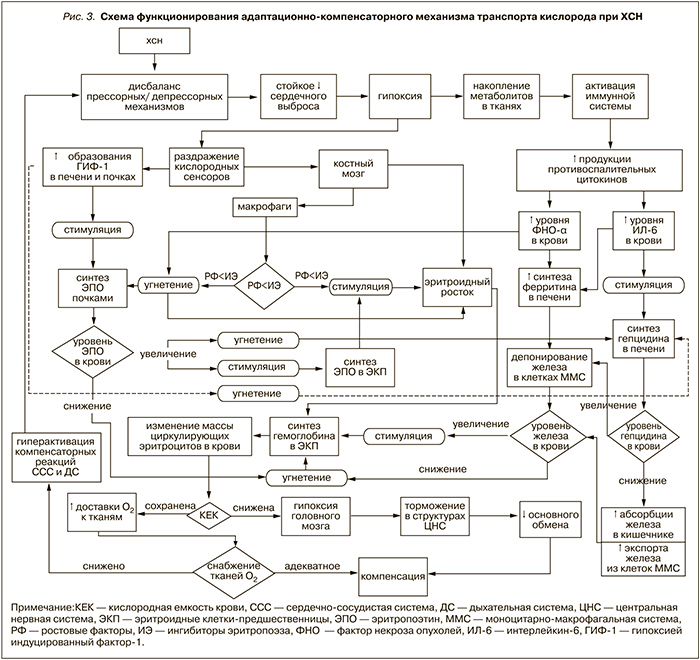
Таким образом, данные нашего исследования не позволяют однозначно утверждать, что почечная дисфункция у больных ХСН относилась к ведущим факторам, негативно влияющим на уровень продукции ЭПО. Не следует забывать, что адаптивно-компенсаторные реакции организма обеспечиваются активацией массы факторов, взаимодействующих синергически и антагонистически (рис. 3). Вероятно, при снижении эритропоэтической функции почек филогенетически сформировавшаяся система саморегуляции организма может отвечать на выраженный гипоксический стимул путем увеличения внепочечной продукции гормона [32]. В связи с этим и нет оснований рассматривать расчетную СКФ в качестве универсального критерия выбора показаний к ЭПО-терапии данной категории больных.
Возможно, наблюдаемые параллельные изменения выделительной и эритропоэтической функции почек служат результатом воздействия со стороны какого-либо общего фактора (факторов), следовательно, до формирования четкого представления об этом механизме оценка критериев показаний к ЭПО-терапии должна носить индивидуальный характер [33].



