Введение
Одним из прогностически значимых осложнений острого коронарного синдрома служит острое почечное повреждение (ОПП). По данным C. Fox и соавт., развитие ОПП в этой когорте больных ассоциируется прежде всего с увеличением смертности и продолжительности госпитализации [1]. В настоящее время отдаленный прогноз пациентов с ОКС, перенесших ОПП, определяется не только высоким сердечно-сосудистым риском, но и возможностью формирования de novo или прогрессированием уже имеющейся хронической болезни почек (ХБП) [2].
Целью нашей работы стало изучение клинической значимости исследования комплекса мочевых маркеров почечного повреждения – альбуминурии, KIM-1 и NGAL, у больных ОКС, в т.ч. осложнившегося развитием ОПП.

Материал и методы
В исследование включены 70 пациентов с ОКС – 45 (64%) мужчин и 25 (36%) женщин, средний возраст – 64 [54;74] года, доставленных бригадой скорой медицинской помощи в Региональный сосудистый центр г. Владимира за период с декабря по июнь 2013 г. При дальнейшем обследовании в соответствии с национальными рекомендациями [3–5] 20 (28,6%) пациентам установлен диагноз нестабильной стенокардии (НС), 50 (71,4%) – острого инфаркта миокарда (ИМ). Клиническое состояние больных оценивали с помощью общепринятых методов (опрос, осмотр, физическое обследование). Всем пациентам проведены общий и биохимический анализы крови, включая определение активности кардиоспецифических ферментов, ЭКГ регистрировали в 12 стандартных отведениях. Систолическая функция миокарда левого желудочка оценена по стандартной методике на ультразвуковом аппарате VIVID-7 фирмы «General Electric, США». При поступлении всем включенным в исследование больным определен уровень сывороточного креатинина (Scr) и расчетная скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI (рСКФ-EPI) [6]. Развитие и тяжесть острого почечного повреждения оценены в соответствии с рекомендациями KDIGO (2012 ). Для диагно-стики ОПП использовано два основных критерия: почасовой диурез и динамика креатининемии за 48 часов. Контроль диуреза осуществлен в течение первых суток госпитализации каждые 6 часов при самостоятельном мочеиспускании (ни у одного пациента не было клинических показаний к катетеризации мочевого пузыря). Динамика креатининемии оценена двумя способами: в первые сутки госпитализации – расчетным методом (прирост креатинина сыворотки к его базальному уровню, соответствующему СКФ 75 мл/мин/1,75 м2), а по истечении 48 часов пребывания в стационаре – по приросту креатинина в сыворотке крови за первые двое суток наблюдения [7]. Кроме того, у всех пациентов с ОКС и у 10 практически здоровых лиц (средний возраст – 63 [48;76], мужчины:женщины=6:4) исследовали комплекс маркеров, характеризующих структурное повреждение почек. Величина альбуминурии (АУ) определена полуколичественным методом в утренней порции мочи (Micral-test, «Рош Диагностика ГмбХ», ФРГ). Экскрецию альбумина с мочой, превышающую 20 мг/л, считали признаком дисфункции почечных эндотелиоцитов и повышенной проницаемости гломерулярной базальной мембраны. О повреждении эпителия проксимальных почечных канальцев судили по величине экскреции с мочой KIM-1 (ELISA, «Human HAVCR Immunoassay, R&D Systems Europe, Ltd.) и NGAL (ELISA, «BioPorto Diagnostics A/S, Дания»).
 Статистический анализ
Статистический анализ
Результаты исследования оценены с помощью пакета прикладных программ StatSoft, Inc. STATISTICA, версия 7.0.
В описательной части для параметров с типом распределения, отличным от нормального, приведены медиана и интерквартильный размах. Сравнение независимых групп проведено с использованием критерия Манна–Уитни (U). При сопоставлении частот качественных переменных применен классический критерий χ2 по Пирсону с поправкой Йейтса. Оценка связей между количественными показателями проведена с использованием ранговой корреляции Спирмена (R). Для определения чувствительности и специфичности предикторов развития ОПП использован ROC-анализ. Различия показателей между группами считали достоверными при уровне значимости р<0,05.
Результаты исследования и их обсуждение
1. Показатели функции почек у больных ОКС (n=70)
В исследованной группе больных ОКС на момент поступления в стационар средний уровень креатининемии составил 103 [76; 197] мкмоль/л, гиперкреатининемия (Scr≥115мкмоль/л у мужчин, Scr≥107 мкмоль/л у женщин) была выявлена у 21 (30%) из 70 больных. В группе пациентов с ОКС (n=70) средний уровень рСКФ-EPI составил 58 [21;103] мл/мин/1,73 м2. У 66 (94%) из 70 обследованных рСКФ-EPI была ниже 90 мл/мин/1,73 м2, что указывает на снижение суммарной фильтрационной функции почек у подавляющего большинства пациентов. Из этих 66 пациентов у 27 (41%) рСКФ-EPI находилась в пределах 89–60 мл/мин/1,73 м2, у 38 (57%) – в диапазоне 59–30 мл/мин/1,73 м2, у 1 (2%) пациента рСКФ-EPI была менее 30 мл/мин/1,73 м2. Обращает на себя внимание, что у подавляющего большинства пациентов с ОКС (>90%) выявлена разной степени выраженности почечная дисфункция, в то время как гиперкреатининемия установлена лишь у 30% больных.
В соответствии с рекомендациям KDIGO наличие ОПП оценивают по критерию, параметры которого наиболее отклонены от нормальных значений. В нашем исследовании среди 70 пациентов с ОКС распространенность ОПП, диагно-стированного расчетным методом, составила 17% (n=12), по динамике креатининемии за первые 48 часов госпитализации – 15% (n=11), на основании оценки почасового диуреза – 89% (n=62). Среди 62 пациентов с ОКС у 33 (53%) была выявлена 1-я стадия ОПП, у 29 (47%) – 2-я, 3-я стадия не была выявлена ни у одного больного. Пациенты с ОКС, перенесшие острое повреждение почек – ОПП (+), группа I, и сохранившие нормальную функцию почек – ОПП (-), группа II, не различались по основным гендерным признакам (табл. 1).
В то же время частота формирования ОПП выше среди пациентов с инфарктом миокарда, чем при нестабильной стенокардии. Так, ОПП было выявлено у 47 (94%) из 50 пациентов с инфарктом миокарда и у 15 (75%) из 20 – с нестабильной стенокардией, (χ2=5,09, р=0,02). Однако нами не выявлено различий средней величины фракции выброса левого желудочка (ФВ ЛЖ, %) в группах пациентов с ОКС с наличием (группа I) и отсутствием ОПП (группа II) (46 [40;55] % против 48 [46;56] %, U=147, р=0,37). Частота выраженной систолической дисфункции миокарда левого желудочка с ФВ ЛЖ<40% в группах пациентов с ОПП (n=62) и без ОПП (n=8) также не различалась – 12 (19%) против 1 (12,5%), (χ2=0,22, р=0,63).
Представленные данные свидетельствуют о высокой частоте формирования ОПП при ОКС. Развитие ОПП в исследованной группе больных не зависело от пола и возраста пациентов, более тесно ассоциировано с инфарктом миокарда, чем нестабильной стенокардией, не связано с абсолютной величиной ФВ ЛЖ и выраженной систолической дисфункцией миокарда (ФВ ЛЖ<40%).
 2. Маркеры структурного повреждения почек у больных ОКС
2. Маркеры структурного повреждения почек у больных ОКС
Из 70 обследованных больных ОКС у 62 (89%) была выявлена клинически значимая альбуминурия, только у 8 (11%) пациентов экскреция альбумина с мочой не превышала 20 мг/л. Распределение больных с разной степенью выраженности альбуминурии представлено на рис. 1.
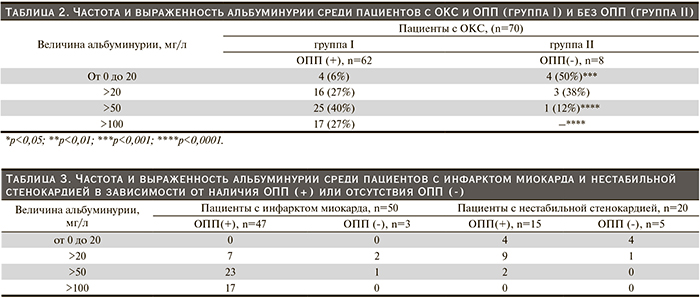
При изучении связи выраженности альбуминурии с наличием или отсутствием ОПП у больных ОКС установлено, что у 7 из 8 пациентов без ОПП альбуминурия отсутствовала или была минимальной (<20 мг/л), в то время как у подавляющего большинства пациентов с ОПП (68%, 42 из 62) альбуминурия была выраженной (>50 мг/л) (табл. 2).
Обращает на себя внимание, что у всех 50 пациентов с ИМ была обнаружена разной степени выраженности альбуминурия, в то время как у 8 из 20 пациентов с НС альбуминурия отсутствовала (табл. 3). Среди 43 пациентов с АУ>50 мг/л у 41 установлен диагноз ИМ, у 40 из них течение заболевания осложнилось развитием ОПП, только у 1 пациента с ИМ ухудшения функции почек отмечено не было. У оставшихся 2 из 43 пациентов с выраженной АУ (>50мг/л) ОПП развилось на фоне нестабильной стенокардии.
Представленные данные свидетельствуют о развитии у большинства пациентов с ОКС почечной дисфункции эндотелия с повышенной проницаемостью почечного фильтра для белков с низкой молекулярной массой, обладающих нефротоксическим потенциалом. Проявляющееся альбуминурией повреждение почечных эндотелиоцитов более выражено при развитии у пациентов с ОКС ОПП, при этом наиболее высокие значения альбуминурии выявляются у больных инфарктом миокарда и ОПП.
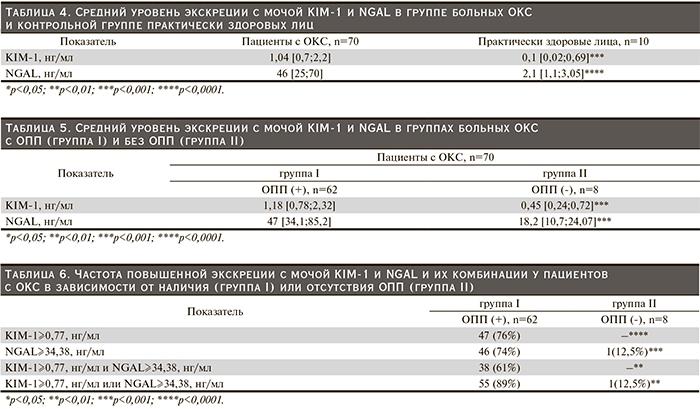
В связи с тем что дисфункция почек в большей степени определяется канальцевыми нарушениями, мы оценили мочевую экскрецию KIM-1 и NGAL у пациентов с ОКС по сравнению с практически здоровыми лицами (табл. 4).
Установлено, что величина экскреции с мочой как KIM-1, так и NGAL статистически значимо выше у пациентов с ОКС, чем у практически здоровых лиц. При сравнении уровней KIM-1 и NGAL в моче больных ОКС в зависимости от наличия ОПП обнаружено, что в группе больных ОПП (группа I) почечная экскреция обоих биомаркеров значимо выше, чем у 8 больных с сохранной функцией почек (группа II) (табл. 5).
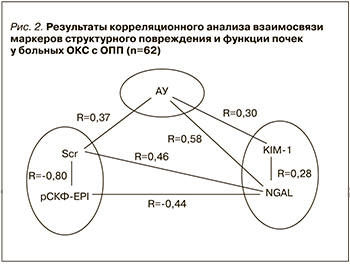
Таким образом, по сравнению с практически здоровыми лицами экскреция с мочой биомаркеров структурного повреждения почек – альбуминурии, KIM-1 и NGAL, у пациентов с ОКС повышена и достигает наибольших значений при развитии у них ОПП. Результаты проведенного корреляционного анализа подтвердили наличие тесной связи маркеров повреждения канальцевого эпителия (величина экскреции с мочой KIM-1 и NGAL) и почечных эндотелиоцитов (альбуминурия) с основными показателями, характеризующими функцию почек (уровень креатинина сыворотки крови и рСКФ-EPI ) в группе больных ОКС с ОПП (рис. 2).
Для оценки чувствительности и специфичности KIM-1 и NGAL как предикторов ОПП мы провели ROC-анализ. Установлено, что уровень в моче KIM-1≥0,77 нг/мл позволяет с чувствительностью 75,8% и специфичностью 100% (AUC 0,875) прогнозировать развитие ОПП у больных ОКС. Уровень экскреции с мочой NGAL≥34,38 нг/мл также является предиктором ОПП у пациентов с ОКС с чувствительностью 74% и специфичностью 100% (AUC 0,87).
 В исследованной нами группе больных ОКС повышенная экскреция с мочой биомаркеров повреждения тубулярного эпителия проксимальных почечных канальцев – KIM-1 (≥0,77 нг/мл) и NGAL (≥34,38 нг/мл), является клинически значимым прогностическим фактором развития ОПП. Мы сопоставили частоту повышенной мочевой экскреции KIM-1 и NGAL в группах пациентов с ОКС, а также с ОПП и без ОПП (табл. 6).
В исследованной нами группе больных ОКС повышенная экскреция с мочой биомаркеров повреждения тубулярного эпителия проксимальных почечных канальцев – KIM-1 (≥0,77 нг/мл) и NGAL (≥34,38 нг/мл), является клинически значимым прогностическим фактором развития ОПП. Мы сопоставили частоту повышенной мочевой экскреции KIM-1 и NGAL в группах пациентов с ОКС, а также с ОПП и без ОПП (табл. 6).
Как видно из представленных данных, у пациентов с ОКС и ОПП повышенные уровни в моче KIM-1 (≥0,77 нг/мл) и NGAL (≥34,38 нг/мл) выявляются практически с одинаковой частотой. В то же время повышенная экскреция с мочой NGAL (≥34,38 нг/мл) отмечена и у одного из 8 пациентов с ОКС без ОПП (группа II), что, по-видимому, свидетельствует о несколько большей специфичности KIM-1 для диагностики ОПП. Результаты проведенного нами исследования не выявили преимуществ одномоментного определения комплекса биомаркеров повреждения эпителия проксимальных почечных канальцев – KIM-1+NGAL, в диагностике ОПП.
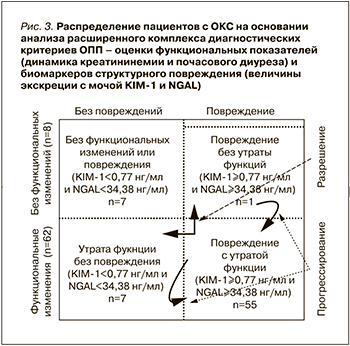
Распределение обследованных нами пациентов с ОКС в соответствии с новой, предложенной в 2013 г. ADQI диагностической моделью ОПП представлено на рис. 3. В соответствии с предложенной концепцией среди 70 обследованных нами пациентов с ОКС только у 7 острое повреждение почек отсутствовало и развитие его в дальнейшем представляется маловероятным. Еще 8 пациентов с ОКС (7 с клинической стадией ОПП – утрата функции, но без структурных повреждений проксимальных канальцев и 1 с субклинической стадией ОПП с сохранной функцией почек, но повышенной экскрецией KIM-1 или NGAL) нуждаются в тщательном мониторинге, т.к. находятся в группе риска прогрессирования поражения почек. У остальных 55 больных ОКС с маркерами структурного повреждения и дисфункцией почек высок риск не только ухудшения функции почек, но и утяжеления прогноза заболевания в целом.
Обсуждение
Внедрение в клиническую практику стандартизированных диагностических критериев ОПП (KDIGO, 2012), основанных на оценке динамики креатининемии и величины почасового диуреза, улучшило выявляемость острого почечного повреждения при ОКС, но не оказало значимого влияния на прогноз пациентов [8–11]. По результатам многочисленных клинических исследований, используемые для диагностики ОПП, функциональные показатели (прирост кретининемии и почасовой диурез) не обладают достаточной чувствительностью и специфичностью в группах больных с уже имеющейся почечной дисфункцией, – ХБП, или в клинических ситуациях, когда исходная функция почек не известна [12, 13].
Необходимость совершенствования диагностических критериев ОПП обосновывает поиск новых маркеров, не только характеризующих функциональное состояние почек, но и позволяющих оценивать тяжесть их структурных повреждений. Основными требованиями к новым биомаркерам служат их более высокая специфичность в диагностике ранней стадии ОПП, определении тяжести поражения почек, оценке прогноза заболевания. Среди изученных функциональных маркеров ОПП наиболее перспективным кандидатом для внедрения в клиническую практику (несмотря на наличие определенных ограничений) является цистатин С [14]. В гораздо более широком спектре биомаркеров, характеризующих структурное повреждение почек, наибольшее количество фактических данных получено в отношении ассоциированного с желатиназой нейтрофилов липокалина (NGAL), молекулы повреждения почек-1 (KIM-1), интерлейкина-18 [15–19]. Продолжают активно изучаться и сравнительно недавно идентифицированные молекулы – нетрин-1 и остеопонтин [20, 21]. Однако по результатам проведенных исследований ни один из маркеров-кандидатов не обладает абсолютной специфичностью для диагностики ОПП. Так, например, уровень синтезируемого в нейтрофилах NGAL повышается в сыворотке и моче не только больных ОПП, но и при воспалительных заболеваниях, неоплазиях, метаболических нарушениях, хронической дисфункции почек [22].
Неудовлетворенность клиницистов существующими критериями ОПП, а также полученные за последние годы экспериментальные и клинические данные о выделении кластера маркеров структурного повреждения почек стали основанием для формирования в 2013 г. новой концептуальной модели ОПП [23]. Расширение спектра диагностических критериев ОПП с возможностью выделения субклинической его стадии позволило разделить пациентов с ОПП на 4 группы в соответствии с клиническим профилем функциональных и лабораторных тестов, отражающих патоморфологию почечного повреждения.
Выводы
- Частота развития ОПП при ОКС составляет 89% и не зависит от возраста и пола пациентов.
- ОПП статистически значимо чаще развивается у больных инфарктом миокарда, чем нестабильной стенокардией, и не имеет прямой связи с систолической дисфункцией миокарда.
- У пациентов с ОКС экскреция с мочой маркеров структурного повреждения почек – альбумина, KIM-1, NGAL, статистически значимо выше, чем у практически здоровых лиц. Среди больных ОКС уровень в моче всех изученных биомаркеров значимо выше в группе пациентов с ОПП, чем среди пациентов с сохранной функцией почек.
- Уровень мочевой экскреции KIM-1≥0,77 нг/л (AUC 0,875) и NGAL≥34,38 нг/л (AUC 0,87) обладают высокой специфичностью и чувствительностью в прогнозировании развития ОПП у больных ОКС. Одномоментное исследование у одного пациента комплекса биомаркеров (KIM-1+NGAL) не имеет значимых диагностических преимуществ.
- Новая диагностическая модель ОПП, включающая оценку показателей функции почек и биомаркеров структурного повреждения почечной ткани, позволяет персонифицировать прогноз поражения почек у больных ОКС.



