Увеличение злокачественных новообразований у больных ТХПН связывают со снижением иммунитета на фоне прогрессирования уремии [1, 3]. Уремия также рассматривается как онкогенный фактор [2]. Детальный анализ развития рака после трансплантации почки позволил выявить следующую закономерность: риск развития рака в 35 раз выше, чем в норме, преимущественно за счет ретикулоклеточной саркомы. Риск возникновения лимфом в 30–40 раз выше, чем в норме, и остается таким в течение последующих пяти лет. Рак кожи и губы возникает в 4 раза чаще, чем в норме, и риск его появления увеличивается с возрастанием трансплантационного интервала [4–6]. I. Penn показал в своем исследовании, что развитие новых опухолей в различных органах составляет 6% случаев у 73 больных с трансплантированной почкой [2]. Кроме того, отмечено возникновение метастазов и рецидив опухоли в собственной почке и трансплантате в 35% случаев у больных с ранее выявленными опухолями собственных почек. Рецидивы онкологических заболеваний после трансплантации почки наблюдались у 181 (22%) из 823 больных с предшествовавшей онкологической патологией [3]. J.E. Sanchez отмечает, что рост почечно-клеточной карциномы в случае ее диагностики после трансплантации почки составляет до 0,5 см в год [7].
 J.E. Belzer [8] полагает, что опухоль у трансплантированных больных под влиянием иммуносупрессии возникает тремя путями:
J.E. Belzer [8] полагает, что опухоль у трансплантированных больных под влиянием иммуносупрессии возникает тремя путями:
- возникновение опухоли в пересаженной почке;
- перенос раковых клеток самой пересаженной почкой;
- возникновение новообразований из метастазов.
Первый случай возникновения de novo опухоли в пересаженной почке был описан в 1988 г. [9]. Возникновение опухоли в трансплантированной почке – довольно редкое явление. Автор описывает двух из 804 (0,24%) больных аденокарциномой трансплантата. Первому больному выполнена нефрэктомия трансплантата, второму – резекция пересаженной почки. Повторного развития опухолевого процесса в трансплантате у больного с резекцией не отмечено [10].
Наиболее эффективен хирургический метод лечения рака как собственных почек, так и трансплантированных [11], объем и технические аспекты которого до настоящего времени остаются предметом дискуссии [12]. К наиболее часто обсуждаемым вопросам относятся преимущества органосохраняющих операций (ОСО), размер и локализация опухоли [13, 14], длительность безопасного времени ишемии почки [15], выживаемость и качество жизни пациентов [16].
«Золотым» стандартом при выявлении опухоли в трансплантированной почке является трансплантатэктомия. Однако в этом случае качество жизни больного ТС ХПН оказывается ограниченным из-за возвращения на лечение гемодиализом. Органосохраняющая операция в таких случаях служит альтернативой спасения трансплантата. При подозрении на наличие опухолевого процесса больному необходимы скрининг УЗИ, КТ, биопсия опухолевого образования. Также необходимо исключить наличие метастазов. Кроме того, при планировании хирургического метода лечения необходима ангиография трансплантированной почки для выяснения кровоснабжения почечной паренхимы. За последние годы проявляется тенденция к органосохраняющим операциям. Лучшим условием для этого считаются небольшие размеры опухоли (до 3 см), децентрализация опухоли в трансплантате и хорошее кровоснабжение остальной, непораженной. части паренхимы трансплантированной почки. H.-U. Gerth доложил о больном, у которого через 13 лет после трансплантации при рутинном УЗИ-обследовании диагностирована опухоль трансплантированной почки и была подтверждена КТ. Выполнена энуклеация опухоли. Функция трансплантата была сохранена. Гистология показала редкую опухоль с низкой градацией без инвазии в псевдокапсулу. Метастазов в кости нет. Такролимус был заменен на эверолимус для уменьшения потенциального риска возникновения опухоли. Автор показал, что для больных с высоким риском малигнизации после трансплантации частый скрининг УЗИ может выявлять ранний рост опухоли и вовремя оказывать хирургическую органосохраняющую операцию с сохранением хорошей функции трансплантата. Кроме того, продемонстрировано, что высокие дозы иммуносупрессии также могут увеличивать риск возникновения опухолей в 80 раз [17]. H. Kuper приводит несколько известных факторов риска для развития почечной карциномы: длительное курение, артериальная гипертензия, работа с асбестом и нефтематериалами, лишний вес, пристрастие к анальгетикам, кисты в почках [18].
L. Viart выявил 0,7% злокачественных опухолей в пересаженной почке у 1037 больных – 6 папиллярных и 2 светлоклеточные карциномы. Всем больным была выполнена органосохраняющая операция. Пятилетняя выживаемость трансплантата составила 100%. Автор отмечает, что больные с поражением трансплантата низкодифференцированными карциномами малого размера (до 3 см) имеют хорошую выживаемость [19].
Несомненно, что органосохраняющая операция больным с опухолью трансплантата наиболее предпочтительна.
Кроме хирургического метода резекция опухолевого поражения трансплантата может быть выполнена при помощи лапароскопической техники. Однако при этом могут появляться проблемы технического выполнения из-за наличия спаечного процесса в области операции. Пожилым больным из-за сопутствующих заболеваний возможно выполнение радиочастотной абляции или чрескожной криодеструкции. Пяти больным выполнена чрескожная радиочастотная абляция. Показанием служили отказ от операции и ожирение больного. Радиочастотная абляция используется в качестве лечения в подобных случаях. В мета-анализе при сравнении чрескожной радиочастотной абляции и щадящей органосохраняющей хирургии не обнаружили различий в результатах. Потенциальные преимущества радиочастотной абляции над хирургией – в минимальной инвазивности, избегающей повреждения прилегающих тканей, сохраняющей окружающую почечную паренхиму и снижение осложнений, в результате чего уменьшается время пребывания больного в стационаре. Криохирургия является еще одним вариантом лечения опухолей в почках, описанным в литературе. Несмотря на хорошие результаты, представленные авторами, этот вид терапии находится в стадии оценки. Эти методы менее травматичны, с меньшей частотой осложнений и небольшим сроком госпитализации [10].

Приводим описание случая возникновения и успешного лечения почечно-клеточной карциномы в пересаженной почке через 23 года после трансплантации.
Больная М. 1959 г.р. 13.10.2014 поступила в отделение с диагнозом «рак донорской почки» . В 1990 г. диагностированы хронический диффузный гломерулонефрит, ХПН–II. С 1992 г. отмечено повышение АД до 180/100 мм рт.ст. Сr крови 1250 ммоль/л. Ur 46,3 ммоль/л. Гиперкалиемии нет. С сентября 1992 г.начато лечение систематическим гемодиализом. Гр. крови АВ(IV) пол. НвSAg пол.
 В ноябре 1992 г. выполнена трансплантация правой донорской почки. Смерть донора наступила от ЧМТ. Время холодовой ишемии – 22 часа. Время тепловой ишемии – 20 минут. Гр. крови донора AB(IV). Фенотип донора: А2, В12,13. Фенотип реципиента А2,11. В12,35. Совпадение по системе HLA по двум лейкоцитарным антигенам. По системе ABO полное. Назначена 3-компонентная имуносупрессия: циклоспорин А 3 мг/кг, азатиоприн 200 мг/сут, преднизолон 35 мг/сут, в/в капельно вводился метилпреднизолон, суммарная доза которого (включая интраоперационное применение) составила 2,25 г. Послеоперационный период осложнился ОКН трансплантата в течение 10 суток, что потребовало проведения 4 сеансов гемодиализа. К 11-м суткам наступило восстановление диуреза до 2500 мл. Отмечено снижение креатинина сыворотки крови до 0,15 ммоль/л и мочевины сыворотки крови 13,7 ммоль/л к 16-му дню после трансплантации почки. Выписана домой в удовлетворительном состоянии через 35 суток после операции. Креатинин сыворотки крови при выписке 0,07–0,08 ммоль/л. Hb – 98 г/л.
В ноябре 1992 г. выполнена трансплантация правой донорской почки. Смерть донора наступила от ЧМТ. Время холодовой ишемии – 22 часа. Время тепловой ишемии – 20 минут. Гр. крови донора AB(IV). Фенотип донора: А2, В12,13. Фенотип реципиента А2,11. В12,35. Совпадение по системе HLA по двум лейкоцитарным антигенам. По системе ABO полное. Назначена 3-компонентная имуносупрессия: циклоспорин А 3 мг/кг, азатиоприн 200 мг/сут, преднизолон 35 мг/сут, в/в капельно вводился метилпреднизолон, суммарная доза которого (включая интраоперационное применение) составила 2,25 г. Послеоперационный период осложнился ОКН трансплантата в течение 10 суток, что потребовало проведения 4 сеансов гемодиализа. К 11-м суткам наступило восстановление диуреза до 2500 мл. Отмечено снижение креатинина сыворотки крови до 0,15 ммоль/л и мочевины сыворотки крови 13,7 ммоль/л к 16-му дню после трансплантации почки. Выписана домой в удовлетворительном состоянии через 35 суток после операции. Креатинин сыворотки крови при выписке 0,07–0,08 ммоль/л. Hb – 98 г/л.
В 2001 г. произведена плановая конверсия азатиоприна на микофенолаты. Концентрация циклоспорина в сыворотке колебалась от 80 до 160 нг/мл, резких колебаний концентрации не было. Функция почки не изменилась.
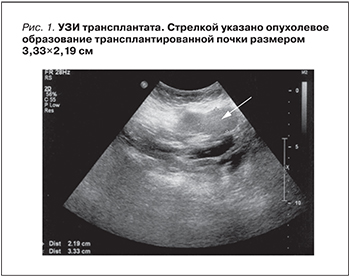
В 2014 г., через 22 года после трансплантации почки, при плановом обследовании при УЗИ выявлено гипоэхогенное округлое образование в нижнем полюсе трансплантата (рис. 1).
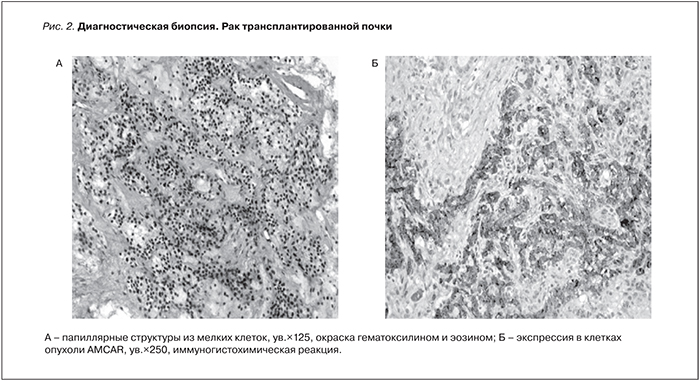
Образование округлой формы с четкими границами размером 3,0 см, замещающее всю толщу паренхимы, распространяется экстраренально, ЧЛС не деформирована. Заподозрена опухоль пересаженной почки. Для идентификации выявленного образования выполнена биопсия. Данные биопсии от 29.09.2014: В биоптате определяются фрагменты опухолевых структур из мелких клеток, формирующие сосочки, солидные скопления крупных клеток с пенистой цитоплазмой. При иммуногистохимическом (ИГХ) исследовании клетки опухоли экспрессируют цитокератины широкого спектра (клон АЕ1/АЕ3), AMCAR, виментин, очагово – CD10 и цитокератин 7. Средний индекс Ki67 не превышает 2%. Заключение: почечноклеточный рак сложного гистологического строения и иммунофенотип клеток опухоли более всего соответствует папиллярному варианту почечноклеточного рака низкой степени злокачественности (рис. 2).
11.09.2014 выполнена КТ брюшной полости. В правой подвздошной области определяется донорская почка. Паренхима почки несколько утолщена. В нижнем полюсе трансплантата визуализируется объемное образование пониженной плотности с четкими, ровными контурами диаметром 31 мм (рис. 3).
После в/в контрастирования отмечается слабое накопление контрастного препарата образованием. Образование занимает всю толщу паренхимы донорской почки, распространяется экстраренально, деформируя латеральный контур почки, и передне-латеральной поверхностью тесно прилежит к внутренней поверхности брюшной стенки. При КТ ангиографии отмечается хорошее кровоснабжение всей паренхимы донорской почки (рис. 4). Больная была госпитализирована для оперативного удаления опухоли трансплантата с диагнозом «хронический гломерулонефрит, ХПН–III, аллотрансплантация трупной почки от 1992 г., хроническая трансплантационная нефропатия, вторичный иммунодефицит, папиллярная карцинома ренального трансплантата».
При поступлении состояние больной удовлетворительное. АД 130/80 мм рт.ст. PS – 82 уд. в 1 минуту. В легких – дыхание везикулярное, живот мягкий, при пальпации безболезненный во всех отделах. Печень и селезенка не увеличены в размерах. В правой подвздошной области пальпируется трансплантат плотноэластической консистенции, безболезненный. Новообразования на коже не определяются, щитовидная железа не увеличена, в молочных железах образования не пальпируются, периферические лимфатические узлы не пальпируются. Мочеиспускание безболезненное, свободное. Мочи за сутки до 1500 мл.
Ан. крови: Hb – 126 г/л, эр. 4.12 ЕД/л, Ht – 0,36, тромбоциты – 491×10 9/л, WBC – 8,50×10 9/л. Биохимия крови: билирубин общий – 8,1 мкмоль/л, холестерин общий 8,8 ммоль/л, общий белок 71 г/л, Ur крови – 6,0 ммоль/л, Cr крови 73 мкмоль/л, глюкоза 4,7 ммоль/л, Ca общий 2,37 ммоль/л, P неорганический 1,06 ммоль/л, АLT – 20 ЕД/л, AST – 30 ЕД/л. Коагулограмма крови: АЧТВ – 21,5 с, протромбиновое время – 10,2 с, протромбиновая активность по Квику (IL) 125%, МНО – 0,88, фибриноген – 4,18 г/л, тромбиновое время 23,2 с.
Поскольку опухолевый узел не более 3 см расположен периферически в нижнем полюсе трансплантата и кровообращение в трансплантате хорошее, функция трансплантата удовлетворительная, планируется выполнение органосохраняющей операции (энуклеации опухолевого узла или резекции нижнего полюса трансплантата).
22.10.2014 выполнена операция: резекция нижнего полюса трансплантированной почки (рис. 5–7).
Особенности операции.
- Поскольку декапсуляция трансплантата сделает проблематичным ушивание паренхимы после резекции, решено произвести выделение нижнего полюса максимально щадяще с оставлением на трансплантате участков париетальной брюшины, не поддающихся отделению острым путем.
- Схематичное выделение почечных сосудов для выключения трансплантата из кровотока после локализации и взятия на турникет мочеточника сопряжено с большим риском повреждения почечных и подвздошных сосудов, мочеточника, т.к. они находятся в едином плотном конгломерате тканей в воротах трансплантированной почки. В связи с этим решено ограничиться выделением участка трансплантата с опухолью, а резекцию выполнять при мануальном обжатии этого сегмента паренхимы без пережатия магистральных сосудов.
С большими техническими сложностями острым путем выделен нижний полюс почечного трансплантата. При этом выявлено, что в нижнем полюсе имеется округлое опухолевидное образование диаметром около 3 см, расположенное частично экстраренально и вплотную подходящее к воротам почки. После мануального обжатия паренхимы, отступив от края опухоли на 0,5 см, произведен циркулярный окаймляющий разрез электроножом. В дальнейшем опухоль вместе с участком паренхимы была выделена и удалена. Кровопотеря составила 450,0 мл. Время мануального обжатия почечного трансплантата составило 15 минут.
В послеоперационном периоде состояние больной не ухудшилось. Проведена антибактериальная терапия – цефтриаксон, ципрофлоксацин. В послеоперационном периоде отмечена лимфорея до 150,0 мл, по поводу чего проведена склерозирующая терапия – введение контрастного вещества в полость через дренаж. Лимфорея прекратилась через 20 суток после операции. Выписана в удовлетворительном состоянии. Cr крови – 75 ммоль/л, Ur крови – 6,3 ммоль/л, Hb – 141 г/л, L – 7,3×10,9. Мочи за сутки до 1600,0 мл.
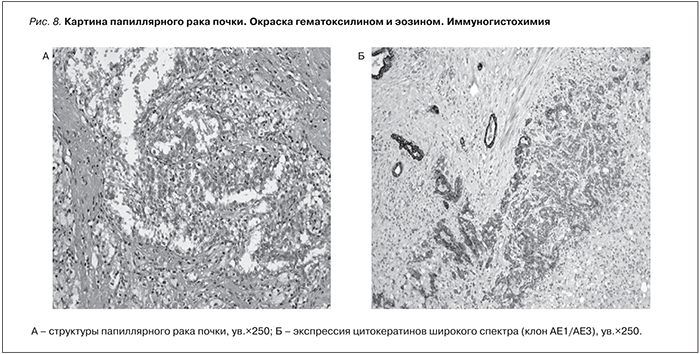
Гистология от 22.11.2014 № 47297/07. В резецированной ткани трансплантированной почки обширный очаг некроза, по периферии которого обнаружены обширные очаги продуктивного воспаления с обилием ксантомных клеток, часть которых многоядерные. Под утолщенной фиброзированной капсулой обнаружены небольшие очаги почечноклеточной карциномы папиллярного варианта I типа, инвазии псевдокапсулы опухоли не обнаружено (рис. 8). Резекция опухоли произведена в пределах здоровых тканей, практически по псевдокапсуле некротизированного опухолевого узла. Картина папиллярного рака почки. Данные ИГХ (иммуногистохимии): клетки опухоли экспрессируют цитокератины широкого спектра (клон АЕ1/АЕ3) (рис. 8Б), виментин, АМСАR, РАХ8, слабо – ЭМА. Ксантомные клетки экспрессируют CD68, клетки обильного лимфоидного инфильтрата – общий лейкоцитарный антиген (CD45).
С помощью CD68 и CD45 в окружающей ткани выявляется большое количество ксантомных клеток и клеток моноцитарно-макрофагального ряда и обильный лимфоидный инфильтрат. Заключение: картина и иммунофенотип папиллярного рака почки.
Поставлен окончательный диагноз: папилярноклеточный рак нижнего полюса трансплантированной почки низкой степени злокачественности, TI, N0, M0. Фурман I, Cтадия I.
В настоящее время доза цикоспорина А 125 мг/сут, майфортик 1,44 г/сут, преднизолон 10 мг/сут, проведена также антибактериальрная терапия (цефтриаксон, цефоперазон-сульбактам). Послеоперационная рана заживала первичным натяжением, однако отмечена выраженная лимфоррея до 250 мл в сутки. Проведена склерозирующая терапия – введение контрастного вещества в дренаж. Пациентка была выписана из урологического стационара 13.11.2014 в удовлетворительном состоянии с дренажем.
Диурез 2000 мл, рост 160 см, вес 63 кг, мочевина 5,3 ммоль/л; креатинин 0,04 ммоль/л, креатинин мочи 3,6 ммоль/л, суточная протеинурия 0,3 г, СКФ 130 мл/мин. Концентрация циклоспорина А в крови – 138 нг/мл. В дальнейшем объем отделяемой лимфы из раны прогрессивно уменьшался и дренаж был удален. С 03.01.2015 рекомендуется отмена майфортика, начать прием сертикана по 0,5 мг 2 раза в день, уменьшить дозу циклоспорина А до 125 мг/сут (75 мг+50 мг).
С 10 января 2015 г. была начата конверсия на препарат группы ингибиторов пролиферативного сигнала: назначен эверолимус, отменен микофенолат натрия, снижена доза циклоспорина А. Назначен также аторвастатин для коррекции гиперлипидемии. Функция трансплантата остается удовлетворительной (креатинин сыворотки – 0,08–0,1 ммоль/л), протеинурия минимальна. В дальнейшем с целью вторичной профилактики онкологических осложнений пациентке планируется полная отмена циклоспорина и продолжение иммуносупрессии двумя препаратами – эверолимусом и преднизолоном.
Обсуждение. С 1986 по 2014 г. в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского было выполнено 1765 трансплантаций почки. Возникновение опухоли ренального трансплантата у нашей больной – это первый случай среди пациентов, оперированных и наблюдавшихся в нашем центре. Размеры опухоли, как и ее гистологические особенности (папиллярный рак), соответствуют типичным характеристикам почечно-клеточного рака РТ, описанным в литературе [19].
Распространенность опухолевого поражения трансплантата часто недооценивается. Из 4,6% всех опухолей после трансплантации 10% приходится на рак трансплантата. Многолетние наблюдения показывают, что чаще других типов рака почки в почечном трансплантате возникает именно папиллярный рак. В ретроспективном многоцентровом исследовании во Франции возникновение аденокарциномы трансплантата зафиксировано в 0,19% (41 806 больных – 79 карцином). Средний размер опухоли – 28,7 мм. Время возникновения опухолей в трансплантате составило 131,7 месяца. Время между датой трансплантации и развития рака почки у трансплантированных больных является чрезвычайно переменным – в пределах от 9 до 228 месяцев. Примерно у 80% больных рост опухоли ограничен пределами почек, что определяет их прогноз. Тридцати пяти больным выполнена резекция трансплантата (35,4%), у 5 (6,3%) – радиочастотная абляция. Выживаемость трансплантата при этих методах лечения составила 94%. Причем большинство опухолей было выявлено случайно. После резекции функция почек зависит от качества остающейся паренхимы. Противники резекции трансплантата считают, что данная операция связана с рисками рецидива (местного и системного), особенно при папиллярных карциномах. Отмечается, что у 11,4% больных при наличии опухоли в трансплантате были отмечены следующие симптомы: боли в трансплантированной почке, макрогематурия, потеря веса больного и гипертермия. Показания к трансплантатэктомии были следующие: плохо функционирующий трансплантат, центральное расположение опухоли, размер опухоли более 4 см, неудовлетворительное кровоснабжение не пораженной части паренхимы почки, папиллярный подтип опухоли [20].
На основании данных литературы и собственных исследований, согласно которым при малейшей возможности необходимо выполнять резекцию трансплантата, что исключает перевод больного на гемодиализ и тем самым улучшает качество жизни. При 5-летнем наблюдении рецидива опухолевого поражения оперированной пересаженной почки у больных после органосохраняющей операции не было. Резекция трансплантата позволяет сохранять функцию трансплантата. Риск подобной операции для больного не высок [21]. В настоящее время при резекции или энуклеации применяется преимущественно пережатие только почечной артерии, т.к. одновременное пережатие артерии и вены чаще вызывает повреждения почечной паренхимы [22]. В некоторых случаях почечно-клеточная опухоль окружена псевдокапсулой из фиброзной ткани.
В этом случае возможно выполнить простую энуклеацию, которая подразумевает удаление опухоли без окклюзии сосудов, простым пальцевым сжатием ткани почки и с максимальным сохранением нормальной, почечной паренхимы. Однако отношение к энуклеации опухоли неоднозначное. Главный недостаток – сомнительная радикальность из-за возможного прорастания псевдокапсулы опухолью и прорастание за ее пределы [23]. Не всегда можно быть уверенным в полном удалении опухолевой ткани. Локальное рецидивирование в пораженной почке считается грозным осложнением. В связи с этим вместе с опухолью по возможности следует удалять слой окружающей опухоли почечной паренхимы. Это уменьшает риск рецидива, а техническая сложность при этом не повышается. Отдаленные результаты энуклеации уступают результатам резекции. По данным W. Morgan, 5-летняя выживаемость больных после резекции почки и энуклеации составила 91,6 и 88,6% соответственно. Несмотря на это, энуклеация опухоли оправданна в тех случаях, когда резекция почки технически трудна или невозможна и чревата значительным ухудшением функции почки [24]. В настоящее время энуклеация в основном применяется при множественных и двусторонних опухолях (болезнь Гиппеля–Линдау), а также у больных с резко сниженной почечной функцией, когда максимальное сохранение почечной паренхимы играет большое значение [25].
Была выполнена резекция трансплантата при опухолевом поражении пересаженной почки 51 больному. Выживаемость трансплантата при этом составила 88%, рецидив опухолевого поражения – 7%. У 75% больных не было симптомов поражения трансплантата. Средний размер опухоли составил 2,8 см. Автор считает, что энуклеация опухоли – наиболее предпочтительная операция. Все больные получали циклоспорин А. Шесть больных были подвергнуты радиочастотной абляции, 2 – чрескожной криоабляции. Выживаемость этих больных составила 100%. Автор отмечает, что у больных после трансплантации почки наиболее предпочтительно выполнять органосохраняющие, малоинвазивные операции. При диагностике опухолевого поражения трансплантата необходима конверсия с циклоспорина А на m-TORингибиторы [26].
Возникновение у нашей больной злокачественной опухоли через 22 года после трансплантации, вероятнее всего, связано с длительной иммуносупрессией, т.к. пациентка после трансплантации вела здоровый образ жизни, не злоупотребляла нефротоксичными препаратами, не страдала ожирением, не курила. Развитие опухолевого процесса в трансплантате было относительно «благоприятное». За последние 3–4 года никаких патологических симптомов, таких как повышение температуры тела, боль, гематурия, снижение веса, потеря аппетита, не отмечалось. Сама опухоль была выявлена случайно – при профилактическом осмотре. Размер образования до 30 мм. По данным КТ, опухоль располагается в нижнем полюсе трансплантата, не затрагивая сосудистую ножку пересаженной почки, метастазов нет. По данным ангиографии, кровоснабжение не пораженной части трансплантата отличное. Был поставлен диагноз: рак трансплантированной почки, ТI, N0, M0. Фурман I. Стадия I. В связи с этим больной показано выполнение органосохраняющей операции (резекции нижнего полюса трансплантата или энуклеации опухолевого узла).
Кроме того, особенность расположения опухоли у данной больной состояла в том, что при резекции нижнего полюса существует опасность нарушения кровоснабжения пиелоуретерального сегмента мочеточника с развитием некроза мочеточника трансплантата, образованием мочевого затека. Во время операции обнаружено, что опухоль находится в фиброзной капсуле, визуализируется граница с почечной тканью. Однако в связи с опасностью оставления опухолевых клеток в паренхиме почки выполнена резекция нижнего полюса трансплантата. Хотя данные биопсии подтвердили, что опухоль была ограничена фиброзной капсулой, все же была выполнена данная операция, т.к. риск рецидивирования опухоли в трансплантате высок. Для уменьшения кровоточивости было выполнено пальцевое обжатие нижнего полюса трансплантата, поскольку пережатие почечной ножки могло бы привести к развитию осложнений, уменьшению массы почечной паренхимы и ухудшению работы трансплантата.
В послеоперационном периоде у больной возникла лимфорея, которая постепенно ликвидировалась посредством склерозирующей терапией.
В дальнейшем для данной категории реципиентов могут быть произведены изменения иммуносупрессивной терапии, поскольку применение ингибиторов m-TOR позволяет снижать частоту возникновения злокачественных образований, в связи с чем могут быть снижены дозы иммуносупрессивных препаратов [27]. Отмена циклоспорина А или существенное снижение его дозы в сочетании с назначением ингибиторов m-TOR позволяет большинству реципиентов ренального трансплантата, имеющих в анамнезе опухолевое поражение почек, добиваться нераспространения опухолевого процесса. Положительную роль играет как отмена циклоспорина А, так и собственное противоопухолевое действие ингибиторов m-TOR, которым обладают сиролимус и его производное – эверолимус. Уже доказан существенный положительный эффект применения этих препаратов при посттрансплантационной саркоме Капоши: конверсия на ингибиторы m-TOR приводит к полному регрессу опухоли [28].
Безусловно, у всех больных после трансплантации почки должна быть онкологическая настороженность [29]. При подозрении на опухолевое поражение трансплантата необходимо выполнение УЗИ и КТ как пересаженной, так и собственных почек.



