Хроническая болезнь почек (ХБП) – актуальная проблема современного здравоохранения. Число больных ХБП составляет около 10% от общего населения при ежегодном росте заболеваемости терминальными стадиями около 4% [9, 12]. Было подсчитано, что около 830 тыс. смертей в год связаны с заболеванием почек, но масштаб проблемы, вероятно, в значительной степени недооценивается. В России в настоящее время насчитывается более 14 млн человек, которые входят в группу риска развития ХБП [3, 7].
Ведущее место в структуре причин развития терминальной почечной недостаточности занимает эссенциальная артериальная гипертензия (АГ) [1, 4, 5]. В настоящее время единые критерии для диагностики гипертензивной нефропатии не разработаны. Наличие почечной дисфункции у больных АГ без проведения биопсии почек позволяет только предполагать данный диагноз. При этом даже биопсия почек не позволяет до конца подтвердить диагноз, т.к. отсутствуют четкие морфологические данные, характеризующие гипертензивную нефропатию [6, 10]. Диагноз гипертензивной нефропатии устанавливают при снижении скорости клубочковой фильтрации (СКФ) менее 60 мл/мин и/или появлении протеинурии на протяжении 3 месяцев при исключении других причин почечной дисфункции [2, 13]. Однако данные критерии свидетельствуют о далеко зашедшей стадии поражения почек, иногда носящего уже необратимый характер. Поэтому продолжается поиск новых, ранних маркеров, характеризующих доклиническое поражение почек при АГ. На сегодняшний день перспективно изучение внутрипочечного кровотока, однако четкие критерии, характеризующие доклиническое поражение почек при АГ, по данным допплерографического исследования сосудов почек, не разработаны.
Целью настоящего исследования стало разработать критерии доклинической диагностики гипертензивной нефропатии с учетом изучения внутрипочечной гемодинамики.
Материал и методы исследования
В исследовании были обследованы 148 больных эссенциальной АГ II стадии без клинически выраженной нефропатии. Средний возраст больных составил (41,4±3,2) года. В группе обследованных было 85 мужчин, что составляет 57,4% от общего числа больных и 63 женщин – 42,6%. Все обследованные не принимали постоянной антигипертензивной терапии в течение предшествовавших 6 месяцев или более.
Критерии исключения: клапанные пороки сердца, сложные нарушения ритма, хроническая сердечная недостаточность III–IV функциональных классов по NYHA (1984), сахарный диабет, наличие в анамнезе ишемической болезни сердца, инфаркта миокарда или острого нарушения мозгового кровообращения. Во всех случаях исключалась симптоматическая артериальная гипертензия.

Контрольную группу (50 человек) составили практически здоровые лица в возрасте 39,8±4,2 года.
Программа обследования включила стандартные и дополнительные методы диагностики больных АГ, предусмотренные рекомендациями Европейского общества гипертонии (2013).
Дополнительно всем пациентам, включенным в исследование, проведено суточное мониторирование АД (СМАД) с использованием аппарата CardioTens фирмы Meditech: в дневное время – каждые 15, ночью – каждые 30 минут. Расчитывали показатели среднесуточного, среднедневного, средненочного систолического АД (САД) и диастолического АД (ДАД), а также степень ночного снижения САД и ДАД.
Для изучения функционального состояния почек проведено определение альбуминурии в суточной моче методом ИФА и определение расчетной СКФ по формуле СКD EPI.
Допплерографическое исследование внутрипочечных сосудов проведено на аппарате Philips HD-7. Внутрипочечный кровоток изучен на уровне магистральной почечной артерии, сегментарной, междолевой и дуговой артериях с обеих сторон. При этом исследовалась максимальная систолическая (Vmax), минимальная диастолическая (Vmin) скорости кровотока и индекс резистентности (IR).
Статистические расчеты проведены с использованием пакетов прикладных программ Statistica 10, Microsoft Excel. При анализе применялись методы описательной статистики (для количественных переменных вычислялись такие показатели, как n – количество значений в анализируемой совокупности данных; при нормальном распределении вычисляли среднее арифметическое [M], стандартное отклонение [σ], при описании признаков, не подчиняющихся закону нормального распределения, использовали медиану [Me] 25-й, 75-й перцентилей, а для категориальных – частоту и долю в процентах). Критерий Манна–Уитни (критерий U) и критерий Фишера (критерий F) применен для оценки различий между двумя выборками по уровню изучаемого признака, критерий Крускала–Уоллиса (критерий H) применен для оценки различий между тремя и более выборками. При выполнении сравнений уровень значимости (р) был принят равным 0,05.
Результаты и их обсуждение
По данным СМАД среднее дневное САД в группе больных АГ, включенных в исследование, составило 158 (150; 166) мм рт.ст., среднее дневное ДАД равнялось 92 (88; 96) мм рт.ст. При изучении циркадного ритма «dipper» пациенты составили 68,2%, «non-dipper» – 25,6%, «night-peaker» – 2%, «over-dipper» – 4%.
При исследовании почечной гемодинамики было выявлено, что у пациентов с эссенциальной АГ II стадии, включенных в исследование, наблюдалось обеднение внутрипочечного кровотока, характеризующееся снижением Vmax и Vmin кровотока (табл. 1). Одновременно отмечено повышение индексов резистентности, характеризующих почечное сосудистое сопротивление. Так, Vmax сегментарной почечной артерии в контрольной группе составила 56 (52; 58) см/с, у пациентов с АГ равнялась 45 (42; 47) см/с, р=0,038; Vmin в сегментарных артериях в контрольной группе равнялась 25 (22; 27) см/с, у больных АГ – 17 (14; 19) см/с, р=0,041. При этом IR сегментарной артерии в контрольной группе составил 0,56 (0,52; 0,58), у пациентов с АГ – 0,62 (0,60; 0,66), р=0,035.
Уровень расчетной СКФ у пациентов с эссенциальной АГ был сопоставимым с группой контроля. Средний уровень СКФ у пациентов с АГ составил 108 (104; 112) мл/мин, в группе контроля – 112 (110; 114) мл/мин, р=0,4.
При этом у пациентов с эссенциальной АГ нормальная СКФ (90–129 мл/мин) была выявлена у 54% (80 человек), повышенная СКФ (>130 мл/мин) – у 22% (32 человека), незначительно сниженная СКФ (60–89 мл/мин) – у 16% (24 человека), умеренно сниженная (45–59 мл/мин) – у 8% (12 человек).
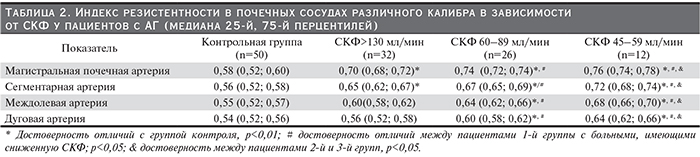
У пациентов с эссенциальной АГ, имевших СКФ>130 мл/мин (стадия гиперфильтрации), отмечено повышение индексов резистентности на уровне магистральной почечной артерии и в крупных внутрипочечных сосудах (на уровне сегментарной артерии). Так, у пациентов с АГ на стадии гиперфильтрации (табл. 2) отмечено достоверное повышение IR на уровне ствола почечной артерии (р=0,023) и на уровне сегментарной артерии (р=0,036) со снижением в мелких артериях (междолевой, дуговой артерии) практически до уровня показателей здоровых людей. Следовательно, на стадии гиперфильтрации кровоток в мелких артериях (уровень микроциркуляторного русла) не страдает.
При СКФ (60–89 мл/мин) отмечено достоверное повышение IR на всех уровнях сосудистого русла почек. При этом наиболее высокое почечное сосудистое сопротивление отмечено у больных с умеренно сниженной СКФ (45–59 мл/мин) (табл. 2).
Соответственно, начальная стадия гипертензивной нефропатии (на стадии гиперфильтрации) характеризуется повышением индексов сосудистого сопротивления на уровне ствола почечной артерии и в крупных внутрипочечных сосудах без изменения в мелких артериях. Данная стадия является отражением физиологической миогенной компенсаторной реакции почечных сосудов, направленной на ликвидацию внутриклубочковой гипертензии и предотвращение повреждения почек при АГ. При снижении СКФ отмечается повышение индексов сосудистого сопротивления на всем уровне сосудистого русла почек, что сопровождается нарушением микроциркуляции, усилением ишемии клубочков почек и в дальнейшем приводит к прогрессированию нефросклероза.
При исследовании суточной экскреции альбуминов с мочой было выявлено, что в группе контроля альбуминурия составила 6 (4; 8), у пациентов с АГ – 22 (8; 46) мг/сут (р=0,03). Высокий уровень альбуминурии (А3) в контрольной группе выявлен у 6,6% (2 человека), у больных АГ – у 36,4% (54 человека); р=0,012. Очень высокий уровень альбуминурии (А4) в группе практически здоровых лиц не определен, среди больных АГ выявлен у 4,7% (7 человек).

Нами были проанализированы показатели почечной гемодинамики (табл. 3) в зависимости от исходного уровня альбуминурии.
При исследовании почечной гемодинамики у больных АГ с высоким уровнем альбуминурии отмечено достоверное снижение минимальной диастолической скорости (р=0,026) по сравнению с пациентами с АГ, имеющими уровень альбуминурии менее 30 мг/сут, в то же время максимальная систолическая скорость достоверно не отличалась в обеих группах с АГ (р=0,67). Одновременно с этим у пациентов с АГ, имеющих высокий уровень альбуминурии, имело место значительное повышение IR, что свидетельствует об увеличении внутрипочечного сосудистого сопротивления.
Для ранней диагностики нарушений внутрипочечной гемодинамики и определения почечного прогноза нами также была выполнена острая фармакологическая проба с каптоприлом. У здоровых добровольцев и пациентов с эссенциальной АГ была проведена оценка почечного сосудистого сопротивления до и через 40 минут после сублингвального применения 25 мг каптоприла. Сравнение полученных значений индексов почечного сосудистого сопротивления до и после пробы с каптоприлом позволяет оценивать состояние внутрипочечной гемодинамики и почечный резерв. Было выявлено, что в группе практически здоровых лиц после сублингвального приема каптоприла отмечено достоверное снижение почечного сосудистого сопротивления, проявляющееся уменьшением IR на уровне сегментарных почечных артерий в среднем на 7% от исходного уровня; р<0,05 (табл. 4).
Также было изучено состояние почечной гемодинамики у больных с различным стажем АГ. Было выявлено, что у пациентов с непродолжительным гипертензивным анамнезом (длительность АГ не более 5 лет) после сублингвального приема каптоприла также отмечено достоверное снижение IR сегментарной почечной артерии в среднем на 5% от исходного уровня. У больных с длительным стажем АГ (длительность более 10 лет) прием каптоприла не приводил к уменьшению почечного сопротивления.
Таким образом, отсутствие достоверного снижения почечного сосудистого сопротивления после проведения острой фармакологической пробы с каптоприлом, вероятно, уже свидетельствует о развитии ремоделирования внутрипочечных сосудов.

Обсуждение результатов исследования
Эссенциальная АГ служит одной из основных причин развития нефропатии. В свою очередь гипертензивная нефропатия существенно усугубляет течение АГ и ухудшает возможности контроля АД. Для улучшения прогноза у больных АГ наряду с оптимизацией антигипертензивного контроля необходимы ранняя диагностика сосудистых и почечных поражений, а также выделение больных с высоким риском развития нефропатии [7, 10]. Ранняя стадия поражения почек при АГ остается недостаточно изученной: окончательно не определены критерии ранней стадии гипертензивной нефропатии, не оценена информативность методов ее диагностики и мониторирования [13, 15]. На сегодняшний день перспективным для ранней диагностики нефропатии остается изучение внутрипочечного кровотока по данным допплерографического исследования с оценкой скоростных и резистивных показателей сосудов почек. При изменении кровотока в почечных сосудах происходит изменение сопротивления в зависимости от сущности патологического процесса. Так, повышение величины индексов может наблюдаться при стеноокклюзивных процессах и вазоспастических реакциях, снижение их указывает на артериовенозное шунтирование или периферическую вазодилатацию. В настоящее время выявлены корреляции между индексами почечного сосудистого сопротивления и наличием клубочкового склероза, интерстициальным фиброзом [8, 11, 14]. Однако единого мнения по поводу допплерографической диагностики поражений почечной паренхимы все еще не существует.
Полученные в нашем исследовании данные позволяют рекомендовать более широкое использование ультразвукового исследования с цветовым картированием кровотока в комплексе клинического обследования больных АГ для ранней диагностики поражения почек. Повышение индексов почечного сосудистого сопротивления ассоциируется с прогрессированием гипертензивного нефроангиосклероза. При проведении допплерографического исследования рекомендовано использование фармакологической пробы с каптоприлом. Отсутствие достоверного снижения почечного сосудистого сопротивления после проведения пробы, вероятно, свидетельствует о развитии ремоделирования внутрипочечных сосудов.
Выводы
- У пациентов с эссенциальной артериальной гипертензией II стадии отмечается обеднение внутрипочечного кровотока, характеризующееся снижением максимальной систолической и минимальной диастолической скорости кровотока. В то же время отмечается повышение индексов резистентности, характеризующих почечное сосудистое сопротивление.
- Ранним критерием гипертензивной нефропатии (на стадии гиперфильтрации) является повышение индексов резистентности на уровне магистральных и сегментарных артерий по данным допплерографического исследования сосудов почек.
- При проведении допплерографического исследования почечных сосудов рекомендовано использование фармакологической пробы с каптоприлом. Отсутствие достоверного снижения индексов резистентности после сублингвального приема каптоприла, вероятно, свидетельствует о развитии ремоделирования внутрипочечных сосудов.



