Между хронической болезнью почек (ХБП) и гиперпаратиреозом (ГПТ) существует тесная связь. ГПТ – это патология околощитовидных желез (ОЩЖ), характеризующаяся избыточной секрецией паратиреоидного гормона (ПТГ). Различают первичный и вторичный ГПТ.
Первичный ГПТ (солитарная паратирома, множественные паратиромы, гиперплазия одной или нескольких желез и реже – аденокарцинома ОЩЖ) имеет гендерную направленность: женщины старшей возрастной группы и частота в общей популяции 1–2%. Почки являются одним из основных органов-мишеней при первичном ГПТ. На уровне почек ПТГ стимулирует реабсорбцию кальция в дистальных канальцах, оказывает фосфатурический эффект и увеличивает продукцию кальцитриола [1]. Усвоение диетарного кальция в кишечнике, стимулированное кальцитриолом, и усиленная мобилизация кальция из костей под влиянием ПТГ обусловливают гиперкальциемию, приводящую к повышенному содержанию кальция в моче, несмотря на увеличение его реабсорбции.
 Патология почек при первичном ГПТ встречается более чем в 60% наблюдений и обусловлена гиперкальциемией, гиперкальциурией и, по-видимому, непосредственно повышенным уровнем ПТГ. Варианты почечного поражения представлены мочекаменной болезнью, нефрокальцинозом, хроническим тубулоинтерстициальным нефритом, а также таким феноменом, как полиурия и полидипсия [2]. Полиурия чаще встречается при тяжелом течении первичного ГПТ, приводит к дегидратации организма, чрезмерной потере многих электролитов и опасна развитием острого почечного повреждения.
Патология почек при первичном ГПТ встречается более чем в 60% наблюдений и обусловлена гиперкальциемией, гиперкальциурией и, по-видимому, непосредственно повышенным уровнем ПТГ. Варианты почечного поражения представлены мочекаменной болезнью, нефрокальцинозом, хроническим тубулоинтерстициальным нефритом, а также таким феноменом, как полиурия и полидипсия [2]. Полиурия чаще встречается при тяжелом течении первичного ГПТ, приводит к дегидратации организма, чрезмерной потере многих электролитов и опасна развитием острого почечного повреждения.
Генез полиурии сложен. Нарушение процесса концентрирования мочи может быть связано с формированием тубулоинтерстициального склероза/фиброза, что нашло подтверждение при гистологическом исследовании прижизненных почечных биоптатов у пациентов с тяжелой формой первичного ГПТ [3]. Доказанным является и факт участия в реализации полиурии кальций-чувствительных рецепторов, экспрессируемых во многих участках нефрона, в первую очередь в дистальном отделе петли Генле [4, 5]. Активация этих рецепторов в условиях патологической гиперкальциемии и нарастания кальция в первичной моче приводит к увеличению объема внутриканальцевой жидкости. Экспериментальные исследования продемонстрировали дозозависимый от ПТГ эффект повышения экспрессии гена кальций-чувствительных рецепторов и снижение экспрессии генов многих переносчиков натрия во всех отделах канальцевой системы, причем при гиперкальциемии, индуцированной передозировкой витамина D, подобные эффекты не регистрировались [6]. Установлено также, что гиперкальциемия способствует резистентности почек к действию вазопрессина, т.е. развитию нефрогенной формы несахарного диабета.
На сегодняшний день описаны отдельные случаи первичного ГПТ, приведшего к развитию ХБП, в т.ч. и собственное наблюдение [7–15].
Вторичный ГПТ (диффузная и/или диффузно-узловая гиперплазия ОЩЖ) – распространенное осложнение ХБП, встречается в среднем у трети–половины пациентов с ХБП 5-й ст., из них у 6–21% имеет тяжелое течение. Развитие вторичного ГПТ обусловлено сопутствующими ХБП гормонально-метаболическими нарушениями: гиперпродукцией фактора роста фибробластов-23, задержкой в организме фосфора, гипокальциемией, дефицитом активной формы витамина D и аномальным кальциемическим ответом кости на действие ПТГ [16].
В отдельных случаях достаточно сложно определить причинно-следственные связи между ГПТ и почечной патологией.
С этим зачастую связана поздняя диагностика первичного ГПТ – иногда уже на стадии почечной недостаточности.
В описанном нами клиническом наблюдении поэтапный анализ истории заболевания пациентки позволял обсудить первичный ГПТ, приведший к ХБП, в более ранние сроки, однако диагноз был поставлен в интраоперационном и подтвержден в постоперационном периодах уже на этапе диализной терапии [7]. Еще сложнее дифференцировать первичный и вторичный ГПТ на этапе почечной недостаточности.
В качестве дифференциально-диагностических критериев первичного и вторичного ГПТ предлагаются:
- гиперкальциемия, хотя нередко встречается нормо- и даже гипокальциемия вследствие дефицитной секреции витамина D;
- высокий уровень ПТГ в крови при небольшой длительности почечного заболевания [17].
По-видимому, реальны и другие клинические ситуации – существование двух независимых (конкурирующих) заболеваний: первичного ГПТ и не связанной с ним ХБП, а также сочетание первичного и вторичного ГПТ.
 Приводим собственное клиническое наблюдение за пациенткой, которой в юности диагностирован хронический гломерулонефрит, спустя многие годы уже при снижении функции почек оперированной по поводу первичного ГПТ, имеющей вторичный ГПТ на этапе диализной терапии и нормальную функцию ОЩЖ после успешной трансплантации почки.
Приводим собственное клиническое наблюдение за пациенткой, которой в юности диагностирован хронический гломерулонефрит, спустя многие годы уже при снижении функции почек оперированной по поводу первичного ГПТ, имеющей вторичный ГПТ на этапе диализной терапии и нормальную функцию ОЩЖ после успешной трансплантации почки.
П а ц и е н т к а А. 18.05.1962 г.р. Со слов пациентки, в возрасте 18 лет перенесла эпизод макрогематурии, после чего диагностирован хронический гломерулонефрит (биопсия почек не выполнялась); в последующем наблюдалась терапевтом и нефрологом. Имела две беременности, протекавшие без осложнений, роды срочные, самостоятельные, без осложнений. С конца 1990-х гг. присоединилась артериальная гипертензия, через несколько лет – увеличение креатинина до 120 мкмоль/л. Объективная информация (некоторые результаты обследования) представлена с 2006 г. (табл. 1).
В середине 1990-х гг. при УЗИ переднего отдела шеи выявлен «узел» правой доли щитовидной железы (ЩЖ). Исследование гормонов – ТТГ, Т4 (свободный) – в пределах референсных значений, исследование функционального состояния ОЩЖ не проводилось. При повторных УЗИ ЩЖ существенной динамики размеров выявленного опухолевидного образования не отмечено.
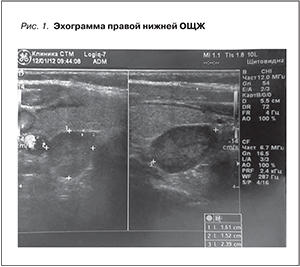
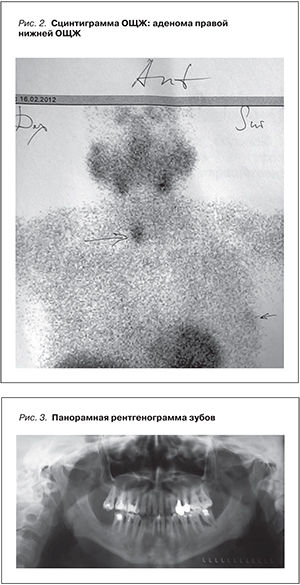
С 2011 г. отметила нарастающей интенсивности болевой синдром в костях. При биохимическом исследовании крови (08.12.2011): кальций (общий корригированный на сывороточный альбумин) 2,5 ммоль/л, кальций ионизированный 1,29 ммоль/л, фосфор 1,37 ммоль/л, ПТГ 1676 пг/мл, щелочная фосфатаза 192 ЕД/л (норма – 31–115), креатинин 363 мкмоль/л, мочевина 20,1 ммоль/л, АлАТ 17 ЕД/л, АсАТ 18 ЕД/л, суточная экскреция кальция с мочой 96 мг. При УЗИ переднего отдела шеи (12.01.2012): ЩЖ без особенностей. ОЩЖ слева не визуализируются, справа в проекции нижнего полюса ЩЖ по заднему контуру определяется гипоэхогенное образование с ровными четкими контурами и умеренной васкуляризацией (низкоскоростной кровоток) размером 1,6×1,5×2,4 см с незначительным дистальным усилением акустического сигнала (рис. 1). Радиоизотопное исследование ОЩЖ с 99мТс-технетрилом (16.02.2012): сцинтиграфическая картина свидетельствует о наличии аденомы правой нижней ОЩЖ (рис. 2).
Рентгенография правого тазобедренного сустава: сужение суставной щели, кистовидные просветления в вертлужной впадине, костные разрастания по верхнему краю вертлужной впадины. Панорамная рентгенография зубов: генерализованный периодонтит с резорбцией межальвеолярных перегородок; зона разряжения костной структуры в периапикальной области 41 и 42 зубов с нечеткими неровными контурами; множественный кариес; частичная адентия (рис. 3). Двухэнергетическая абсорбциометрия скелета: минеральная плотность костной ткани в дистальном отделе костей предплечья, шейке бедренной кости, поясничном отделе позвоночника в пределах возрастной нормы. Диагностированы первичный ГПТ, костная форма.
16.04.2012 в отделении хирургической эндокринологии ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» выполнена операция удаления опухоли правой нижней ОЩЖ, биопсия правой верхней ОЩЖ. При интраоперационной ревизии ЩЖ несколько увеличена за счет всех отделов, мягко-эластической консистенции, узловые образования в ее паренхиме не пальпируются. В местах типичного расположения ОЩЖ обнаружены правые (нижняя 20×15×15 мм и верхняя 6×4×3 мм), левые достоверно не визуализировались. Удалена опухоль правой нижней ОЩЖ. Произведена биопсия (не менее 50% объема паренхимы) правой верхней ОЩЖ.

Заключение патологоанатомического исследования. Операционный материал представлен: 1. Инкапсулированным узлом желтого цвета массой 4 г размером 2,8×2,1×1,1 см; на разрезе мелкие кисты менее 0,1 см в диаметре; 2. Кусочком серовато-желтого цвета диаметром 0,5 см. Результат гистологического исследования. Правая нижняя ОЩЖ: аденома из главных и онкоцитарных клеток солидного строения с фолликулярноподобными структурами и кистообразованием; на ограниченном протяжении определяется капсула и ободок ткани нормальной ОЩЖ. Правая верхняя ОЩЖ: количество стромального жира менее 10%, умеренная гиперплазия главных клеток.
Послеоперационный период без осложнений. Клинические проявления и лабораторное подтверждение гипокальциемии на вторые сутки (табл. 2). Получала лечение препаратами кальция и витамина D.
Ухудшение состояния с ноября 2012 г. – нарастающая слабость, головокружение, одышка при ходьбе, повышение АД до 185/110 мм рт.ст., плохо поддающееся медикаментозной коррекции, снижение диуреза до 800–1000 мл/сут. 04.12.2012 госпитализирована в отделение трансплантологии и диализа ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». При обследовании: креатинин крови 630 мкмоль/л (расчетная СКФ по формуле CKD-EPI менее 10 мл/мин), мочевина 35,8 ммоль/л, Нв 74 г/л, общий белок 69 г/л, альбумин 33 г/л, ЩФ 76 ЕД/л, ПТГ 623 пг/мл. УЗИ почек: правая 73×48 мм, левая 113×62 мм; паренхима слабо определяется, дифференциация на слои отсутствует; конкрементов нет. Рентгенография кистей: умеренный околосуставной остеопороз; субпериостальная резорбция медиальных поверхностей средних фаланг 2–3-го пальцев обеих кистей.
07.12.2012 выполнена лапароскопическая имплантация перитонеального катетера, через 10 дней введена в программу перитонеального диализа. Программа амбулаторного перитонеального диализа на протяжении 2,5 лет адекватна, пациентка удовлетворительно реабилитирована, продолжала трудовую деятельность (табл. 3).
04.05.2015 выполнена трансплантация трупной почки. Индукционная иммуносупрессивная терапия включала введение базиликсимаба в суммарной дозе 40 мг и метилпреднизолона в суммарной дозе 1,5 г, базисная – ингибитор кальцинейрина (програф в стартовой дозе 0,15–0,20 мг/кг/сут и далее под контролем плазменной концентрации препарата – С0 8–10 нг/мл), препарат группы микофенолатов (майфортик 0,72 г/сут), преднизолон (30 мг/сут с последующим снижением дозы до поддерживающей – 5–10 мг/сут). Функция трансплантата немедленная, нормализация уровня азотемии на 5-й день (креатинин плазмы –80 мкмоль/л). Ранний послеоперационный период без осложнений (табл. 4). УЗИ щитовидной железы (19.05.2015): щитовидная железа расположена обычно, в размерах не увеличена, контуры ровные и четкие, паренхима средней эхогенности, умеренно диффузно-неоднородной структуры, узловых образований и зон измененной структуры не выявлено. В проекции типичного расположении ОЩЖ дополнительных образований не лоцируется. При ЭхоКГ кальциноза клапанов не выявлено. Через три недели пациентка выписана на амбулаторное наблюдение.

Амбулаторное наблюдение в течение полугода – состояние пациентки стабильно удовлетворительное, функция почечного трансплантата хорошая, пациентка продолжает трудовую деятельность (табл. 4).
Итак, согласно анамнестическим данным, в 18-летнем возрасте у пациентки диагностирован хронический гломерулонефрит (без гистологического подтверждения), спустя 17 лет (при нормальной функции почек) обнаружено опухолевидное образование в проекции правой доли ЩЖ, а спустя еще 15 лет на стадии начальной почечной недостаточности (креатинин крови – 266–284 мкмоль/л) – развернутая клинико-лабораторная картина тяжелого течения ГПТ. Такая хронологическая последовательность может свидетельствовать в пользу как существования у пациентки двух (конкурирующих) заболеваний – ХБП и первичного ГПТ, так и развившегося в юности первичного ГПТ (мягкой, или асимптомной, малосимптомной форм), приведшего в последующем к почечной патологии (хронический интерстициальный нефрит). Последние данные зарубежных исследователей указывают на высокую распространенность субклинической (бессимптомной) формы первичного ГПТ – до 50–80% [17, 18]. Характерными особенностями этой формы первичного ГПТ являются длительное существование с медленным прогрессированием заболевания до его манифестной формы, но при этом наличие высокого относительного риска развития почечной патологии [19]. Описаны и редкие семейные случаи первичного ГПТ, который проявляется в различные после рождения сроки – от неонатального периода до старшего детского возраста [20].
Независимо от того, присоединился ли первичный ГПТ к уже имевшейся почечной патологии, или явился ее причиной, очевидно, что длительное его существование (около 15 лет от момента первой информации об узле ЩЖ до аденомэктомии ОЩЖ) способствовало прогрессированию ХБП вплоть до проведения заместительной почечной терапии.
Если происхождение ХБП (до аденомы или вследствие аденомы ОЩЖ) может обсуждаться, то наличие у пациентки именно первичного ГПТ не вызывает сомнений. В его пользу свидетельствуют гиперкальциемия (только для ионизированного кальция крови – 1, 38 ммоль/л, общий кальций был в пределах нормальных значений и это характерно для первичного ГПТ на фоне ХБП), высокий уровень ПТГ (1676 пг/мл), повышенная в 1,5 раза активность ЩФ, характерные для фиброзного остеита рентгенологические изменения костной ткани, ультразвуковые и сцинтиграфические признаки аденомы правой нижней ОЩЖ, результаты интраоперационной ревизии (необнаруженные левые ОЩЖ). Диагноз подтвержден гистологическим исследованием, при котором выявлены важнейшие дифференциально-диагностические критерии аденомы ОЩЖ: наличие капсулы и полоски неизмененной ткани рядом с опухолью [21].
Вторичный (третичный) ГПТ «в чистом виде» на тот момент менее вероятен, т.к. он характеризуется неравномерной диффузной/диффузно-узловой гиперплазией всех ОЩЖ, а у нашей пациентки были обнаружены аденома с участком неизмененной ткани в одной железе и умеренная диффузная гиперплазия главных паратироцитов, а также уменьшение количества стромального жира во второй железе, остальные ОЩЖ интраоперационно не визуализировались. Тем не менее вторичный ГПТ имел место и это положение подтверждалось повышенным уровнем ПТГ в раннем послеоперационном периоде и нарастанием его по мере прогрессирования ХБП, а также тенденцией к нормализации функции ОЩЖ после выполнения пациентке успешной трансплантации почки. Несколько повышенный уровень ПТГ у реципиентов почечного трансплантата через полгода после операции, то, что имеет место у нашей пациентки, допустим, поскольку восстановление минерально-костного гомеостаза может продолжаться в течение года. Исследования свидетельствуют – при сопоставимой скорости клубочковой фильтрации реципиенты почечного трансплантата имеют больший, чем пациенты с ХБП, уровень ПТГ [22, 23]. По-видимому, в описанной ситуации, можно говорить о сочетании первичного (аденома правой нижней ОЩЖ) и вторичного (умеренная гиперплазия правой верхней ОЩЖ) ГПТ.
Таким образом, в некоторых случаях достаточно сложно проследить патогенетическую связь между ХБП и первичным ГПТ, что затрудняет своевременную диагностику и удаление аденомы ОЩЖ, а на этапе терминальной почечной недостаточности – определение происхождения ГПТ.

