Введение
COVID-19 представляет собой острое респираторное заболевание, вызываемое коронавирусом SARS-CоV-2, пандемия которого стартовала в декабре 2019 г. К настоящему времени число случаев этого заболевания в мире, по данным ВОЗ, превысило 639 млн, при этом число смертей составило более 6 млн. В России эти показатели равны соответственно 21 499 952 и 387 000 случаев. Почти за 3-летний период пандемии накоплен значительный опыт диагностики и лечения COVID-19, который, в частности, подтверждает вариабельность течения этого заболевания. Установлено, что в 80% случаев болезнь характеризуется легким течением, в то время как у 20% больных она протекает в среднетяжелой и тяжелой формах, а в части случаев приобретает даже критическое течение, при котором эффективность лечебных мероприятий подчас оказывается недостаточной [1–3]. С накоплением опыта стало очевидным, что риск тяжести заболевания и смерти возрастает с возрастом пациентов, а также в связи с сопутствующей патологией, прежде всего кардиоваскулярной и сахарным диабетом [1, 4–6]. Кроме того, выявлена также связь между тяжестью течения COVID-19 и хронической болезнью почек (ХБП) [7]. Так, по данным отчета за 2020 г. Института здоровья Италии, хроническая почечная недостаточность (ХПН) оказалась четвертой по частоте причиной смерти от COVID-19, составив 23,1% и уступив место только артериальной гипертензии (66%), сахарному диабету 2 типа (29%) и ишемической болезни сердца (27,9%) [8].
По современным представлениям в патогенезе тяжелого течения COVID-19 центральную роль играет гипериммунный ответ с развитием синдрома высвобождения цитокинов, подобно тому, как это происходит при гриппе или тяжелом остром респираторном синдроме (SARS – Sever Acute Respiratory Syndrome) [9–11]. В частности, это подтверждается данными о высоком и коррелирующем с тяжестью заболевания уровне в крови больных COVID-19 маркеров воспаления и провоспалительных цитокинов [5, 9, 12, 13]. Среди последних ведущую роль играет интерлейкин-6 (ИЛ-6), который рассматривается в настоящее время как ключевой медиатор в иммунопатогенезе COVID-19. Будучи многофункциональным цитокином, вырабатываемым различными типами клеток, ИЛ-6 участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции иммуноглобулинов, активация Т-клеток, стимуляция выработки белков острой фазы в печени, а также стимуляция гемопоэза.
Таким образом, ИЛ-6 вовлечен в механизм развития различных заболеваний, в т.ч. воспалительных и онкологических [14–16]. Полагают, что при новой коронавирусной инфекции вирусные частицы фагоцитируются альвеолярными клетками, которые через главный комплекс гистосовместимости (MHC-I – Major Histocompatibility Complex) представляют вирусные пептиды CD4+T-лимфоцитам. Последние при этом активируются и продуцируют интерферон γ (IFN-γ), гранулоцитарный макрофагальный колоний-стимулирующий фактор и провоспалительные цитокины (прежде всего ИЛ-1 и ИЛ-6, фактор некроза опухоли-a), рекрутирующие нейтрофилы и моноциты, которые, в свою очередь активируясь, продуцируют свободные кислородные радикалы и избыточную концентрацию ИЛ-6. В результате ИЛ-6 связывается как с мембранным рецептором, расположенным на иммунокомпетентных клетках и гепатоцитах (классический путь), так и со своим растворимым рецептором (транссигнальный путь активации). Образующийся комплекс ИЛ-6/растворимый рецептор взаимодействует с трансмембранным белком гликопротеином 130 (gp130), который является учредителем класса всех цитокиновых рецепторов и представлен на подавляющем большинстве клеток человеческого организма. При новой коронавирусной инфекции именно транссигнальный путь позволяет ИЛ-6 оказать повреждающее воздействие на различные ткани и органы, прежде всего на альвеолярные клетки [17].
Приведенные данные легли в основу представлений, согласно которым важной составляющей лечения COVID-19 наряду с глюкокортикостероидами (ГКС) являются моноклональные антитела к рецепторам ИЛ-6. Последние, ингибируя как растворимые, так и мембранные рецепторы ИЛ-6, препятствуют активации иммунокомпетентных клеток и повреждению тканей, а также ингибируют синтез в гепатоцитах острофазовых маркеров воспаления [13, 18].
Таким образом, в международной клинической практике с 2020 г. для терапии COVID-19 широкое распространение получили лекарственные препараты тоцилизумаб (Актемра) и сарилумаб (Кевзара), представляющие собой гуманизированные моноклональные антитела к рецепторам ИЛ-6 из подкласса иммуноглобулинов G 1 (IgG1) [9, 13, 17]. Данные препараты были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения синдрома высвобождения цитокинов, в т.ч. при тяжелом течении COVID-19. К настоящему времени накоплена доказательная база по эффективности и безопасности этих препаратов при СOVID-19-пневмонии [19–24], что позволило включить их в международные рекомендации [25], хотя вопрос об оптимальных сроках введения пока однозначно не решен. В отечественной клинической практике с 2020 г. получил распространение другой ингибитор рецептора ИЛ-6 – препарат левилимаб (Илсира®, АО «БИОКАД»), который представляет собой рекомбинантное моноклональное антитело и имеет аналогичный тоцилизумабу и сарилумабу механизм действия. Левилимаб зарегистрирован в России 05.06.2020 по ускоренной процедуре для применения в условиях угрозы возникновения и ликвидации чрезвычайных ситуаций и одобрен Минздравом РФ для лечения угрожающего жизни острого респираторного дистресс-синдрома, сопровождающегося повышенным высвобождением цитокинов. В дальнейшем препарат получил постоянную регистрацию в качестве патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении CОVID-19. При этом, согласно Временным методическим рекомендациям по профилактике, диагностике и лечению новой коронавирусной инфекции, разработанным экспертами Минздрава РФ уже в начале пандемии, применение ингибиторов рецепторов ИЛ-6 в комбинации с ГКС стало рассматриваться как терапевтическая опция для пациентов и со среднетяжелой формой пневмонии, и с тяжелым поражением легких «с целью подавления цитокинового шторма и предотвращения развития полиорганной недостаточности» [26].
Эффективность и безопасность левилимаба были оценены в многоцентровом рандомизированном плацебо-контролируемом двойном слепом исследовании СORONA, в которое были включены 217 больных (рандомизированы 206 человек) с тяжелой COVID-19-пневмонией, нуждавшихся в кислородной поддержке, но не требовавших по своему состоянию искусственной вентиляции легких (ИВЛ). Результаты этого исследования показали, что пациенты, лечившиеся левилимабом, в 1,5 раза чаще, чем включенные в группу «плацебо» (63,1 против 42,7%), достигли устойчивого клинического улучшения и выписались из стационара к 14-му дню после однократного подкожного введения 324 мг левилимаба. Кроме того, в испытуемой группе число больных, нуждавшихся в лечении в условиях отделения реанимации и интенсивной терапии (ОРИТ), было в 3,3 раза меньше, чем среди пациентов, получавших стандартную терапию, что позволяет думать об упреждающем эффекте препарата. Более того, пациенты, получавшие левилимаб, в 3 раза реже, чем в группе «плацебо» (12,6 против 40,8%; p<0,0001), нуждались в его повторном введении в качестве «терапии спасения», что свидетельствует о целесообразности раннего применения данной терапии. Частота побочных эффектов в испытуемой группе была сопоставимой с таковой в группе «плацебо»; повышения частоты значимых бактериальных инфекций не наблюдалось. Из значимых побочных эффектов отмечали повышение уровня трансаминаз печени и нейтропению легкой или умеренной степени. Таким образом, проведенное исследование убедительно продемонстрировало эффективность и безопасность левилимаба при лечении тяжелой COVID-19-пневмонии [27]. С приведенными данными полностью согласуются и результаты наблюдательных исследований, в которых также была показана эффективность подкожного и внутривенного введения левилимаба в отсутствие заметных серьезных побочных эффектов при лечении COVID-19-пневмонии, главным образом средней степени тяжести [28, 29]. Заслуживает также внимания многоцентровое открытое наблюдательное исследование, направленное на изучение эффективности и безопасности левилимаба при его применении на амбулаторном этапе у пациентов с COVID-19 легкого течения с минимальным объемом поражения легких (КТ1), результаты которого демонстрируют упреждающее противовоспалительное действие левилимаба, снижающее вероятность прогрессирования пневмонии [30]. Обобщенный анализ отечественного опыта был рассмотрен 18.06.2022 в Санкт-Петербурге на заседании специального экспертного совета, который на основании полученных к настоящему времени данных принял резолюцию «Опыт упреждающей терапии ингибиторами рецептора ИЛ-6 и перспективы ее применения в рамках эволюции COVID-19», согласно которой применение препарата левилимаб рекомендуется как в условиях стационара при лечении COVID-19 в случаях симптомов гипервоспаления «с упреждающей целью» или для купирования цитокинового шторма, так и на догоспитальном этапе в качестве ранней упреждающей противовоспалительной терапии при легком с наличием факторов риска прогрессирования или среднетяжелом течении с симптомами системного воспалительного ответа [31].
Следует отметить, что приведенные выше публикации демонстрируют эффективность левилимаба при COVID-19 у пациентов с разного рода сопутствующей патологией, в большинстве случаев сердечно-сосудистой и сахарным диабетом, в то время как больные, страдающие ХБП, которая, как отмечено выше, является фактором риска, осложняющим течение этого заболевания [7,8], в исследования, как правило, не включались. Лишь в работу Е.В. Тавлуевой и соавт. [29] были включены 40 нефрологических пациентов, функциональное состояние почек которых, однако, не охарактеризовано. В этой публикации обращает на себя внимание тот факт, что у одного из пациентов с ХБП после введения левилимаба отмечено кратковременное обратимое повышение уровня креатинина сыворотки крови, причину которого авторы, однако, не анализируют. В то же время в инструкции по применению препарата отмечается, что данные о его фармакокинетике при почечной недостаточности отсутствуют и при снижении скорости клубочковой фильтрации (СКФ) до <60–30 мл/мин вводить левилимаб следует с осторожностью, а при уровне СКФ<30 мл/ мин он противопоказан.
Вместе с тем, как следует из сказанного выше, ХБП, бесспорно, является фактором риска тяжелого течения и даже смерти при COVID-19 [7, 8]. В связи с этим и принимая во внимание приведенные выше данные об эффективности левилимаба при COVID-19 разной cтепени тяжести, в т.ч. о его упреждающем действии [30], при лечении новой коронавирусной инфекции у наблюдавшихся нами больных со снижением функции почек мы приняли решение применить левилимаб вне существующего стандарта (off-label) по решению консилиума и специальной врачебной комиссии. Подавляющее большинство из этих больных при поступлении в стационар имели разной степени почечную недостаточность.
Целью настоящей работы явились анализ результатов и оценка эффективности и безопасности применения левилимаба при лечении COVID-19 у больных ХПН.
Материал и методы
Исследование было наблюдательным неконтролируемым одноцентровым и ретроспективным. Оно включило 56 больных (29/52% мужчин, 27/48% женщин) в возрасте от 33 лет до 91 года. Медиана возраста составила 67,5 (60;75) года. Все пациенты были госпитализированы с октября 2020 по март 2022 г. в нефрологическое отделение ГКБ № 52 Департамента здравоохранения Москвы, перепрофилированное для оказания медицинской помощи SARS-CoV-2-инфицированным пациентам.
Среди причин ХБП преобладали гломерулонефриты, которые были диагностированы у 16 (28%) больных, у 10 из которых они были первичными идиопатическими, а у 6 – ассоциированными с васкулитом, связанным с действием антител к цитоплазме нейтрофилов (АНЦА – антинейтрофильные цитоплазматические антитела). На втором месте по частоте было диабетическое поражение почек, которое имело место у 14 (25%) пациентов, на третьем месте находился гипертонический нефроангиосклероз, диагностированный у 9 (16%) больных, хроническая тубулоинтерстициальная нефропатия разной природы, в т.ч. подагрическая и обструктивная, констатирована у 8 (14%) пациентов, патология единственной почки у 4 (7%) пациентов. Единичные случаи были представлены поликистозом почек (3 больных), амилоидозом (1 больной), ишемической болезнью почек (1 больной).
У всех пациентов, за исключением одного, имела место ХПН, характеризовавшаяся повышением уровня креатинина сыворотки крови при поступлении до 12–387 с медианой 173 (137; 237) мкмоль/л. Соответственно, показатель расчетной СКФ варьировался в диапазоне от 8 до 64 при медиане 27,5 (20;41,8) мл/мин/1,73 м2. Распределение больных по стадиям ХБП представлено в табл. 1, в которой показано, что в целом почти в половине случаев (47%) имела место ХБП 3-й стадии, причем стадия ХБП 3А диагностирована у 10 (18%), а ХБП С3Б у 16 (29%) больных. У 21 (38%) пациента ХБП находилась в стадии 4, а в 8 (14%) случаях – в стадии 5 (додиализной). Лишь у 1 (2%) больного имела место ХБП С2 (табл. 1). Таким образом, у 26 (46,4%) больных СКФ находилась в диапазоне от 60 до 30 мл/мин, у 29, т.е. у 52%, была ниже 30 мл/мин.
COVID-19 диагностировался на основании клинической картины болезни и подтверждался данными полимеразной цепной реакции (ПЦР) с целью выявления РНК вируса из материала мазка, полученного из носоглотки, а также результатами компьютерной томографии (КТ) грудной клетки.
ПЦР выполнялась с помощью тест-систем «Ампли Тест SARS-CoV-2» (ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА России), «Поливир SARS-CoV-2 Express» (Научнопроизводственная фирма «Литех», «РеалБест РНК SARSCoV-2» ФБУН «Государственный научный центр вирусологии и биотехнологии "Вектор"» (Россия).
КТ-диагностика и лабораторное обследование проводились соответственно Временным методическим рекомендациям по профилактике и лечению новой коронавирусной инфекции Минздравом России (версия 8 от 03.09.2020). Всем больным проведена пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии, выполнялись и контролировались в динамике клинический анализ крови с определением уровня эритроцитов, гемоглобина, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы, а также биохимическое исследование уровня в сыворотке крови мочевины, креатинина, электролитов, глюкозы, аланинаминотрансферазы, аспартатаминотрансферазы, общего билирубина, альбумина и лактатдегидрогеназы. Как основные лабораторные маркеры активности заболевания определялись С-реактивный белок (СРБ) и ферритин сыворотки крови, исследовался Д-димер. Кроме того, у всех пациентов контролировали общие анализы мочи и суточную протеинурию. При поступлении и при выписке рассчитывали также показатель СКФ по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration, 2009 г. в модификации 2011 г.). Клинический статус пациентов оценивали с помощью ординальной шкалы по следующим категориям: «выписан», «не нуждается в оксигенотерапии, но требует противовоспалительной терапии», «нуждается в оксигенотерапии», «нуждается в высокопоточной оксигенации или неинвазивной вентиляции легких (НИВЛ)», «нуждается в ИВЛ или экстракорпоральной мембранной оксигенации», «умер».
Лечение СOVID-19 проводилось в соответствии с 14-й версией Временных рекомендаций Минздрава РФ [32] и включило помимо левилимаба противовирусные препараты ремдесивир и ковид-глобулин, а также антикоагулянты (низкомолекулярный гепарин). У 45 (80%) больных применяли ГКС, как правило, дексаметазон в дозе 8 мг/cут. Исключением были 6 пациентов с АНЦА-васкулитом, которым с целью предупреждения активации основного заболевания повышалась принимаемая ими поддерживающая доза преднизолона (обычно до 15–20 мг/ сут.), а при доказанной активности АНЦА-васкулита доза увеличивалась до 30 мг/сут.
Всем пациентам проводили лечение левилимабом. При этом (в отличие от других авторов) большинству (94,6%) пациентов препарат назначали внутривенно, обычно в дозе 324 мг. Лишь в 10 (17,9%) случаях доза препарата была снижена до 162 мг, с другой стороны, в единичных случаях с учетом тяжести состояния больных она увеличивалась до 486–648 мг (соответственно по 4/7% пациента в каждой подгруппе). В подавляющем большинстве (87%) случаев левилимаб вводили в первые сутки госпитализации. У 11% больных первое введение препарата выполнено на 2-е сутки, в 2% случаев – на 3–6-е сутки пребывания в стационаре. У 42 (75%) больных имелась необходимость в дополнительной инфузии, в связи с чем у 32 (60%) из них левилимаб был введен повторно на следующий день после первого введения в дозе, как правило, 324 мг. В 10 случаях препарат вводился повторно в дозах 162 мг (редко) или 324 мг (как правило) на 3–6-е сутки после его первой инфузии в связи с сохраняющимся субфебрилитетом, отсутствием должного снижения уровня СРБ, уровень активности которого был признан как ключевой маркер оценки эффективности терапии. Статистический анализ. При нормальном распределении непрерывных переменных рассчитывали средние значения и среднеквадратическое отклонение, а в случаях распределения, отличного от нормального, вычисляли медиану 25 и 75 перцентилей. Частотные показатели представлялись числом и долей пациентов с наличием или отсутствием анализируемого признака. Сравнительный анализ средних показателей, а также относительных величин выполнялся по t-критерию Стьюдента, а при неправильном распределении переменных – по критерию Манна–Уитни. При сравнении переменных значимыми считали различия при p<0,05. При статистической обработке данных использовали пакет программ SPSS (версия 22).
Результаты
Диагноз COVID-19 у всех наблюдавшихся больных был подтвержден результатами ПЦР, а также данными КТ грудной клетки, выявлявшей характерную картину пневмонии, свойственную этому заболеванию.
Все пациенты, за исключением трех, госпитализировались и лечились в отделении нефрологии. Только упомянутые 3 (5,3%) пациента при поступлении находились в крайне тяжелом состоянии и были госпитализированы в ОРИТ. Клиническое состояние большинства из остальных 53 больных при поступлении оценивалось как средней степени тяжести, существенно реже оно было тяжелым.
При этом лихорадка с повышением температуры тела до 38,4±0,7°С была зарегистрирована у 40 (71,4%) из 56 больных, кашель у 32 (57%) , одышка у 11 (20%) из них. Общая слабость имела место в 24 (43%) случаях. На головную боль жаловались 18 (32%) больных, на боль в горле – 14 (25%), на мышечные боли – 10 (18%). Рвота и диарея отмечены соответственно у 4 (7%) и 11 (20%) пациентов. Аносмия имела место в 9 (16%) случаях.
Распределение больных по данным КТ представлено в табл. 2. В половине случаев (у 28/50% больных) протяженность поражения легких не превышала 25%, что по КТ соответствует COVID-19-пневмонии 1-й степени, а у 3 (5,3%) больных КТ-признаки пневмонии вообще отсутствовали. Объем поражения легких до 50% (КТ 2-й степени) диагностирован в 17 (30,6%) случаях, и у 8 (14,2%) пациентов изменения в легких были еще более распространенными (более 50% легочной ткани), т.е. соответствовали КТ 3-й или 4-й степени (5 и 3 больных соответственно).
Таким образом, как следует из представленных данных, у большинства больных поражение легких было минимальным или умеренным, что согласуется с уровнем сатурации SpO2, который составлял в среднем 95,8±1,7%. В то же время при поступлении около 20%, а с 4-х суток госпитализации даже 30% больных нуждались в кислородной поддержке, которая обеспечивалась назальной инсуффляцией увлажненного кислорода потоком 4–5 л/мин.
Изменения со стороны периферической крови характеризовались в основном лимфопенией с медианой числа лимфоцитов 0,7×109/л (0,5×109/л; 1,0×109/л) при медиане числа лейкоцитов 3,7×109/л (2,8×109/л; 4,6×109/л).
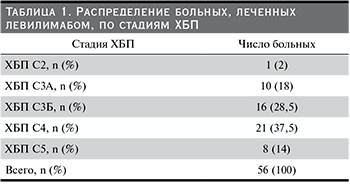
СРБ практически у всех больных был повышен и варьировался в диапазоне от 6,3 до 186 мг/л, его медиана составила 36 (18,5; 77) мг/л. Уровень ферритина крови характеризовался медианой 334,6 (176; 692) мкг/л. Медиана уровня лактатдегидрогеназы в сыворотке крови была равна 302,5 (240,5; 392) Е/л. Введение левилимаба приводило к быстрому снижению активности болезни, что проявилось нормализацией температуры тела уже на следующий день после введения препарата (рис. 1) и снижением к 7-м суткам до нормы уровня СРБ, медиана которого снизилась к моменту выписки до 1,0 (0,34; 3,5) мг/л (р<0,0001, рис. 2).
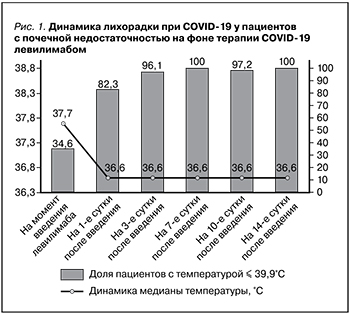
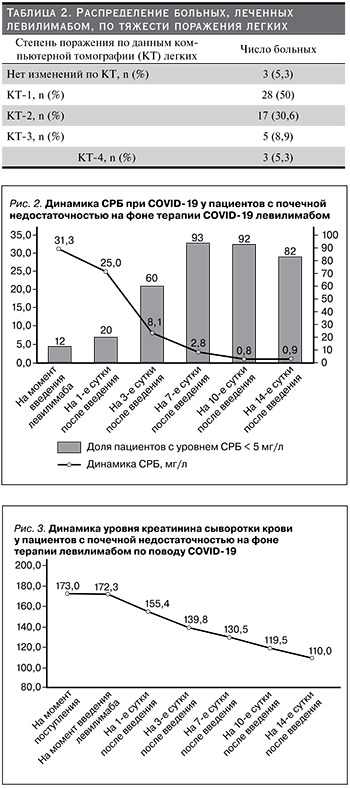
Отрицательной динамики функции почек в условиях проводившегося лечения не отмечено ни в одном из случаев. Напротив, на фоне улучшения состояния у 42 (75%) из 56 пациентов показатель уровня креатинина сыворотки крови снижался, и к моменту выписки из стационара его медиана составила 127 (106; 185) мкмоль/л по сравнению с исходным значением 173 (137; 237) мкмоль/л (р<0,0001). Лишь в 14 (25%) случаях он оставался примерно на одном и том же уровне (рис. 3). Соответственно, медиана показателя СКФ повысилась с 27,5 (20; 41,6) мл/мин/1,73 м2 при поступлении до 41 (26,5; 62,1) мл/мин/1,73 м2 при выписке (р<0,0001).
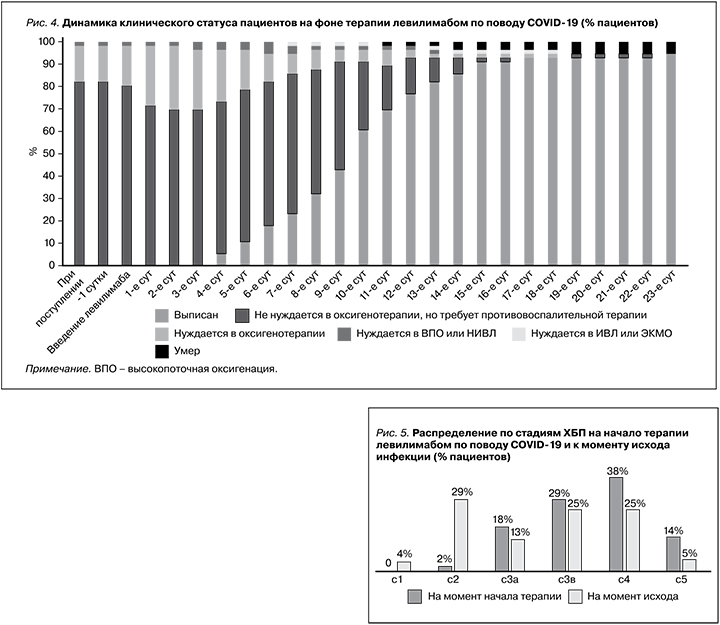
При оценке клинического статуса пациентов на фоне терапии левилимабом (рис. 4) наблюдалось прогрессивное увеличение числа выписанных пациентов,начиная с 4-х суток после введения левилимаба. Повышение потребности в кислородотерапии у 10% пациентов, наблюдавшееся в течение первых 3 суток после введения, сменилось значимым ее сокращением вплоть до выздоровления.
Конечным результатом лечения 53 (94,6%) пациентов было выздоровление от COVID-19 с выпиской из стационара начиная с 4-х и вплоть до 14–18-х суток госпитализации. При этом у 42 (79%) из них выздоровление сопровождалось повышением функции почек (рис. 5).
Умерли, несмотря на введение левилимаба, 3 (5,4%) больных, поступивших, как уже отмечено, в крайне тяжелом состоянии и госпитализированных в ОРИТ. Все трое были преклонного возраста (74, 84 и 90 лет) и имели серьезную сопутствующую патологию, которая включала ожирение и ишемическую болезнь сердца на фоне ХБП С5 в одном случае, сахарный диабет 2 типа и постоянную форму фибрилляции предсердий при ХБП С, ХБП С3А во втором и онкологическое заболевание на фоне ХБП С4 в третьем случае. COVID-19 протекал у этих больных с выраженными явлениями общей интоксикации, лихорадкой до 38,2–39,0°С и гипоксемией, что у 2 из них на 2-е и 11-е сутки госпитализации потребовало ИВЛ. Введение левилимаба этим больным было неэффективным, смерть наступила на 11-е, 14 и 15-е сутки, несмотря на активную терапевтическую тактику.
Серьезных побочных эффектов при лечении левилимабом мы не наблюдали. Что касается отмеченного другими отечественными авторами повышения уровня в крови аланинаминотрансферазы (АЛТ), то мы наблюдали его значимое повышение лишь в 7% случаев, а в 20% констатировали только его кратковременное транзиторное увеличение [28, 29]. В то же время у 59% пациентов уровень этого показателя оставался стойко нормальным, у 11% наблюдалась нормализация его исходно повышенного значения.
Таким образом, у наблюдавшихся больных ХПН мы не отметили ни ренальных, ни экстраренальных клинически значимых отрицательных побочных эффектов левилимаба при его применении в качестве патогенетической терапии COVID-19.
Обсуждение
Наше исследование демонстрирует в целом благоприятный терапевтический эффект ингибитора рецепторов ИЛ-6 левилимаба, применявшегося для терапии COVID-19 у пациентов с почечной недостаточностью, которая более чем в половине случаев характеризовалась снижением СКФ ниже 30 мл/мин. В большинстве случаев препарат назначали в комбинации с ГКС. При этом следует отметить, что наша тактика лечения отличалась от предпринятой другими авторами. В частности, с учетом риска прогрессирования COVID-19 на фоне ХПН мы вводили препарат не подкожно, а внутривенно и у 42% больных повторно, с повышением однократной дозы у части из них. Несмотря на указанные отклонения, каких-либо серьезных побочных эффектов левилимаба мы не отметили. Напротив, введение препарата способствовало быстрой регрессии симптомокомплекса системного воспаления, в 79% случаев – снижению уровня креатинина по сравнению с данными при поступлении и сокращению срока пребывания больных в стационаре. Результаты наших наблюдений, таким образом, полностью согласуются с данными других авторов о благоприятном клиническом действии левилимаба в отношении COVID-19, полученными в группах больных без поражения почек [28–30].
Клиническое течение COVID-19 более чем у половины наблюдавшихся нами пациентов можно оценить как относительно легкое или (чаще) среднетяжелое, следовательно, левилимаб вводился как с терапевтической, так и с упреждающей целью. Действительно, на фоне терапии мы не отметили у категории больных ХБП прогрессирования инфекции в целом и увеличения протяженности поражения легких в частности. Исключение составили лишь упомянутые выше 3 (5,4%) пациента преклонного возраста, поступивших практически в критическом состоянии и страдавших серьезной сопутствующей патологией на фоне значительной почечной недостаточности, при том что протяженность пневмонии у них была минимальной или весьма умеренной (КТ-1 в двух случаях и КТ-2 в одном).
Следует отметить, что наблюдаемый нами, как и другими авторами, эффект левилимаба подобен таковому при действии других ингибиторов рецепторов ИЛ-6, в частности тоцилизумаба, применяемого, однако, как правило, не с упреждающей целью, а для подавления цитокинового шторма при тяжелом течении COVID-19-пневмонии [20, 21, 33]. При этом вопрос о лечении тоцилизумабом пациентов с почечной недостаточностью в литературе специально не обсуждается. Как правило, имеются лишь только краткие упоминания о возможности применения тоцилизумаба у больных на гемодиализе и после трансплантации почки [34, 35]. В то же время наши собственные предшествующие наблюдения показали, что введение тоцилизумаба при среднетяжелом течении COVID-19 у пациентов с почечной недостаточностью способствует повышению функции почек, сопутствующему развитию клинической ремиссии новой коронавирусной инфекции [19]. Точно так же и в настоящей работе под влиянием левилимаба по мере регрессии симптомов системного воспаления наблюдалось постепенное повышение показателей функции почек (рис. 3). Как следствие, если при поступлении у половины больных стадия ХБП оценивалась как С 4, то к моменту выписки ее тяжесть уменьшилась до С 3Б (рис. 5). Эти данные позволяют предполагать нефротропный эффект вируса SARS-CoV-2, возможно цитопатический, вызывающий острую обратимую дисфункцию почек, которая наслаивается на необратимое органическое повреждение органа. Природа этой дисфункции требует дальнейшего изучения.
Заключение
Результаты наших исследований позволяют заключить, что у больных ХПН левилимаб обладает хорошим профилем безопасности и достаточно эффективен при его применении с упреждающей и терапевтической целями при легкой и среднетяжелой формах COVID-19 независимо от степени снижения функции почек. Особенностью новой коронавирусной инфекции у больных этой категории является высоко вероятное в ее активной фазе наслоение острой дисфункции почек на предсуществующее их органическое повреждение, что может быть связано как с нефротропным эффектом вируса SARS-CoV-2, так и с действием цитокинов, и потенциально обратимо по мере выздоровления от инфекции. При применении левилимаба не было выявлено ни одного случая усиления почечной дисфункции, а в ряде случаев отмечается снижение уровня креатинина ниже исходного на фоне лечения вирусной инфекции и купирования активной воспалительной реакции. Тем не менее факт развития дисфункции почек в острой фазе болезни позволяет заключить, что нефрологические пациенты после выписки из стационара после перенесенного COVID-19 нуждаются в пристальном мониторинге.



