В настоящее время длительное время выживания трансплантата связано с постоянным совершенствованием хирургической техники, анестезиологического пособия, интенсивной терапии и современных эффективных иммуносупрессоров. Однако прекрасные долгосрочные результаты трансплантации сводятся на нет из-за возникающих осложнений, особенно при развитии рака. Заболеваемость, агрессивность, прогноз при возникновении рака значительно хуже, чем в общей популяции [1].
Длительно проводимая иммуносупрессия приводит к онкологическим заболеваниям от 6 до 20% реципиентов почечных трансплантатов и является одной из наиболее частых причин смерти этой категории больных [2, 3]. С увеличением времени нахождения больных на гемодиализе и сроков, прошедших после трансплантации почки, частота злокачественных образований возрастает. Детальный анализ развития рака после трансплантации почки позволил выявить следующую закономерность: риск развития рака в 35 раз выше, чем в общей популяции, преимущественно за счет ретикулоклеточной саркомы [4]. Риск возникновения лимфом в 30–40 раз выше, чем в норме и остается таким в течение последующих пяти лет. Рак кожи и губы возникает в 4 раза чаще, чем в норме, и риск его появления увеличивается с возрастанием трансплантационного интервала [5]. Частота развития опухолей к 30 годам после операции пересадки почки увеличивается от 33 до 75%. Рецидивы онкологических заболеваний после трансплантации почки наблюдались у 181 (22%) из 823 больных с предшествовавшей онкологической патологией [2]. Иммунодепрессанты, такие как циклоспорин (ЦсА) и такролимус (програф), применяемые в отношении трансплантированных пациентов, могут вызывать иммунные дефекты, таким образом ставят под угрозу иммунную реакцию и содействуют развитию вторичного иммунодефицита, который в конечном итоге может облегчить развитие онкологических заболеваний [6]. Однако данные различных авторов по этому вопросу противоречивы. Так, некоторые исследователи считают, что применение ЦсА и такролимуса не повышает риска развития новообразований по сравнению с традиционной трехкомпонентной иммуносупрессией [7].
Было показано, что распространенность рака после 10 лет функционирующего трансплантата составляет 20–30%, а через 20 лет – 45% [8, 9]. Некоторые иммунодепрессанты (ингибиторы кальциневрина, азатиоприн, тимоглобулин) оказывают непосредственное влияние на онкогенез. Ингибиторы кальциневрина способствуют опухолевому росту и метастазированию путем ингибирования репарации ДНК и усиления апоптоза. Также стимулируется производство трансформирующего фактора роста-бета (TGF-бета) и фактора роста эндотелия сосудов (VEGF). Азатиоприн и его производные способны увеличивать повреждение ДНК и ингибировать восстановление ДНК. Thymoglobulin способствовует генетическим мутациям, вызванным онковирусом. При этом стоит отметить, что некоторые виды опухолей могут показать регресс, если иммуносупрессивная терапия отменяется или изменяется на такие препараты, как ингибиторы м-TOR и микофенолаты [8, 10]. Учитывая онкологическую настороженность у больных после трансплантации, потенциальную пользу могут приносить использование иммуносупрессивных лекарств с минимальным онкогенным потенциалом и противоопухолевым эффектом. Использование ингибиторов пролиферативного сигнала m-TOR (mammalian target of rapamycin) вместо ингибиторов кальциневрина способно снижать риск рака среди трансплантированных больных [11]. Ингибиторы m-ТОR показали прямой противоопухолевый эффект. А уменьшение рака при назначении микофенолатов связывается с уменьшением дозировок ингибиторов кальциневрина. В настоящее время при выявлении рака или онкологической настороженности, плохом онкологическом анамнезе (билатеральный рак нативных почек, трансплантация донорской почки пораженной опухолью) применяется препарат m-TOR сертикан (эверолимус) [12–15].
Возникновение опухоли в трансплантированной почке – довольно редкое явление. Первый случай возникновения de-novo опухоли в пересаженной почке был описан в 1988 г. [16]. Частота развития опухолей в трансплантате, по данным разных авторов, составляет от 0,1 до 0,9% [17, 18]. Большинство этих новообразований представляли собой папиллярно-клеточную карциному (55,7%), имели невысокую стадию и низкую степень злокачественности, средний размер опухоли составлял 27,8 мм. В то же время у 2 пациенток документированы случаи возникновения в трансплантатах переходно-клеточного рака высокой степени злокачественности – через 24 и 14 месяцев после ТП [19].
J.E. Belzer [20] полагает, что опухоль у трансплантированных больных под влиянием иммуносупрессии может возникать тремя путями:
- возникновение опухоли в пересаженной почке;
- перенос раковых клеток самой пересаженной почкой;
- возникновение новообразований из метастазов.
I. Penn считает, что опухоли ренального трансплантата, диагностированные ранее чем через 2 года после трансплантации, следует считать перенесенными от донора, хотя граница данного временного интервала для опухолей донорского происхождения точно не определена [21]. Вопрос о трансплантации донорских органов, пораженных опухолью, в настоящее время решается неоднозначно. В ретроспективном исследовании, включившем 10 997 донорских почек, во время подготовки к трансплантации было выявлено 30 органов (0,273% почек и 0,546%доноров) с почечно-клеточными карциномами, 67% этих опухолей имели размеры менее 20 мм и были удалены перед трансплантацией, которая затем была успешно осуществлена [22].

В установлении клеток опухоли могут помочь молекулярно-генетические исследования, поскольку характеристики донора и реципиента хорошо известны [23]. Вопрос о передаче раковых клеток вместе с донорским органом даже при наличии онкопроцесса у донора не всегда однозначен. Был проведен гинетический анализ опухоли, обнаруженной в трансплантате у 58-летнего пациента через 14 лет после пересадки почки, изъятой у донора с онкопроцессом (опухолью печени). На основании анализа ДНК авторы сделали вывод, согласно которому опухоль произошла из клеток реципиента, а не донора. Авторы выдвинули гипотезу о происхождении опухоли из стволовых клеток собственной почки или костного мозга, что в данном исследовании выглядит правдоподобно [24].
Злокачественные опухоли могу развиваться как в собственных (нативных) нефункционирующих почках, так и в трансплантированной почке – функционирующей или нефункционирующей. Риск возникновения почечно-клеточных карцином у реципиентов почечного трансплантата в 15 больше, чем в общей популяции. Примечательно, что среди всех почечно-клеточных карцином примерно 40% являются папилярным раком по сравнению только 10–15% в общей популяции [25, 26]. Развитию почечно-клеточного рака после ТП могут способствовать как традиционные факторы риска (курение, избыточная масса тела, злоупотребление анальгетиками), так и иммуносупрессия, вирусные инфекции (BK-вирус), болезнь фон Гиппеля–Линдау, приобретенная кистозная болезнь почек [27]. Кроме того, отмечается одновременное развитие двух-трех разных по гистологическому строению опухолей. Эти опухоли гистогинетически совершенно разные, топографически отличаются от других и не включают новообразования или метастазы первичной опухоли. Они классифицируются как одновременные (появление в одно и то же время), синхронные (появление второй опухоли в течение шести месяцев) и метахромные (вторая опухоль появляется через шесть месяцев после появления первичной) [28]. В литературе описано сочетание рака кожи, неходжкинской лимфомы и злокачественной гистиоцитомы у одного больного с длительной стабильной функцией почечного трансплантата [29]. Описан уникальный случай развития двух почечно-клеточных карцином различного происхождения у одного реципиента: через 2 года после ТП у него была выявлена опухоль собственной левой почки (выполнена лапароскопическая нефрэктомия), а через 13 лет после трансплантации – опухоль трансплантированной почки (осуществлена органосохраняющая операция) [30]. Учеными из Испании ретроспективно проанализированы 1200 больных после трансплантаций почки, выполненных за 32 года. Среднее время выживаемости трансплантата составило 8 лет. Были проанализированы различные схемы иммуносупрессии, включая кортикостероиды, азатиоприн, ингибиторы кальциневрина (циклоспорин, такролимус), базиликсимаб, микофенолаты, m-TOR-ингибиторы. У 77 (6,4%) больных выявлен рак. У 53 (69% всех больных раком) был единственный рак, у 20 из них диагностирован рак кожи (меланома), у 33 – рак других органов. У 24 (31% всех больных раком) больных обнаружен синхронный или метахромный рак. Из них у 20 больных рак кожи сочетался с раком солидных органов, у 4 – рак только солидных органов. Авторы делают вывод, согласно которому длительное применение иммуносупрессоров может приводить к развитию не только одиночного, но и множественного рака у больных после трансплантации различного гистогенетического строения. Надо всегда помнить, что у больных после трансплантации может развиваться несколько видов рака при трех различных условиях: (1) пациенты, у которых в анамнезе был рак; (2) пациенты, которым выполняется трансплантация с раковыми клетками в донорском органе; (3) пациенты с развитием самостоятельного синхронного (разный по иммуногистохимическому исследованию) рака после трансплантации солидного органа [31].
В связи с крайне редким возникновением синхронного рака у реципиента ренального трансплантата приводим собственное клиническое наблюдение.
Б о л ь н о й Г. 34 лет. И.Б. 18484 поступил 31.08.2015 с диагнозом: хронический диффузный гломерулонефрит, ХБП-V. ИБС. Дилятационная кардиомиопатия, ХСН 2-й Б-ст., ФК 3. Вторичная артериальная гипертензия II степени, Вторичная анемия. Аллотрансплантация трупной почки в 2011 г. Хронический гепатит «B+С» в стадии ремиссии. Состояние после паратиреоидэктомии в 2009 г.
С 2000 г. отмечается артериальная гипертензия до 210/110 мм рт.ст., протеинурия до 5 г/сут. С февраля 2003 г. гиперазотэмия. Сr сыворотки крови – 1485 ммоль/л, Ur сыворотки крови – 47,3 ммоль/л. Диагностирована ХБП-V. Перенес неоднократные оперативные вмешательства по формированию артериовенозной фистулы на предплечье. С 2003 г. начато лечение систематическим гемодиализом. В 2009 г. в связи со вторичным гиперпаратиреозом уровень паратиреоидного гормона – 1527 ммоль/л, выполнена тотальная паратиреоидэктомия с аутотрансплантацией в кивательную мышцу справа. Послеоперационный период без особенностей. Учитывая бесперспективность лечения основного заболевания, больной включен в лист ожидания трансплантата.
30.11.11 выполнена АТТП слева. Донору 43 года. Погиб от черепно-мозговой травмы. Совпадение по групповой совместимости полное. По системе HLA по 3 антигенам: A2, B35, DR4. Перекрестная проба отрицательная. Перед операцией проведена индукция симулектом 20 и на 4-е сутки – 20 (общая доза симулекта – 40). Во время операции введено 500 метилпреднизолона. Послеоперационный период осложнился ОПН трансплантата, что потребовало проведения 5 сеансов гемодиализа. Восстановление диуреза на 16-е сутки до 3500 мл. Нормализация азотемии на 18-е сутки. На 20-е сутки удален стент. Получает 3-компонентную терапию: преднизолон 20; Циклоспорин А 350; мофетила микофенолат 1500. Кол-во мочи за сутки до 2500. Hb – 99г/л, L – 6,8х 10'9. Cr крови – 0,12 ммоль/л, Ur крови – 8 ммоль/л., бил. общ. – 3 ммоль/л, холестерин – 5,73 ммоль/л, общ. белок – 56,9 ммоль/л. АСТ – 5,4; AЛТ – 3,7 ммоль/л, ЩФ – 47 ммоль/л, мочевая к-та – 340 мкмоль/л, триглицериды – 3,59 ммоль/л, железо – 25,6 ммоль/л, ферритин – 681 мкг/л. Посев мочи – стерильный. Fкл. – 62,5 мл/мин. Протеинурия – 0,28 г/л/сут, протеинурия – 1,03 г/сут. УЗИ трансплантата: размер 137×60×57 мм, контуры четкие, ровные. Дифференциация на слои сохранена, паренхима не утолщена, ЧЛС не расширена. RI – 0,78. УЗИ брюшной полости: патологии не выявлено. ЭХО-кардиография ФВ – 56%. Больной выписан домой в стабильном, удовлетворительном состоянии. Получал антибактериальную, противовирусную, противогрибковую, противоязвенную, гипотензивную терапию.
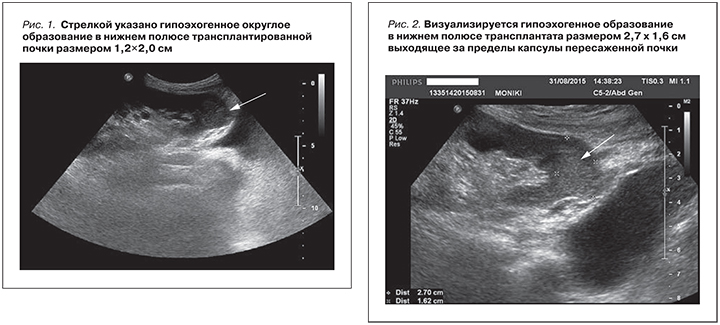
В 2014 г. при плановом осмотре было выявлено неоднородное гипоэхогенное, гиповаксулярное образование в нижнем полюсе трансплантированной почки (рис. 1). Образование округлой формы с четкими границами. Размер 1,2×2,0 см.
Гистологической верификации не проводилось. Больной от биопсии отказался. С мая 2015 г. у больного появились нарастающие боли в поясничной области и костях таза. Ro - легких: лимфоаденопатия, МТs грудного отдела позвоночника. 02.07.2015 МРТ позвоночника – картина структурных изменений позвонков, патологичечского перелома тела L4 позвонка, вторичные изменения костей таза. Дегенеративные изменения в пояснично-крестцовом отделе позвоночника. 03.07.2015 МСКТ поясничного отдела позвоночника: картина обширного Mts-процесса в кости таза и поясничный отдел позвоночника с патологическим переломом тела L4. 20.07.2015. СКТ костей таза. Картина смешанных Mts в кости скелета. Отмечается снижение высоты тела L4 до 1/2 с мягкотканным компонентом и компрессией спинномозгового канала на данном уровне. Деформация лонной и седалищной костей справа. Донорская почка с патологическим объемным образованием ее нижнего полюса. УЗИ трансплантата: контуры пересаженной почки четкие, ровные. Размер 11,5×6,5×5,0 см. Чашечно-лоханочная система не расширена и не деформирована. Экстраренальных образований не выявлено. В области нижнего полюса трансплантата визуализируется округлое гипоэхогенное образование с четкими границами (рис. 2). Размер 2,5×2,3 см. Образование не деформирует Ч-ЛС. Выходит за пределы капсулы трансплантата. От биопсии трансплантата больной отказался.
Поступил в ГБУЗ МО МОНИКИ 30.08.2015 в крайне тяжелом сопорозном состоянии, выраженный болевой синдром. Диагностирована полиорганная, дыхательная недостаточность. А/Д – 70/40 мм рт.ст. Количество мочи за сутки – 250 мл. Больной переведен на ИВЛ. При поступлении: Ur крови – 67,8 ммоль/л, Cr крови – 0,37 ммоль/л, Na – 126,7 ммоль/л, K – 7,03 ммоль/л Ca – 1,06 ммоль/л. Hb 37,3 г/л, Ht – 0,16, Plt – 36, WBC – 11,8х10'9, LYM – 29,3.
Alb – 21,8 г/л, AlP – 1589 ЕД/л, AST – 114,9 ЕД/л, ALT- 63,4 ЕД/л, Cholesterol – 4,63 ммоль/л, Uric Acid – 1245,35 ммоль/л, Phos. – 7,76 мг/дл, Ca – 1,89 ммоль/л, Iron 32, 89, Glucose – 7,3 ммоль/л, Creatine Kinase – 136 ЕД/л.
 В связи с анемией больному перелито 500 свежезамороженной эрицитарной массы. Учитывая гиперкалиемию, 7,3 ммоль/л, произведена попытка проведения гемодиализа. Однако в связи с некорригируемой гипотензией провести гемодиализ не удалось. 31.08.2015 диагностирована смерть больного. Развитие тяжелой анемии смешанного генеза (Hb – 37 г/л), тромбоцитопении (36×10'9/л) могло быть связано с ХНП и миелокарцинозом. Развитие полиорганной недостаточности на фоне раковой интоксикации: нефропатия трансплантата, бурая индурация легких, спленомегалия, правосторонний гидроторакс, тяжелая анемия смешанного генеза, тромбоцитопения, отек головного мозга, хронический гепатит В – привело к смерти больного.
В связи с анемией больному перелито 500 свежезамороженной эрицитарной массы. Учитывая гиперкалиемию, 7,3 ммоль/л, произведена попытка проведения гемодиализа. Однако в связи с некорригируемой гипотензией провести гемодиализ не удалось. 31.08.2015 диагностирована смерть больного. Развитие тяжелой анемии смешанного генеза (Hb – 37 г/л), тромбоцитопении (36×10'9/л) могло быть связано с ХНП и миелокарцинозом. Развитие полиорганной недостаточности на фоне раковой интоксикации: нефропатия трансплантата, бурая индурация легких, спленомегалия, правосторонний гидроторакс, тяжелая анемия смешанного генеза, тромбоцитопения, отек головного мозга, хронический гепатит В – привело к смерти больного.
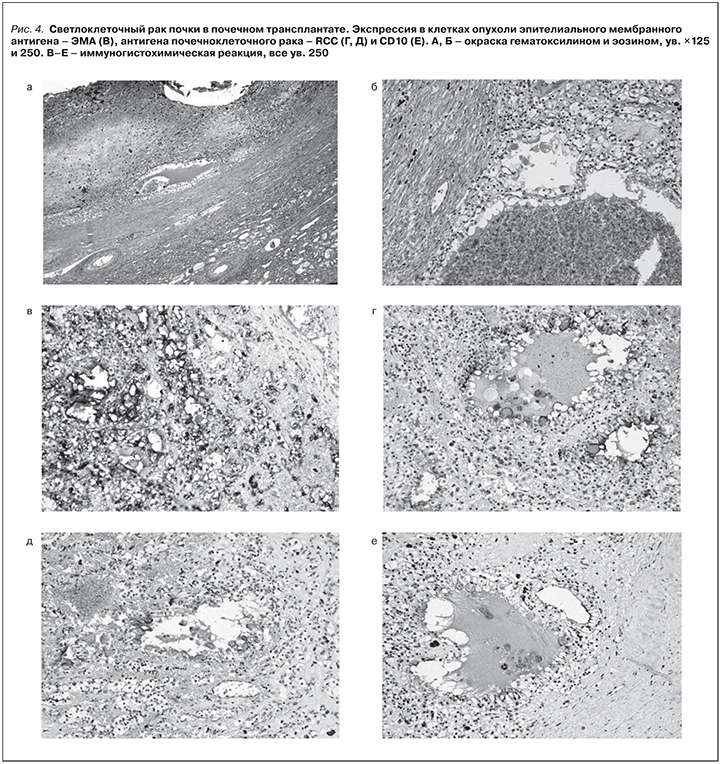
При патологоанатомическом исследовании в нефротрансплантате выявлен клинически диагностированный и гистологически подтвержденный светлоклеточный почечно-клеточный рак размером 1,7×2,0×1,2 см (рис. 3). Grade II по Фурман, pT1aN0M0, не сыгравший значительной роли в танатогенезе.
В нефротрансплантате имелись морфологические признаки трансплантационной нефропатии и дистрофические изменения эпителия канальцев. Гистологическое заключение: в биоптате определяются фрагменты опухолевых структур из мелких клеток, формирующих сосочки, солидные скопления крупных клеток с пенистой цитоплазмой. При иммуногистохимическом (ИГХ) исследовании клетки опухоли экспрессируют цитокератины широкого спектра (клон АЕ1/АЕ3), AMCAR, виментин, очагово – CD10 и цитокератин 7 (рис. 4). Заключение: строение и иммунофенотип клеток опухоли более всего соответствуют светлоклеточному варианту почечно-клеточного рака низкой степени злокачественности.
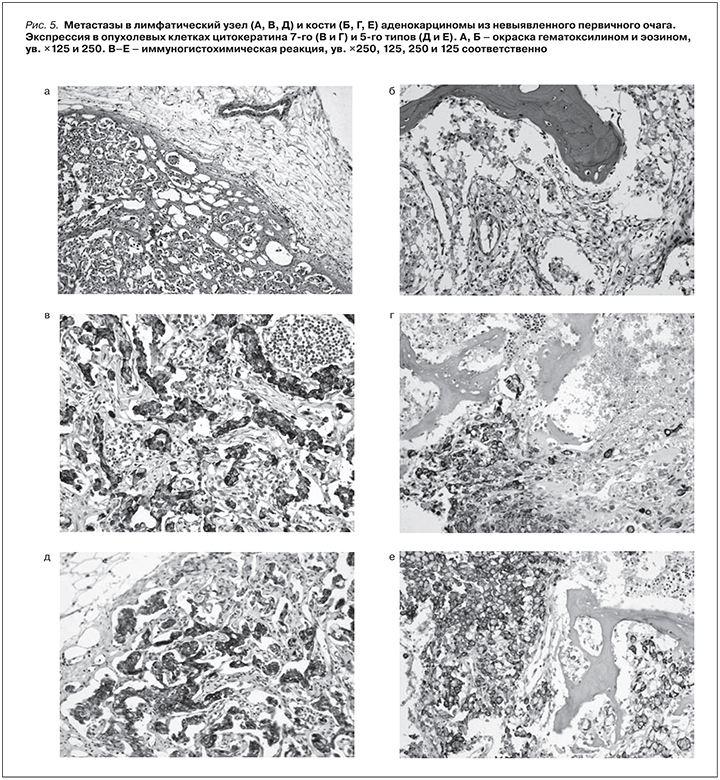
Кроме того, гистологически выявлена метастатическая низкодифференцированная аденокарцинома без выявленного первичного очага с метастазами в парааортальные подвздошные лимфоузлы, тело L4 позвонка (патологический перелом), кости таза, pTxN2M1, IV стадия. При иммуногистохимической реакции выявлены метастазы в лимфатический узел и кости муцинозной аденокарциномы из не выявленного первичного очага. Экспрессия в опухолевых клетках цитокератина, 7-й и 5-й типы (рис. 5).
Представленное наблюдение иллюстрирует возможность развития синхронного рака с поражением различных органов у одного пациента с функционирующим нефротрансплантатом. В хирургическом отделении трансплантологии и диализа МОНИКИ им. М.Ф. Владимирского при ретроспективном анализе 1765 пересадок трупных почек, выполненных с 1992 по 2015 г., нами было выявлено раковое поражение нефротрансплантата у 3 (0,16%) больных. У одной больной выявлен светлоклеточный рак трансплантата через 23 года после операции. Выполнена органосохраняющая операция с хорошей функцией пересаженной почки. У второй через год после трансплантации выявлена муцинозная аденокарцинома в жировой ткани почечного синуса, лоханки и паренхимы нефротрансплантата с сосудистой инвазией. Последний был удален. Больная погибла от раковой интоксикации и развития полиорганной недостаточности. У третьего реципиента (нашего больного) через два года после трансплантации диагностировано два разных (синхронных) по своей природе (гистогенетическому строению) рака с поражением пересаженной почки.
У нашего больного при иммуногистохимическом исследовании диагностирована разновидность почечно-клеточного рака – светлоклеточный рак. Последний поражает трансплантат в 10–12% случаев. Если при папиллярном раке выживаемость трансплантата составляет до 90%, то при светлоклеточном – до 54%. Патология пересаженной почки была выявлена через два года после трансплантации. Размеры опухоли (2,7×1,6 см), ее расположение (в нижнем полюсе), удовлетворительная функция пересаженной почки позволили выполнить резекцию трансплантата. Однако отрицательное отношение больного к находке в трансплантате не позволило верифицировать опухоль и выполнить оперативное лечение. Больной отказался от биопсии трансплантата. В случае диагностики единственной операбельной опухоли больной мог бы быть прооперирован и выписан домой с удовлетворительной функцией трансплантата. Кроме того, ранняя диагностика опухоли позволила перевести больного на лечение препаратами m-TOR, исключив из лечения препараты кальцийневрина. Эта замена препаратов, возможно, могла бы замедлить развитие синхронного рака и таким образом предотвратить летальный исход.
Второй находкой у нашего больного была верифицированная низкодифференцированная муцинозная аденокарцинома (перстневидно-клеточный рак) в регионарных парааортальных, подвздошных лимфоузлах и костях таза и тело L4 позвоночника (патологический перелом). К сожалению, первичного очага выявить не удалось. Муцинозная опухоль может быть выявлена в желудке, поджелудочной железе, толстой кишке. Особенностью муцинозной опухоли является наличие перстневидных клеток в гистопрепарате.
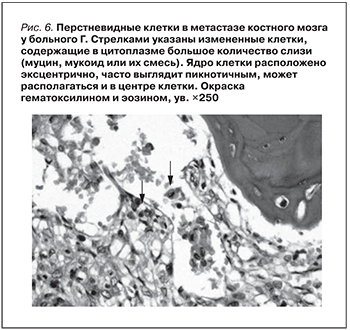
Часть аденокарцином продуцирует слизь. В таких слизеобразующих муцинозных аденокарциномах слизь может располагаться вне клеток, в строме, образуя полости (озера), в которых плавают раковые клетки – разрозненные, группами, в виде отдельных желез или их обрывков. Этот тип секреции чаще встречается в высокодифференцированных слизеобразующих аденокарциномах. При другом типе секреции слизь накапливается в цитоплазме раковых клеток, смещая их ядро, с образованием т.н. перстневидных раковых клеток. Этот тип секреции чаще наблюдается в низкодифференцированных аденокарциномах. Нередко имеется сочетание внеклеточной и внутриклеточной продукции слизи. Возможна продукция слизи, которая скапливается в цитоплазме с образованием перстневидных клеток или располагается вне клеток в строме; часто оба вида секреции сочетаются. Опухоли, состоящие преимущественно из перстневидных клеток, выделяют в отдельную группу – перстневидно-клеточный рак. Эти опухоли представлены изолированными, не связанными между собой клетками, содержащими в цитоплазме массу слизи (муцин, мукоид или их смесь). Ядро клетки обычно расположено эксцентрично, часто выглядит пикнотичным, но может располагаться и в центре клетки.
В данном случае раковые клетки муцинозной аденокарциномы поразили костный мозг больного, который способствует кроветворению (рис. 6). Ввиду депрессии костного мозга на фоне ХПН и миелокарциноза у больного наблюдалась резко выраженная анемия. Hb – 37 г/л, тромбоцитопения 36×10'9/L. Патологический перелом L4, вызванный поражением структуры позвонка метастазами аденокарциномы, вызывал сильнейшие боли при движении.
Сообщения о развитии второго синхронного рака, не связанного с первым после трансплантации, крайне редки. В исследовании E. Taioli еt al. показано, что риск развития синхронного рака после трансплантации почки статистически не более значим, чем у больных в общей популяции. Из 7636 больных после пересадки солидных органов (почки, сердце, легкие, печень) первичный рак диагностирован у 499 больных, из них у 22 зафиксировано развитие второго рака. Авторы указывают, что, несмотря на длительный прием иммуносупрессантов, нет зависимости развития второго рака от возникновения первого [32]. Кроме того, опыт Michele L et al. вместе с тщательным обзором литературы не подтверждает гипотезу о том, что у больных с ослабленным иммунитетом более часто развивается синхронный рак. Причины этого авторы видят в том, что больные часто не доживают до развития второго рака или больные возвращаются к заместительной почечной терапии, прерывая иммуносупрессивную терапию, тем самым ограничивая воздействие онкогенных эффектов таких препаратов по времени. Трудно найти больных, которые после диагностики рака и успешного лечения принимают ту же иммуносупрессию без изменения дозировок или смены иммуносупрессантов [31].
Однако все же нельзя с большой уверенностью утверждать, что именно иммуносупрессия может вызывать синхронный рак у больного с ослабленным иммунитетом после трансплантации. Как правило, возникающий синхронный рак и поражает один и тот же орган или ткань. Кожа является самым поражаемым органом, а именно – возникновение саркомы Капоши. Авторы считают, что при возникновении синхронного рака необходимо, если это возможно, приостановить лечение иммунодепрессантами или перейти на лечение ингибиторами m-TOR. Кроме того, для предотвращения развития рака у потенциальных больных нефротрансплантатом должны проводиться меры профилактики против онковирусных инфекций (вакцинация), снижение воздействия экологических онкогенных факторов (наркотики, курение, алкоголь, солнце), ежегодное обследование этих больных и, что очень важно, попытаться уменьшить дозировки иммуносупрессоров, не подвергая больного риску отторжения трансплантата.
Ранняя диагностика опухоли в трансплантате является основным условием для возможной органосохраняющей операции с хорошим результатом. В настоящее время УЗИ – самый простой и доступный метод ранней диагностики изменений и в трансплантате, и в других органах. Поражение трансплантата раком в стадии pTI М0 N0 позволяет удалять раковую опухоль и выполнять органосохраняющую операцию трансплантата с последующей хорошей функцией пересаженной почки [33]. Более короткие интервалы ультразвукового скрининга могут способствовать раннему выявлению опухоли и повышать шанс на успешные органосохраняющие операции, сохранять жизнь больному [34, 35]. Для подтверждения диагноза и исключения метастазирования опухоли рекомендуются рентгеновская компьютерная томография (РКТ) с контрастированием или магнитно-резонансная томография. Если диагноз остается неясным после проведения визуализационных исследований, выполняется тонкоигольная аспирационная биопсия под ультразвуковым или РКТ-наведением, хотя не все авторы признают диагностическую ценность и безопасность этого метода у реципиентов РТ [36].
В дальнейшем для данной категории реципиентов могут быть произведены изменения иммуносупрессивной терапии, поскольку применение ингибиторов m-TOR позволяет снижать частоту возникновения злокачественных образований, в связи с чем могут быть снижены дозы иммуносупрессивных препаратов [37]. Отмена Циклоспорина А или существенное снижение его дозы в сочетании с назначением ингибиторов m-TOR позволяет большинству реципиентов ренального трансплантата, имеющих в анамнезе опухолевое поражение почек, добиваться нераспространения опухолевого процесса. Положительную роль играет как отмена Циклоспорина А, так и собственное противоопухолевое действие ингибиторов m-TOR, которым обладает сиролимус и его производное – эверолимус. Уже доказан существенный положительный эффект применения этих препаратов при пострансплантационной саркоме Капоши: конверсия на ингибиторы m-TOR приводит к полному регрессу опухоли [38].
Пациенты с опухолью в трансплантате встречаются редко, однако в данном случае на кону стоит не только онкологический результат, но и функция пересаженного органа. Следование онкологическим клиническим рекомендациям и выполнение органосохраняющего оперативного вмешательства – оптимальный подход, имеющий потенциал для решения обеих дилемм. Лечение опухолей в трансплантате должно проводиться согласно имеющимся рекомендациям по лечению рака почки, и при небольших размерах предпочтение должно отдаваться резекции, которая обеспечивает оптимальный баланс между онкологическим результатом и сохранением почечной функции.



