Введение
Хроническая болезнь почек (ХБП) является серьезной проблемой здравоохранения в мире. Распространенность ХБП достаточно велика: например, в западных популяциях составляет 10–15% [1]. ХБП охватывает все возрастные группы пациентов: от молодых пациентов, чаще имеющих только одно заболевание сопряженное с ХБП, до коморбидных и полиморбидных пациентов старших возрастных групп, хрупких пациентов, пациентов с саркопенией. И наибольшая распространенность ХБП выявлена у пожилых пациентов, что связано не только с возрастом, но и, по всей видимости, с хроническим воспалением и гипоксий, участвующих в патофизиологическом механизме многих хронических заболеваний (ХБП, хроническая сердечная недостаточность [ХСН], саркопения и пр.) [2].
Известно, что «естественное старение» приводит к постепенному стойкому снижению СКФ за счет ишемии в перфузионных зонах клубочковых и перитубулярных зонах капиллярных сетей (необратимые изменения), а также к альбуминурии из-за снижения реабсорбции и/или деградации альбумина в проксимальном отделе (обратимые изменения), что является предиктором прогрессирования ХБП. Распространенность на ранних стадиях ХБП плохо изучена и колеблется от 5 до 9% и достигает 37% при терминальной стадии ХБП. Наличие саркопении у пациентов с ХБП коррелирует с большей заболеваемостью и смертностью, особенно вследствие увеличения сердечно-сосудистых осложнений [7, 8].
Сердечно-сосудистые заболевания широко изучены и достаточно распространены у пациентов с ХБП [9, 10]. Данные, полученные в результате обсервационных исследований, регистрируют высокую смертность пациентов с ХБП вследствие сердечно-сосудистых осложнений [11–13].
К основным причинам смертности пациентов с ХБП относятся такие заболевания, как ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность (ХСН) и аритмии [14]. Также изучено и доказано негативное влияние на развитие сердечно-сосудистых событий изменения уровня СКФ у пациентов с ХБП [15].
Известно, что ХБП может выступать в роли как причины, так и следствия сердечно-сосудистых событий. Роль саркопении для пациентов с ХБП остается не до конца неизученной.
Целью исследования стало изучение прогностической роли саркопении у пациентов с ХБП.
Материалы и методы
Структура исследования
Исследование проведено в соответствии с правилами ICH GCP на базе ГБУЗ «ГП № 6 ДЗМ». Длительность исследования составила 3 года (2016–2018). В течение месяца было проанализировано 1000 амбулаторных карт пациентов в возрасте 50 лет и старше, имевших сердечно-сосудистые заболевания и обратившихся на прием к врачу-терапевту/ВОП, вне зависимости от цели обращения, из них отобрано 337 карт с верифицированным диагнозом ХБП. В дальнейшем участвовать в исследовании согласились 115 пациентов, соответствовали критериям включения и исключения только 79 из них (табл. 1).

Методы обследования
Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) в соответствии с Национальными рекомендациями по ХБП [16].
Верифицировали диагноз ХБП в соответствии с рекомендациями KDIGO [17]:
- наличие любых клинических маркеров повреждения почек, подтвержденных дважды (временной интервал между исследованиями не менее 3 месяцев);
- выявленное снижение СКФ (>60 мл/мин/1,73 м2), альбуминурия или любые другие клинические маркеры повреждения почки подтверждены на протяжении 3 месяцев;
- СКФ сохраняется <60 мл/мин/1,73 м2 вне зависимости от динамики других маркеров;
- диагностированы необратимые маркеры (признаки) структурных изменений почки при прижизненном морфологическом исследовании или лучевой визуализации.
Наблюдение за пациентами проводилось в течение 3 лет, были оценены конечные точки и прогрессирование ХБП. Прогрессированием ХБП считали увеличение стадии ХБП в течение года, конечными точками – наличие любого сердечно-сосудистые события, в т.ч. коронарного вмешательства, и/или смерть пациента.
Верифицировали диагноз ХСН в соответствии с национальными рекомендациями [18].
С целью анализа внутренних сред организма (процентное соотношение воды, мышечной и жировой ткани) проводилась биоимпедансметрия (биоимпедансметр с программным обеспечением ABC-02 «Медасс»).
По величине реактивной составляющей импеданса рассчитывалась величина основного обмена.
Верификация диагноза саркопении в соответствии с рекомендациями EWGSOP [19]:
Низкая мышечная масса.
Снижение индекса массы скелетной мускулатуры (ИМСМ) для женщин ≤6,76 кг/м2, для мужчин ≤10,76 кг/м2.
ИМСМ=общая масса скелетной мускулатуры тела (кг)/ рост2 (м) по данным биоимпедансометрии.
Низкая мышечная сила.
Снижение силы хвата кисти для мужчин <30 кг, для женщин <20 кг по данным динамометрии (электронный динамометр Camry EH101).
Уровень ИЛ-1в, -6, -8, -10, -18, NTproBNP определяли в плазме крови с помощью ИФА наборов производства Bender Med-Systems.
Методы статистической обработки материалов
Для статистической обработки полученных данных использовали язык R-программное обеспечение RStudio (пакеты psych, epiR, ggplot2, dplyr). Нормальность распределения определялась с помощью критерия Шапиро–Уилка и критерий Колмогорова–Смирнова. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M)±стандартное отклонение (S) или медиана, 25-й и 75-й процентили. Для сравнения групп применялся t-критерий Стьюдента при правильном распределении, критерий Вилкоксона при неправильном. Для сравнения результатов между независимыми выборками применяли критерий Манна–Уитни, для сравнения бинарных распределений использовался χ-квадрат Пирсона. Для изучения влияния одного или нескольких факторов на рассматриваемый признак проводилось построение логистического регресса, расчет отношения рисков, отношения шансов, а также использовалось построение линейного регресса для непрерывных переменных. При проверке статистических гипотез нулевую гипотезу отвергали при уровне значимости менее 0,05.
Результаты
Клиническая характеристика пациентов представлена в табл. 2. Численность исследуемой группы составила 79 пациентов, из них оказалось только 18 мужчин. Средний возраст пациентов составил 74,97±8,27 года. Ожирение имело 35 (44,3%) пациентов, из них 19 имели абдоминальное ожирение. По данным листа уточненных диагнозов, стабильную стенокардию в анамнезе имели 45 (57%) пациентов, ПИКС – 37 (46,8%), ОНМК – 14 (17,7%), сахарный диабет – 32 (40,5%), фибрилляцию предсердий – 11 (13,9%) пациентов, из них пароксизмальную форму имели 6 пациентов, постоянную форму – 5 пациентов. Полученные данные уровня NTproBNP позволили подтвердить наличие ХСН у 27 (34,2%) пациентов.
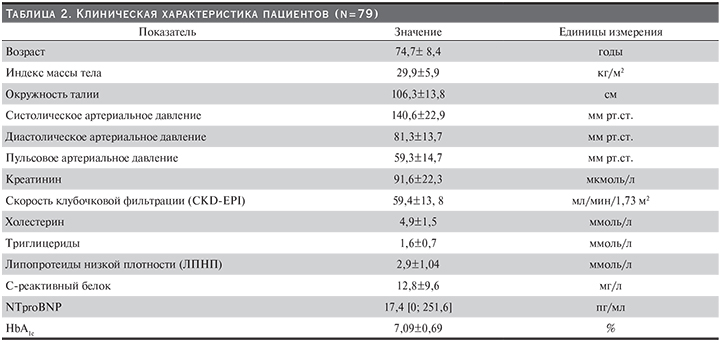
Изучение стадии ХБП у исследуемой группы пациентов показало, что 2 (2,5%) имели ХБП С1, ХБП С2 – 40 (50,6%) пациентов, ХБП С3а – 26 (32,9%) , ХБП С3б – 9 (11,4%), ХБП С4 – 2 (2,5%) пациента.
У 32 (40,5%) пациентов было выявлено увеличение стадии ХБП (прогрессирвание), из них 16 (20,3%) пациентов имели саркопению. Была выявлена прямая обратная достоверная взаимосвязь прогрессирования ХБП и наличия у пациентов саркопении (p-value: 0,043): у пациентов с саркопенией в 2,62 раза возрастает шанс (OR=2,62; 95% ДИ [1,02; 6,71]) и увеличивается риск в 1,72 раза (RR=1,72; 95% ДИ х1,02; 2,90]) прогрессирования ХБП в течение года; так же как у пациентов с прогрессированием ХБП в течение года в 2,62 раза возрастает шанс (OR=2,62; 95% ДИ [1,02;6,71]) и увеличивается риск в 1,81 раза (RR=1,81 95% ДИ [1,01; 3,22]) развития саркопении.
В течение периода наблюдения было зарегистрировано 23 конечные точки, из них у 16 пациентов выявлены такие факторы риска сердечно-сосудистых событий и смерти, как ХСН и/или саркопения (табл. 3). Изучение риска возникновения конечных точек у данной когорты пациентов свидетельствует о наличии прямой связи между наличием ХСН, саркопении и ХСН+саркопении у пациентов с ХБП и риском возникновения конечных точек, однако статистической значимости не получено (p>0,05).
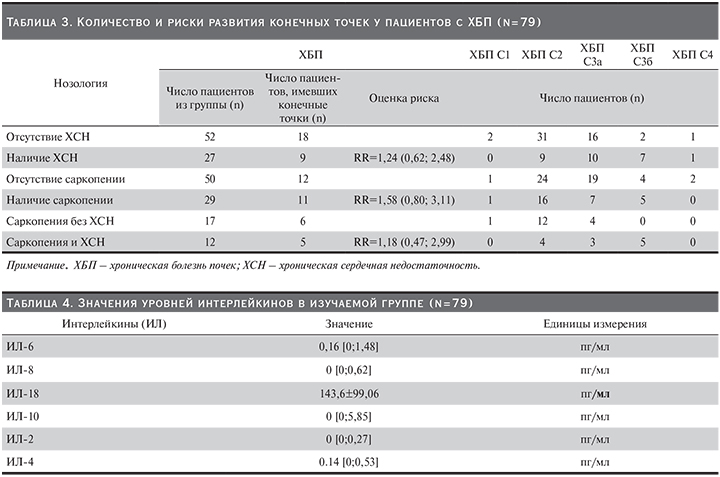
Изучение уровня интерлейкинов (табл. 4) позволило подтвердить наличие воспаления у изучаемой группы и выделить среди всех провоспалительных цитокинов значимое повышение уровня ИЛ-18, превышающего референсные значения в 2 раза. У пациентов с саркопенией наблюдалась тенденция повышения уровня ИЛ-18 и -6 и снижение уровня противовоспалительного цитокина ИЛ-10. Тем не менее не было выявлено различий в уровнях ИЛ-18 и-6 у пациентов с саркопенией и без.
С учетом выявления у изучаемой когорты пациентов предикторов (саркопения, воспаление), которые, возможно, вносят особый склад в развитие сердечно-сосудистых событий и смерти, была построена модель линейного регреса (рис. 1), позволяющая изучить зависимость между факторами. В первично построенную модель были включены все непрерывные переменные, наибольшую статистическую значимость продемонстрировали уровни ИЛ-18 и-6, в дальнейшем была построена модель зависимости уровня ИЛ-18 от-6, уровень достоверности модели r2=0,28 p=0,001. При среднем уровне значения log ИЛ-18, равном 4,7, его увеличение на 1 приводит к увеличению log ИЛ-6 на 0,23.

Стоит отметить, что наилучшим образом полученная линейная модель описывает данные для группы пациентов без наличия конечных точек, при этом пациенты с саркопенией следует скорее всего отнести к выбросам, исходя из расположения на графики. Более интересным представляется то, что у пациентов с конечными точками наблюдается обратная зависимость в отношении уровней ИЛ-18 и-6, однако легко заметить, что у пациентов, имевших конечные точки и саркопению, были выявлены нулевые значения противовоспалительного ИЛ-10, в отличие от тех, кто не имел неблагоприятных исходов. Таким образом можно заключить, что для пациентов с ХБП и саркопенией большее прогностическое значение, по-видимому, оказывает противовоспалительная система интерлейкинов.
Для проверки значимости влияния уровня интерлейкинов на конечные точки была построена логит-регрессионная модель. Наилучшим образом оказали влияние на модель уровни Log ИЛ-18 и ИЛ-6, наиболее значимым оказалось влияние ИЛ-18 (p=0,0496). При расчете коэффициентов модели были получены значения отношения шансов для всех включенных переменных Log ИЛ-18 OR=5,76 95% ДИ (1,2; 44,2); Log ИЛ-6 OR=1,39 ДИ (0,66; 3,12). Таким образом, эта модель подтверждает данные, полученные в предыдущем анализе: на риск возникновения изучаемых конечных точек наибольшим образом оказывает влияние уровень только одного провосполительного интерлейкина: ИЛ-18. Риск развития конечных точек повышается в 5,76 раза при наличии у пациентов с ХБП высокого уровня ИЛ-18.
Обсуждение
Значительная доля случаев ХБП встречается среди пожилых людей, учитывая увеличивающийся процент пожилых людей в популяции, появляется необходимость понимания процессов, происходящих с возрастом [20]. Одним из них является саркопения – многофакторный синдром со сложным патогенезом, связанный с хроническими заболеваниями, активацией медиаторов воспаления, отсутствием/снижением физической активности, митохондриальной дисфункцией, нервно-мышечной дисфункцией, уменьшением количества сателлитных клеток и гормональными изменениями [8].
Саркопения является широко распространенной проблемой пациентов с ХБП и встречается на всех ее стадиях [8, 21, 22]. ХБП часто называют моделью «ускоренного старения» и, следовательно, представляет большой интерес влияние ХБП и его прогрессирование на саркопению и развитие сердечно-сосудистых событий и смертности. Zhou Y. et al., в рамках исследования RENEXC, изучая взаимосвязь саркопении и снижения СКФ, продемонстрировали четкую связь между прогрессированием саркопении и увеличением стадии ХБП. Проведенное нами исследование показало, что самостоятельного значения снижение скорости СКФ не имеет в отношении прогрессирования саркопении, тогда как снижение СКФ в течение года (прогрессирование ХБП) демонстрирует прямую обратную достоверную взаимосвязь с прогрессированием саркопении (p-value: 0,043) [23, 24].
Принят во внимание тот факт, что прогрессирование этих процессов, возможно, потенцировано, в частности, воспалением. Известно, что ИЛ-1, -6, -8 и другие цитокины определяют развитие воспалительного процесса, являясь провоспалительными цитокинами, т.н. маркерами воспаления. IL-6 инициирует эндотелиальное повреждение, главным образом путем снижения экспрессии эндотелиальной синтазы оксида азота (eNOS) и адипонектина (антиатерогенного адипокина) [25]. Также повышенный уровень ИЛ-6 не только является следствием ХБП, но, что более важно, он служит пусковым механизмом для развития и прогрессирования ХБП и связанных с ним осложнений, особенно сердечно-сосудистых. Клетки почек, включая подоциты, эндотелиальные клетки, мезангиальные клетки и эпителиальные клетки канальцев (TECs), могут секретировать IL-6 в определенных условиях [26]. Pecoits-Filho и et al. провели анализ взаимосвязи между уровнем воспаления и СКФ у пациентов с ХБП и выявили отрицательные корреляции между СКФ и ИЛ-6 (rho=-0,18; p<0,05) [27]. Авторы показали, что сама по себе низкая СКФ связана с воспалительным процессом, что в свою очередь свидетельствует о нарушении почечной элиминации провоспалительных цитокинов. Также стоит отметить роль ИЛ-18 в повреждении почек, которое также является фактором высокого риска прогрессирования ХБП и сердечно-сосудистых осложнений [28].
Высокие значения уровня ИЛ-18 служат предиктором развития неблагоприятных сердечно-сосудистых событий для пациентов с ХБП и определяют прогностическую значимость для пациентов, находящихся на гемодиализе [29]. Formanowicz et al. в своем исследовании показали наличие тесной взаимосвязи между ИЛ-18, ХБП и сердечно-сосудистыми событиями [30]. Также результаты исследования позволили сделать вывод о значительном влиянии на сигнальные пути ИЛ-18: повышение концентрации IL-18 в сыворотке крови выше порога 1584,5 пг/мл характеризовалось повышением риска смерти от сердечно-сосудистых событий у пациентов с ХБП в 20,63 раза.
Проведенное нами исследование подтверждает высокий уровень воспаления у пациентов с ХБП, однако обращает на себя внимание чрезвычайно высокие значения именно уровня ИЛ-18 (143,6±99,06 пг/мл), в разы превышающие референсные значения, что позволяет думать о возможном прогрессировании ХБП, о чем свидетельствуют полученные данные: у 40,5% пациентов было выявлено прогрессирование ХБП, стоит отметить, что у половины из них (20,3%) была выявлена саркопения. Нами получена прямая обратная достоверная взаимосвязь прогрессирования ХБП и наличия у пациентов саркопении (p-value: 0,043). Риск прогрессирования ХБП у пациентов с саркопенией увеличивается почти в 2 раза (RR=1,72 95% ДИ [1,02; 2,90]), так же как и увеличивается риск развития саркопении у пациентов с прогрессированием ХБП в 2 раза (RR=1,81 95% ДИ (1,01; 3,22). Системный обзор, проведенный Hirai et al., также подтверждает синергическое прогрессирование саркопении и ХБП, а также, что наличие саркопении у пациентов с ХБП служит предиктором смертности в этой группе [31].
Таким образом, фактически провоспалительные цитокины, происходящие из макрофагов (IL-1, -6 и др.), играют ключевую роль в индукции метаболических изменений, связанных со многими патофизиологическими условиями не только иммунными и воспалительными реакциями, но и в развитии саркопении. В литературе хорошо описано, что окислительный стресс и повышенные уровни медиаторов воспаления являются двумя возможными механизмами, способствующими патогенезу саркопении [32]. Так, повышенные уровни воспалительных цитокинов, таких как ИЛ-6, TNF-альфа, а также hsCRP, связаны с саркопенией как в общей популяции, так и у пациентов с ХБП [33–36]. Данные нашего исследования демонстрируют повышение уровня ИЛ-6, -18 у изучаемой когорты пациентов с ХБП, однако четких статистических различий у пациентов с саркопенией и без по отношению к уровню интерлейкинов найдено не было. В 2016 г. Bano et al. провели мета-анализ перекрестных исследований, сравнивших сывороточные уровни воспалительных цитокинов у пациентов с и без саркопении (3072 пациентов с саркопенией и 8177 без саркопении) [37].
У пациентов с саркопенией выявлены значительно более высокие уровни hsCRP (SMD=0,51; 95% ДИ: 0,26, 0,77; р<0,0001; I2=96%) по сравнению с контрольной группой, тогда как уровни TNF-α в сыворотке не имели значимых различий в группах (SMD = 0,28; 95% ДИ: -0,26, 0,83; p=0,31; I2=97%), так же как и уровни ИЛ-6 в сыворотке не имели ожидаемых значимых различий в группах (SMD=0,35; 95% ДИ: -0,19, 0,89; p=0,21; I2=97%).
Исследование de Souza et al. показало, что у пациентов с саркопенией наблюдалась тенденция к более высоким уровням hsCRP и более низким уровням противовоспалительного цитокина ИЛ-4, однако различий в уровнях ИЛ-6 также между группами получено не было [22]. Таким образом, стоит отметить важность баланса между про- и противовоспалительными цитокинами (ИЛ-1ra, -4, -10 и др.), является ключевым для регуляции многих биохимических процессов. Полученные нами данные не дали достоверных результатов в отношении уровня ИЛ-4, тогда как уровень ИЛ-10 достоверно различался у пациентов и имел решающее значение в построенной линейной модели регрессf, влияя на частоту развития сердечно-сосудистых событий и смертности: все пациенты с ХБП, саркопенией и нулевым уровнем ИЛ-10 имели конечные точки, в отличие от пациентов с высоким уровнем ИЛ-10. Изучено повышение распространенности сердечно-сосудистых осложнений (в частности, ХСН) у пациентов с ХБП и СКФ <60 мл/мин, по некоторым данным, частота возникновения неблагоприятных исходов более чем в 2 раза выше, чем у пациентов без ХБП [38–41].
В исследовании Hanatani et al. было показано, что саркопения может выступать в качестве независимого предиктора развития сердечно-сосудистых событий и смерти, особенно у пациентов высокого уровня BNP (p<0,0001), что доказывает проведенный авторами многофакторный анализ рисков Кокса RR: 3,04, 95% ДИ: 1,45–6,38; р=0,003) [42]. Однако наше исследование не дало статистически значимых подтверждений влияния ХСН как дополнительного фактора риска развития неблагоприятных исходов у пациентов с ХБП (RR=1,24; ДИ: 0,62, 2,48). Наши данные позволили определить ИЛ-18 как значимый предиктор (p=0,0496) развития изучаемых конечных точек: Риск развития конечных точек повышается в 5,76 раза при наличии у пациентов с ХБП высокого уровня ИЛ-18.
Выводы
Результаты исследования демонстрируют, что достаточно трудно выявить влияние одного конкретного фактора на общий повышенный риск сердечно-сосудистой событий и смертности у пациентов с ХБП и саркопенией. Однако значительная роль принадлежит цитокинам, в частности равновесию между про- и противовоспалительными цитокинами. Также стоит отметить роль нарастания уровня воспаления в течение года, что в свою очередь увеличивает риск как прогрессирования саркопении и ХБП, так и развития сердечно-сосудистых событий и смерти.
Ограничения исследования
Наше исследование имеет некоторые ограничения: небольшой размер выборки; оценка СКФ проводилась расчетным методом с использованием формулы CKD-EPI на основе креатинина сыворотки, на уровень которого могло повлиять изменение мышечной ткани, связанное с саркопенией; достаточно многочисленные критерии исключения, что, вероятно, могло привести к смещению выбора и недооценке распространенности саркопении.



