Синдром Гудпасчера (СГ) – редкое аутоиммунное органоспецифическое заболевание, характеризующееся клиническими проявлениями в виде сочетания быстропрогрессирующего гломерулонефрита (БПГН) с легочными кровотечениями и наличием антител к базальной мембране клубочков почек (аБМК) [1].
Заболеваемость СГ у взрослых составляет 0,5–1 на 1 млн в год, у детей заболевание наблюдается еще реже [2, 3].
В литературе рассматриваются данные о генетической предрасположенности к развитию заболевания. В качестве факторов, определяющих генетическую предрасположенность к СГ, рассматривают изменения в системе гистосовместимости. Есть предположение, будто СГ ассоциирован с HLA-DR15, DRB1 (1501), DRB1(1502) [4, 5]. Считают, что к возможным предрасполагающим факторам в развитии заболевания относятся курение, воздействие углеводородов и пыли с высоким содержанием металлов, острые респираторные инфекции, в частности грипп, использование кокаина, а также терапия, подавляющая лимфоцитарный росток кроветворения [6, 7].
У большинства пациентов с СГ объектом для анти-БМК является мономерная субъединица с молекулярной массой 28 кд, расположенная в домене NC1, присутствующем в α-3-цепи коллагена IV типа [8, 9]. Поскольку в качестве мишени анти-БМК-антител выступает α-3-цепь коллагена IV типа, обсуждается значение мутаций в кодирующем ее гене [10]. Дальнейшее изучение генетических детерминант СГ необходимо прежде всего с точки зрения поиска закономерностей формирования предрасположенности к реакциям аутоиммунитета, нередко реализующейся в виде угрожающих жизни системных заболеваний [11]. Два различающихся по конформации эпитопа анти-БМК были определены на остатках 17-31 и 127-141 данного домена и были названы EA и EB соответственно. Несмотря на повсеместное наличие базальных мембран, клинически значимое поражение наблюдается только в альвеолах и клубочках. Считается, что это связано с большей доступностью, а также с более высоким уровнем синтеза α-3-цепей коллагена [12].
Другой особенностью альвеолярной и клубочковой мембран является их структурная связанность с α-3-цепями коллагена, что облегчает доступ для антител извне [13–16]. Показано, что в формировании тканевого повреждения при СГ существенную роль играют Т-лимфоциты. Продемонстрировано значительное нарастание в периферической крови в острую фазу заболевания числа CD4+-Т-лимфоцитов, распознающих NC-домен α-3-цепи коллагена IV типа, число которых существенно уменьшается в стадию ремиссии, а при прерывании обострения их число более значительно уменьшается [17, 18].
Развитие СГ может быть также обусловлено нарушениями регуляции экспрессии иммуноглобулина G (IgG), что подтверждается в исследовании, выполненном на животных с лабораторно воспроизведенным СГ, с отсутствующим Fc-гамма рецептором IIB, играющим центральную роль в контроле экспрессии IgG [19, 20].
Почечное поражение при СГ развивается при участии воспалительных металлопротеиназ, в частности металопротеназы-9, экспрессия которой в клубочке становится заметной уже в 1-е сутки заболевания и достигает максимума к 7-м суткам [13, 20].
Несмотря на редко встречающиеся единичные случаи СГ, разработаны и внедрены в методы лечения СГ, целью которых считается удаление из циркуляции аБМК с одновременным предотвращением их дальнейшего образования и подавление существующего тканевого воспаления. Считают, что всем пациентам с аБМК-гломерулонефритом (за исключением диализ-зависимых на момент установления диагноза, имеющих 100% полулуний, по данным адекватной нефробиопсии, при этом не имеющих легочных кровотечений), следует проводить иммуносупрессивную терапию с использованием циклофосфамида, высоких доз глюкокортикостероидов, плазмафереза [21]. Считают, что при легочном кровотечении следует проводить трансфузию свежезамороженной плазмы [22]. Также имеется опыт применения ритуксимаба больными СГ, что сопровождается значимым улучшением состояния [23]. Считают, что циклофосфамид особенно эффективен при угрожающих жизни легочных кровотечениях, а поражение почек нередко хуже поддается лечению иммунодепрессантами [21].
Кроме того, накоплен опыт применения при СГ селективной иммуносорбции. Во всех случаях успешного применения ее сочетали с активной иммуносупрессивной терапией [24]. Несколько десятилетий назад после проведенного многоцентрового исследования пациентов с СГ сравнивали эффективность плазмафереза и иммуносорбции между собой, число умерших в обеих группах и число пациентов, у которых исчезла необходимость в гемодиализе, не различались, что позволило сделать вывод о сопоставимой эффективности двух методов лечения [25].
Продолжают разрабатываться новые способы лечения СГ. Ряд исследователей применили микофенолата мофетил в лечении молодого пациента, у которого преднизолон в комбинации с циклофосфамидом, успешно купировавший первое обострение и впоследствии утративший свою эффективность, легочное кровотечение рецидивировало. Монотерапия микофенолата мофетилом поддерживала ремиссию поражения легких в течение одного года [26, 27], что обусловлено цитостатическим действием на лимфоциты, подавляя их пролиферацию и образование антител В-лимфоцитами. Ряд авторов в своих исследованиях обнаружили, что применение микофенолата мофетила позволяет добиваться значительного уменьшения протеинурии, выраженности гломерулосклероза, инфильтрации почечных клубочков макрофагами и экспрессии почечной тканью остеопонтина, являющегося одним из медиаторов фиброгенеза [28].
Публикации последних лет свидетельствую об активных разработках и использовании новых терапевтических стратегий [29]. В ряде исследований продемонстрировано, что содержащие дексаметазон липосомы, тропные к экспрессируемой гломерулярными эндотелиоцитами воспалительной молекуле адгезии Е-селектину, при анти-БМК-гломерулонефрите значительно уменьшают экспрессию почечной тканью комплекса адгезивных медиаторов – Р-селектина, Е-селектина и VCAM-1 [1, 21]. Во многом будущее в лечении СГ связывают с инновационными антихемокиновыми и антицитокиновыми препаратами, т.к. определено, что интенсивность макрофагальной инфильтрации и гломерулярного повреждения при СГ может быть уменьшена с помощью блокатора растворимого хемокина CXCL16, индуцирующего миграцию и адгезию клеток моноцитарного ряда [30]. Также в лабораторных условиях изучено противовоспалительное действие белка станниокальцина-1 [31].
Однако внедрению их в практику лечения должны предшествовать специально планируемые контролируемые клинические исследования. Так, например, установлено, что выраженность почечного процесса, в частности количество поврежденных подоцитов на ранней стадии аБМК-гломерулонефрита, может быть уменьшено путем применения блокатора рецепторов ангиотензина II кандесартана, блокатора трансформирующего фактора роста β пирфенидона и их комбинации [31]. Как известно, блокаторы рецепторов ангиотензина II назначают подавляющему большинству терапевтических, нефрологических и др. пациентов, однако в отношении больных СГ их использование требует тщательного мониторинга динамики креатининемии и калиемии, особенно у пациентов с выраженными нарушениями функции почек.
Отмечено, что примерно у трети пациентов с СГ наряду с высоким титром анти-БМК в крови определяют ANCA (антитела к миелопероксидазе, антитела к протеиназе-3), что, по мнению некоторых специалистов, не влияет на течение и прогноз заболевания [4].
Также известно, что у 5–14% больных АНЦА-(антинейтрофильные цитоплазматические антитела) определяют аБМК, у 30–43% больных аБМК выявляют АНЦА. Считают, что влияние двойной серопозитивности на прогноз и течение болезни остается спорным вопросом [32, 33].
АНЦА-ассоциированные васкулиты (АNCA-АВ) относили к достаточно редким заболеваниям, однако за последние десятилетия в мире отмечена тенденция к увеличению распространенности АNCA-АВ. Заболеваемость АNCA-АВ колеблется от 4 до 250 случаев на 100 тыс. населения в год. Пик заболеваемости приходится на 45–55 лет, мужчины болеют несколько чаще, чем женщины [34]. Наиболее распространенной нозологической формой, по мнению ведущих специалистов, является гранулематоз Вегенера [35].
Считают, что этиология системных васкулитов остается недостаточно изученной, но, видимо, как и большинство аутоиммунных заболеваний, они развиваются под воздействием факторов внешней среды у генетически предрасположенных лиц [36]. По мнению ведущих специалистов, пусковым моментом могут быть перенесенные вирусные и бактериальные инфекции, иммунная гиперчувствительность к некоторым лекарственным препаратам (антибактериальным, противовирусным, ингибиторам ангиотензинпревращающего фермента, аминазину и др.). Установлены специфичные иммунногенетические маркеры отдельных форм васкулитов [37; 38]. Так, один из перечисленных выше пусковых факторов может приводить к манифестации гранулематоза Вегенера у пациентов с HLA типа B7, B8, DR2. Диагностика и лечение этих редко встречающихся заболеваний в течение длительного времени представляли значительные трудности. Однако в 1985 г. были открыты АNCA-антитела (АNCA-АТ) – это семейство антител, реагирующих с различными компонентами первичных гранул цитоплазмы нейтрофилов, лизосом и моноцитов. Идентифицировано два различных образца свечения – цитоплазматическое, направленное против протеиназы 3 (PR-3 – с-АNCA), и миелопироксидазы (МРО – р-АNCA). АNCA-антитела выявляются в большинстве случаев (около 90%) активного васкулита (антитела к PR-3 или МРО). Недавно обнаружен еще одни тип аутоантител, направленных против лизосомального мембранного белка-2 (anti-LAMP-2), выявляемых у anti-PR3- и anti-MPO-позитивных пациентов с активным васкулитом. Аnti-LAMP-2 вызывают апоптоз эндотелиальных клеток микрососудистого русла и малоиммунный некротизирующий гломерулонефрит [39–41].
Классификации и рекомендации по диагностике и лечению системных васкулитов неоднократно пересматривались. Международной группой экспертов – членов Европейской антиревматической лиги (EULAR – European League Against Rheumatism), Европейской ассоциации по изучению болезней почек (ERA-EDTA – European Renal Association-European Dialysisand Transplant Association) и Европейского общества изучения васкулитов (EUVAS – European Vasculitis Society) проводилась масштабная работа, в итоге которой были согласованы и в начале 2016 г. опубликованы новые рекомендации по диагностике и лечению системных васкулитов (СВ), ассоциированных с АНЦА, к которым относят гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА) [42].
Повреждения сосудистой стенки – многофакторный и многоступенчатый процесс, достаточно обстоятельно описанный в научных статьях последних лет. В патологических реакциях при АНЦА-СВ участвуют различные типы клеток, в первую очередь нейтрофилы, Т-клетки и В-клетки, вместе с тем некоторые особенности их межклеточных взаимодействий до сих пор не расшифрованы [43–45].
Центральное значение в повреждении сосудистой стенки имеет индуцированная АНЦА-активация нейтрофилов с их дегрануляцией, высвобождением кислородных радикалов и протеолитических ферментов. Нейтрофилы служат источником фактора некроза опухоли α (ФНО-α), интерлейкина-8 (ИЛ-8), ИЛ-17, а также BLyS (В-лимфцитарный стимулятор), играющего фундаментальную роль в В-клеточной патологии. Дефекты апоптоза нейтрофилов способствуют хронизации АНЦА-СВ. Таким образом, классический нейтрофильный путь, вызывает некроз и воспаление сосудов. Т-клетки являются источником разнообразных цитокинов, играющих ключевую роль на всех этапах реализации сложных механизмов АНЦА-ассоциированного сосудистого повреждения [46]. Поэтому Т-клеточные реакции (прежде всего при участии Th1- и Th17-клеток) занимают центральное место в патогенезе гранулематозного воспаления и способствуют развитию некротизирующего васкулита. Считают, что Т-клеточный путь способен стимулировать продукцию антител В-клетками. Функциональный дефицит T-регуляторных клеток лежит в основе хронического аутоиммунного воспаления при АНЦА-СВ. Сами В-клетки играют важную роль в патогенезе АНЦА-АВ за счет синтеза ими АНЦА, в результате дифференцировки В-клеток образуются плазматические клетки, которые также продуцируют АНЦА. В-клетки являются источником цитокинов (ИЛ-6, ФНО-α, ИЛ-10), проявляют свойства антиген-презентирующих клеток, могут дифференцироваться в длительно живущие клетки памяти или, взаимодействуя с Т-клетками, нарушают баланс Т-хелперов/супрессоров [47–51].
В патогенезе некоторых АНЦА-СВ дополнительно большое значение имеет эозинофилия, которая поддерживается высоким уровнем ИЛ-5. Эозинофилы выделяют цитотоксические факторы, нейротоксичные и кардиотоксичные катионные белки, активные метаболиты кислорода и становятся центральным повреждающим фактором при их аккумуляции в тканях. Также эозинофилы служат источником цитокинов, хемокинов, лейкотриена С4, простагландина Е2 и проявляют свойства антиген-презентирующих клеток [52, 53].
В настоящее время используют разработанные схемы лекарственной патогенетической терапии, включающие введение глюкокортикоидных гормонов и цитостатиков. Кроме стандартной терапии этих тяжелых форм заболевания появились новые возможности в лечении пациентов с рефрактерным и рецидивирующим течением АНЦА-СВ.
В 2011 г. в Европе, а с 2013 г. в РФ официально зарегистрированы препараты нового класса, т.н. генно-инженерные биологические препараты (ритуксимаб – RTX), включенные в схемы лечения ANCA-АВ и предложенные в рекомендациях KDIGO (Kidney Disease: Improving Global Outcomes, 2012) в качестве альтернативы при противопоказаниях или высоких рисках лечения цитостатиками, плохой их переносимости, возникновении осложнений и при рефрактерных формах заболевания. Выполненные в последние годы многоцентровые исследования подтверждают эффективность этого препарата, также определены показания к его применению [54–59].
Известно, что большинство клинических проявлений системных аутоиммунных заболеваний связано с наличием антител и/или отложением иммунных комплексов, поэтому одним из важных компонентов лечения является использование методов очищения плазмы, применяемых в случаях АНЦА-СВ с тяжелой почечной недостаточностью или легочным кровотечением [60–63]. Например, терапевтический плазмаферез (ТРЕ; плазмообмен) достаточно эффективен, особенно в случаях сочетания АНЦА и антител к базальной мембране клубочков при применении даже на ранней стадии [64, 65].
Таким образом, традиционные подходы и новые разработки значительно расширили компетенции профильных специалистов в лечении пациентов с АНЦА-СВ и СГ. Однако при необходимости госпитализации пациентов с СГ и/или ГПА, находящихся в тяжелом или крайне тяжелом состоянии в связи с острой дыхательной недостаточностью (кровохарканье, легочное кровотечение) и ОПП (острое повреждение почек) в отделение реанимации, минуя приемное отделение, определены единые (стартовые) подходы к лечению этих пациентов.
На наш взгляд, кратко следует изложить данные, предшествовавшие манифестации основного заболевания, представляющие значительный интерес.
Клинический пример
В 1985 г. в возрасте 1 года и 3 месяцев у пациентки выявили активный пиелонефрит. Диагностирована аномалия развития мочевых путей: пояснично-крестцовая дистопия и ротация правой почки. Длительное время наблюдалась и, видимо, получала соответствующее лечение по поводу хронического пиелонефрита и нейрогенного мочевого пузыря (информация не предоставлена). В 1998 г. в 14 лет выявлены сцинтиграфические признаки умеренно опущенной деформированной правой почки. В 2003 г. (19 лет) – сцинтиграфические признаки тяжелой степени нарушения накопительно-выделительной функции правой почки. В 2016 г., по данным селективной ангиографии почек: дистопия правой почки, артериальное кровоснабжение представлено 5 артериями, КТ-признаки анатомического варианта кровоснабжения. В связи с бесплодием перенесла безрезультатно две экстракорпоральных оплодотворения. В 2017 г. наступила самостоятельная беременность, которая протекала (со слов родственников) без патологии, родоразрешение в срок.
В августе 2018 г. появились периодические боли в крупных суставах, кашель, боль в горле, эпизоды повышения температуры тела, резь в глазах (связывала с ношением линз). Лечения не получала. В связи с затруднением носового дыхания была выполнена КТ гайморовых пазух, выявлены изменения (документы не представлены). Со слов пациентки, отмечались корочки на слизистой оболочке носовой полости, после удаления которых отмечалась кровоточивость. В конце 2018 г. появились отеки нижних конечностей. С середины марта 2019 г. отметила ухудшение состояния, появились выраженные отеки нижних конечностей, слабость, одышка, субфебрильная температура, в связи с чем самостоятельно обратилась в медицинское учреждение для проведения необходимых исследований.
Пациентка К. 34 лет 04.04.2019 обратилась в ГБУЗ «ГКБ им. С.С. Юдина» ДЗМ, где по представленным результатам лабораторных исследований: повышение уровней креатинина до 790 мкмоль/л (в январе 2019 г. 90 мкмоль/л), мочевой кислоты до 480 мкмоль/л, антистрептолизин О 314,5 ЕД/мл, паратиреоидный гормон – 260,8 пг/мл, анемия (гемоглобин – 67 г/л), протеинурия – 1,34 г/л., в связи с уремией проведен сеанс гемодиализа, после чего отмечено кровохарканье, наросла дыхательная недостаточность и в отделении реанимации 05.04.2019 переведена на искусственную вентиляцию легких (ИВЛ). Лабораторно: АТ к БМК – 28 (N менее 20), антинуклеарный фактор (АНФ) – 2,1 (N до 1,) за счет повышение Scl 70, С3 – 71 (N 90–180), АТ к МПО обнаружено. Проведен сеанс двойной каскадной плазма-фильтрации – КПФ, после которого проведена пульс-терапия: метипред 1000 мг (06.04.2019, 07.04.2019, 08.04.2019), пульс-терапия: эндоксан 600 мг (07.04 2019 или 08.04.2019). Далее проведено 3 процедуры КПФ и гемодиафильтрации (ГДФ); 09.04.2019 выполнена трахеостомия; антибактериальная терапия: имипенем/циластатин 500 мг 2 раза в сутки. Для продолжения лечения 10.04.2019 была переведена в ОРИТ № 2 ГКБ № 52 бригадой ЦЭМП (Центр экстренной медицинской помощи).
В отделение реанимации ГКБ 52 поступила 10.04.2019. При поступлении состояние крайне тяжелое, уровень сознания – медикаментозная седация (пропофол), 5–6 по Ramsey, SOFA 10 баллов.
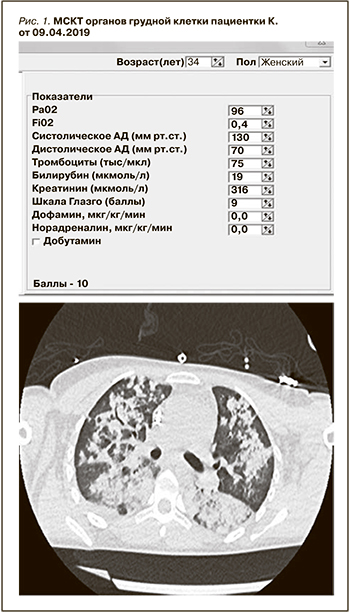 ИВЛ проводили через трахеостомическую трубку в режиме VCV: ДО 475 vл, ЧД – 14 в минуту, FiO2 40%, SpO2 96%. Аускультативно выслушивается жесткое дыхание, ослабленное над всеми отделами легких, хрипы отчетливо не выслушиваются. При санации небольшое количество слизисто-геморрагического отделяемого. По данным из представленных документов ГКБ им. С.С. Юдина ДЗМ известно, что 09.04.2019 проведено исследование органов грудной клетки (рис. 1).
ИВЛ проводили через трахеостомическую трубку в режиме VCV: ДО 475 vл, ЧД – 14 в минуту, FiO2 40%, SpO2 96%. Аускультативно выслушивается жесткое дыхание, ослабленное над всеми отделами легких, хрипы отчетливо не выслушиваются. При санации небольшое количество слизисто-геморрагического отделяемого. По данным из представленных документов ГКБ им. С.С. Юдина ДЗМ известно, что 09.04.2019 проведено исследование органов грудной клетки (рис. 1).
Заключение: КТ-картина обширного острого альвеолярного повреждения легких (наиболее вероятно – легочные кровоизлияния) с признаками начальной резорбции геморрагий, малое количество патологического пристеночного субстрата в трахее и главных бронхах. При пересмотре КТ от 09.04.2019 выявлен вдавленный перелом рукоятки грудины.
Тоны сердца приглушены, ритм правильный, ЧСС – 94 в минуту, АД – 115/80 мм рт.ст. Живот увеличен в объеме, мягкий, на пальпацию не реагирует, перистальтика выслушивается, ослабленная. Печень и селезенка не пальпируются. Поясничная область не изменена, на пальпацию не реагирует. По назогастральному зонду – застойное отделяемое. Мочеиспускание по уретральному катетеру, моча мутная с буроватым оттенком.
Лабораторные исследования: гемоглобин – 91 г/л, гематокрит – 25,3%, тромбоциты – 75 тыс/мкл, лейкоциты – 9,5 тыс/мл, общий белок – 46,6 г/л, альбумин – 27,3 г/л, мочевина – 20,3 ммоль/л, креатинин– 316 мкмоль/л, билирубин – 19,2 мкмоль/л, АСТ – 8,3 ЕД/л, АЛТ – 7,4 ЕД/л, ГГТ– 60,4 ЕД/л, ЩФ – 124 ЕД/л, ЛДГ – 811 ЕД/л, амилаза – 9,3 ЕД/л, холестерин – 3,07 ммоль/л, рН – 7,389, рО2 – 155 мм рт.ст., ИО – 390; КФК – 214,7 ЕД/л, триглицериды – 4,04 ммоль/л, ЛПВП – 0,45 ммоль/л, ЛПНП – 1,79 ммоль/л, С-реактивный белок (СРБ) – 90,89 мг/л. АНФ – 6,7, АТ к МПО – 66,5 (N 0–20), С3 – 42 (N 90–170), С4 – 8 (N 10–40).
С учетом легочно-почечного синдрома, серологических маркеров выставлен диагноз «ANCA-ассоциированный васкулит в сочетании с СГ».
10.04.2019 проведен консилиум. Заключение: в настоящее время тяжесть состояния обусловлена полиорганной недостаточностью, в рамках сочетанного системного заболевания СГ и АNCA васкулита с поражением жизненно важных органов легких, почек, требующих продолжения ИВЛ, заместительной почечной терапии, патогенетической иммуносупрессивной терапии, на фоне предшествовавшего заболевания почек (аномалия развития почек). Состояние после состоявшегося легочного кровотечения. Двусторонняя пневмония. Дыхательная недостаточность – 3-й ст.
План лечения. В качестве усиления патогенетической терапии в условиях геморрагического пневмонита, БПГН показано проведение высокообъемного плазмаобмена (TPE – Therapeutic Рlasma Еxchange) с объемом замещения 2,5 л, с введением метилпреднизолона 125 мг до и 250 мг после ТРЕ 10.04.2019 и 11.04.2019. Продолжить введение имипенема по 500 мг 2 раза в сутки с учетом уровня скорости клубочковой фильтрации и интермиттирующего диализа. Ко-тромоксазол 480 мг/сут в/в 3 раза в неделю. Ig 5 г после ТРЕ. Оставлены рекомендации по дообследованию пациентки.
10.04.2019, 14.00 – состояние пациентки крайне тяжелое с отрицательной динамикой в виде носового кровотечения. Вызван на консультацию оториноларинголог (15.00: состоявшееся носовое кровотечение, признаков активного кровотечения нет, показаний к тампонаде носа нет). Продолжена медикаментозная седация, гемодинамические показатели стабильные. Выполнено дообследование: ультразвуковое исследование почек, ОБП плевральных полостей: эхо-признаки диффузных изменений и неравнамерного повышения эхогенности паренхимы почек, уменьшения толщины паренхимы правой почки (эхо-картина правостороннего нефросклероза, диффузного повреждения паренхимы почек). Эхо-признаки свободной жидкости в брюшной полости. Эхо-признаки наличия минимального правостороннего гидроторакса, незначительного выпота в левом плевральном синусе.
Эхокардиография: общая систолическая функция миокарда левого желудочка (ЛЖ) удовлетворительная. Зон нарушения локальной сократимости не выявлено. Нарушение функции диастолического расслабления миокарда ЛЖ. Гипертрофии миокарда ЛЖ нет. Полости сердца не расширены. Признаков легочной гипертензии не выявлено. Некоторое уплотнение корня аорты, колец и створок АК и МК. Легкая митральная недостаточность. Уплотнение листков перикарда, следы жидкости в полости перикарда.
Тромбоэластография (ТЭГ): вторичные изменения гемостаза в рамках агрессивного воспалительного процесса. Вне геморрагических проявлений, самостоятельной терапии не требует.
Эзофагогастродуоденоскопия: носовое кровотечение, ангиоэктазии желдука и постбульбарного отдела 12-перстной кишки с признаками состоявшегося кровотечения.
Проводится процедура ГДФ в безгепариновом режиме.
10.04.19.18.00. Состояние пациентки с отрицательной динамикой в виде снижения SpO2 до 86%. При FiO2 50%. ИО – 140. Изменен режим ИВЛ на BiLevel: Рвдох 18 см Н2О, Рнизк – 7 см Н2О, Рsupp – 9 см Н2О, ЧД – 20 в минуту, FiO2 – 60%, РЕЕР – 8 см Н2О. Уровень сознания – медикаментозная седация (пропофол). С целью синхронизации с аппаратом ИВЛ показано дополнительное введение Sol. Midazolami – 30 мг/сут. После окончания процедуры ГДФ проводится процедура ПО (ТРЕ) в безгепариновом режиме с замещением СЗП 2,0 л.
10.04.2019, 22.00. Состояние крайне тяжелое. Уровень сознания – медикаментозная седация (пропофол, мидазолам, ардуан), 6-й уровень по Ramsey. Кожные покровы бледные, теплые, тургор кожи сохранен. Пастозность верхних и нижних конечностей, тела. Аускультативно выслушивается жесткое дыхание, ослабленное над всеми отделами легких, хрипы отчетливо не выслушиваются. При санации небольшое количество слизисто-геморрагического отделяемого.
Гемодинамика с тенденцией к гипотонии, начато введение норадреналина. Тоны сердца приглушены, ритм правильный. Живот увеличен в объеме, мягкий, на пальпацию не реагирует, перистальтика выслушивается, ослабленная. По назогастральному зонду застойное отделяемое в небольшом количестве.
Режимы ИВЛ прежние, кроме FiO2 (55%); SpO2 после смены режима вентиляции повысилось до 96%. Отмечено снижение гемоглобина до 74 г/л. тромбоцитов – до 35 тыс/мкл.
Фибробронхоскопия: эндоскопическая картина двустороннего диффузного геморрагического бронхита 2-й ст. интенсивности воспаления.
ТЭГ: нормальное состояние гемостаза за счет плазменных факторов свертывания и низкая плотность сгустка крови на фоне активности тромбоцитов. Данных за избыточный фибринолиз не выявлено. Таким образом, в целом гемостаз направлен в сторону гипокоагуляции (консультация гемотолога).
Хирург: клинических данных за желудочно-кишечное кровотечение не выявлено. В экстренной операции не нуждается.
Проведена процедура ТРЕ, без осложнений.
11.04.2019–12.04.2019. Состояние крайне тяжелое. Температура – 37,3°С. Уровень сознания – медикаментозная седация (пропофол, мидазолам), 5–6-й уровни по Ramsey. С аппаратом ИВЛ синхронизирована. Кожные покровы бледные, теплые, тургор кожи сохранен. Отмечается пастозность верхних и нижних конечностей, тела.
ИВЛ через трахеостомическую трубку в режиме BiLevel: Рвдох – 18 см Н2О, Рнизк – 7 см Н2О, Рsupp – 9 см Н2О, ЧД – 20 в минуту, FiO2 – 55%, РЕЕР – 8 см Н2О. Показатели газообмена улучшились: SpO2 – 93–96%. ИО – 388. Аускультативно выслушивается жесткое дыхание, ослабленное над всеми отделами легких, хрипы отчетливо не выслушиваются. При санации небольшое количество слизисто-геморрагического отделяемого. ТЭГ: умеренная гипокоагуляция за счет плазменных факторов гемостаза, нормальная плотность сгустка.
Тоны сердца приглушены, ритм правильный, ЧСС – 73 в минуту, АД – 130/70 мм рт.ст., постоянная инфузия норадреналина в дозе 0,05 мкг/кг/мин. Живот увеличен в объеме, мягкий, на пальпацию не реагирует, перистальтика выслушивается, ослабленная. По назогастральному зонду застойное отделяемое – 500 мл за сутки. Мочеиспускание по уретральному катетеру – 600 мл, моча мутная буроватого оттенка. Стула не было.
Баланс за сутки: + 610 мл, -3100 мл.
После 2-го сеанса ТРЕ лихорадка до 38,0°С, при микробиологическом исследовании БАЛ – гнойно-геморрагическое отделяемое (в посеве Staphylococcus aureus, Klebsiella pneumonia, Proteus mirabilis), по данным лабораторных исследований отмечен рост лейкоцитоза, СРБ более 300 мг/мл. Состояние расценено как поздняя нозокомиальная ИВЛ-ассоциированная пневмония на фоне геморрагического пневмонита и массивной иммуносупрессивной терапии, в связи с чем уменьшена доза кортикостероидов, прекращено проведение ТРЕ, начата поликомпонентная антимикробная терапия, включившая дорипенем, полимиксин, ванкомицин, бисептол, каспофунгин. 12.04.2019 проведено повторное КТ-исследование (рис. 2).
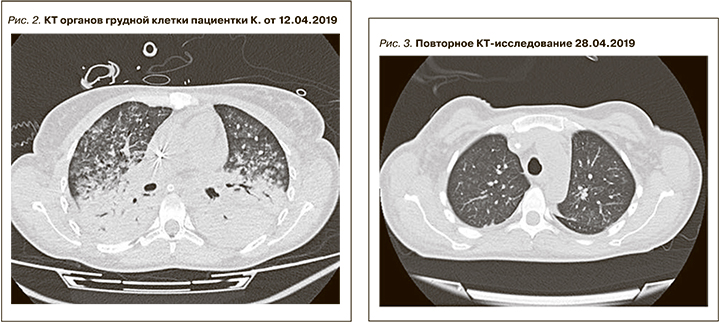
По сравнению с КТ от 09.04.2019 – отрицательная динамика: нижние доли обоих легких и задние сегменты верхних долей тотально безвоздушны с видимыми просветами бронхов, паренхима их уплотнена, нативной плотностью до 50 HU (признак геморрагического пропитывания), при в/в контрастировании деструктивных изменений в паренхиме легких не выявляется. В полости перикарда жидкости нет. В верхних долях обоих легких сохраняются сливные альвеолярные инфильтраты в прежнем объеме. В плевральных полостях жидкости нет. В полости перикарда минимальный выпот, не нарастает. Медиастинальные л/у множественные, умеренно увеличенные, наибольший из них размером 10,5 мм по короткой оси. В просвете трахеи и главных бронхов патологических включений не выявлено. С обеих сторон адекватно установленные ЦВК.
Заключение: КТ-картина обширного острого альвеолярного повреждения легких с тотальной безвоздушностью паренхимы нижних долей обоих легких, нарастания выраженности уплотнений, наиболее вероятно за счет геморрагического пропитывания, менее вероятно – пневмоническая инфильтрация. По сравнению с КТ-исследованием от 09.04.2019 динамика отрицательная.
К терапии основного заболевания добавлено введение Ig, замена/удаление ЦВК (бедренного, яремного), коррекция режимов ИВЛ. Проводились гемотрансфузии эритроцитарной массы, тромбоконцентрата и криопреципитата. В связи с диагностированным правосторонним экссудативным средним отитом выполнен парацентез барабанной перепонки (в посеве K. pneumoniae, Preudomonas aeruginosa), добавлена местная терапия (капли в ухо, капли в нос). В связи с положительным посевом кала на токсины А и В Clostridium difficile добавлен ванкомицин внутрь. Через несколько дней зарегистрировано развитие приступов генерализованного тонико-клонического судорожного синдрома. По данным КТ, ГМ-картина диференциального диагноза между проявлениями множественных ишемических инфарктов на границе «водораздела» и корковых инфарктов при венозных тромбозах, что расценено как активность системного заболевания, в связи с чем принято решение о введении 1000 мг ритуксимаба и дальнейшее введение Ig. Назначена постоянная инфузия карбамазепина, затем больная была переведена на постоянную инфузию конвулекса. В связи с лабораторной картиной гипотиреоза назначен левотироксин по 150 мкг/сут.
На фоне проводимой антимикробной терапии через 10 дней отмечены снижение уровня СРБ, нормализация уровня лейкоцитов крови, снижение температуры тела до минимального субфебрилитета. Особенностью серологической активности стало наличие АТ к МПО, при контроле – выявление АТ к ПР3, АНФ с повышением до 6 норм за счет SCL70. С 18.04.2019 постепенное снижение дозы норадреналина, с 19.04.2019 самостоятельное поддержание гемодинамики 120/70–130/80 мм рт.ст. без дотации норадреналина. После нормализации температуры тела, выведения пациентки на сознание возобновлены сеансы ТРЕ с объемом замещения до 2,5 л с превентивным введением МП 125 мг и ИГ. В данном объеме проведено четыре сеанса. С 25.04.2019 назначен преднизолон 15 мг/сут внутрь, с 27.04.2019 – 30 мг/сут внутрь.
С 27.04.2019 повторных приступов генерализованного тонико-клонического судорожного синдрома не регистрировалось. На фоне проведенной терапии восстановилось сознание, регрессировали признаки дыхательной недостаточности (рис. 3).
По сравнению с КТ от 12.04.2019 – выраженная положительная динамика в виде дальнейшего уменьшения объема консолидации в нижних долях обоих легких, почти полного восстановления нормальной пневматизации верхних долей. Новых патологических изменений нет. Альвеолярные инфильтраты в верхних долях с признаками начальной резорбции. В полости перикарда – минимальное количество жидкости. Появился выпот в плевральных полостях (180 мл справа, 120 мл слева). Медиастинальные л/у множественные, умеренно увеличенные, наибольший из них размером 10,5 мм по короткой оси. В просвете трахеи и главных бронхов патологических включений не выявляется.
Заключение: КТ-картина разрешения альвеолярного повреждения легких в стадии неполного восстановления.
С 30.04.2019 пациентка проходила через вспомогательные режимы ИВЛ и с 05.05.2019 больная переведена на самостоятельное дыхание, 06.05.2019 выполнена декануляция трахеи (ИВЛ в течение 25 суток).
После стабилизации состояния 10.05.2019 для дальнейшего лечения пациентка переведена в профильное отделение, где продолжена патогенетическая терапия.
Заключение
Несвоевременное обращение за медицинской помощью и запоздалая диагностика СГ и АНЦА-СВ, представляющая определенные трудности для врачей различных специальностей в связи редкостью этих заболеваний, мало известных широкому кругу практикующих врачей, полиорганные проявления и разнообразие клинических вариантов течения заболевания не всегда позволяют заподозрить их наличие на ранних стадиях. Свидетельством служит некоторая информация, полученная от пациентки: «...в 2018 г. появились периодические боли в крупных суставах, кашель, боль в горле, эпизоды повышения температуры тела, резь в глазах (связывала с ношением линз). К врачу не обращалась. Лечения не получала». Или: «...самостоятельно обратилась в медицинское учреждение для проведения необходимых лабораторных исследований и затем самотеком обратилась в ГКБ».
В ГКБ (первая госпитализация) в связи с уремией проведен сеанс гемодиализа, после диагностики СГ и АНКА-васкулита проведены сеанс КПФ и медикаментозная терапия глюкокортикоидами и цитостатиками в режиме пульс-терапии. Однако состояние пациентки ухудшилось в связи с нарастанием дыхательной недостаточности и развитием легочного кровотечения, а затем – нозокомиальной пневмонии в связи с массивной иммуносупрессией. Также не следует сбрасывать со счетов и возможное наличие у пациентки генетически опосредованных иммунологических нарушений либо приобретенных в процессе различных методов проводимого лечения начиная с младенчества. Несмотря на литературные данные, свидетельствующие о сочетанном воздействии на организм двух заболеваний, не вызывающих суммации повреждающего действия, видимо, эта тема нуждается в дальнейшем более прецизионном исследовании. Всего за время нахождения в ГКБ при первой госпитализации проведено три сеанса КПФ и ГДФ.
Как известно, в Европейских рекомендациях 2016 г. отмечено, что применение ПО (ТРЕ) следует рассматривать при быстропрогрессирующем ГН с уровнем креатинина крови >500 мкмоль/л (5,7 мг/дл) у пациентов с дебютом или рецидивом заболевания. При проведении ТРЕ можно удалить иммунные комплексы, служащие патофизиологическим источником болезни, поэтому в этой ситуации целесообразно было рассмотреть более раннее использование ПАФ (ТРЕ). Хорошо известно, что методика ТРЕ заключается в отделении плазмы путем фильтрации через большие поры мембраны плазменного фильтра, впоследствии клетки крови возвращаются в сосудистое русло пациента, а плазма удаляется. Чтобы поддерживать внутрисосудистый объем, удаленная плазма замещается субституатом различного состава в зависимости от показаний. Это может быть либо только свежезамороженная плазма (СЗП), либо комбинация СЗП (80% объема) с 5-процентным раствором альбумина (20% объема). Поэтому, на наш взгляд, проведение ТРЕ в этой ситуации было более целесообразным.
В настоящее время значительное число публикаций свидетельствует о необходимости внедрения персонифицированной медицины. Ведущие ученые, эндокринологи, кардиологи, хирурги, ревматологи уже длительное время используют основные подходы, составляющие персонифицированную медицину. Наиболее важной составляющей являются генетические исследования, которые могли бы предоставить полноценную информацию (кроме представленной кратким анамнезом) о генетических нарушениях у этой пациентки.



