Введение
Иммуносупрессивная терапия после трансплантации сόлидных органов существенно повышает риск развития онкологических заболеваний по сравнению с общей популяцией. Значимую часть онкологических заболеваний после пересадки почки составляют новообразования кожи [1].
Отмечено, что рост случаев рака кожи у пациентов после пересадки почки, получающих после трансплантации почки иммуносупрессивную терапию, пропорционален продолжительности приема и дозе имуносупрессантов [2]. Помимо иммуносупрессивной терапии другие факторы риска развития рака кожи включают климатический пояс (интенсивность ультрафиолетового излучения), эпизоды солнечных ожогов в детском возрасте, наличие солнечных кератозов, опухолевых поражений до трансплантации и мужской пол.
Клинический случай
Заболевание почек дебютировало в возрасте 37 лет с артериальной гипертензии до 200/120 мм рт.ст. При обследовании обнаружены протеинурия, эритроцитурия, был поставлен диагноз хронического гломерулонефрита. В течение последующих 5 лет нарастали явления хронической почечной недостаточности, в 2004 г. начата заместительная почечная терапия программным гемодиализом.
В январе 2005 г. выполнена операция – аллотрансплантация трупной почки от совместимого трупного донора с немедленной функцией трансплантата. С самого начала была использована только базовая трехкомпонентная иммуносупресивная терапия (циклоспорин, микофенолата мофетил, метилпреднизолон). Послеоперационный период протекал без осложнений, пациент был выписан под амбулаторное наблюдение на 20-е сутки после операции.
В связи с развитием нефропатии трансплантата в 2007 г., ростом уровня креатинина плазмы до 278 мкмоль/л, умеренной альбуминурией проведена конверсия циклоспорина на такролимус с положительным клиническим эффектом: креатинин плазмы крови стабилизировался на уровне 156–167 мкмоль/л. В конце 2010 г. находился на стационарном лечении по поводу двусторонней внебольничной пневмонии. После курса антибактериальной терапии без изменения режима иммуносупрессии пациент был выписан после рентгенологического подтверждения разрешения пневмонии. Дальнейший период наблюдения протекал без особенностей, функция трансплантата оставалась удовлетворительной, а уровень креатинина сыворотки крови стабильным (157–178 мкмоль/л).
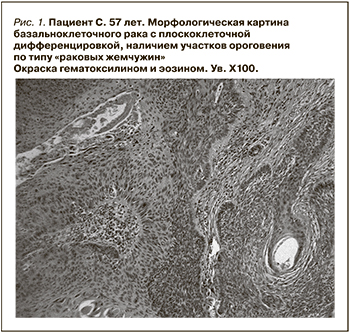
В 2015 г. при очередном визите в клинику обнаружено кожное новообразование в левой височной области. Новообразование было удалено, при гистологическом исследовании обнаружен базальноклеточный рак с плоскоклеточной дифференцировкой, наличием участков ороговения (рис. 1). После выписки продолжено наблюдение онкологом по месту жительства.
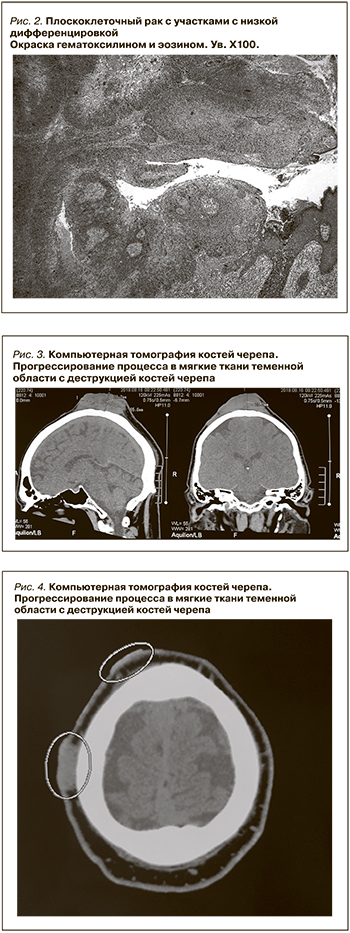
В марте 2018 г. обнаружен рецидив кожного новообразования височной области, а также новые очаги в лобной области, передней грудной стенке. Выполнено широкое иссечение всех кожных новообразований с основанием. При гистологическом исследовании был верифицирован плоскоклеточный рак (рис. 2). В связи с прогрессированием онкологического заболевания проведен курс близкофокусного рентгеновского излучения в суммарной дозе 50–80 грей.
Тем не менее в июле 2018 г. прогрессировал процесс в мягкие ткани теменной области с деструкцией костей черепа (рис. 3, 4). Выполнена биопсия опухоли мягких тканей теменной области. При гистологическом исследовании идентифицирован низкодифференцированный плоскоклеточный рак. Несмотря на проводимую терапию, отмечено прогрессирование заболевания, приведшее к летальному исходу через 3 года после обнаружения онкологического заболевания кожи.
Обсуждение
Ряд исследований свидетельствует о преобладании немеланомных опухолей среди злокачественных новообразований кожи у пациентов после трансплантации почки [2, 3]. У пациентов этой когорты чаще, чем в общей популяции, наблюдаются множественные очаги и более агрессивное клиническое течение рака [4, 5].
Риск развития рака кожи зависит от инсоляции и варьируется в разных географических регионах. В частности, самая высокая заболеваемость отмечается в Австралии. Солнечное облучение является одним из главных факторов риска для развития немеланомного рака у пациентов после трансплантации почки. Описано наблюдение, в котором из 53 поражений, диагностированных у 25 из 486 реципиентов с пересаженной почкой, 34 (64,2%) были расположены на лице – наиболее открытой для ультрафиолетового излучения части тела [1].
По данным Imko-Walczuk, среди пациентов после трансплантации почки в Гданьске (Польша) не было отмечено различий по локализации рака кожи с общей популяцией: 76% плоскоклеточных карцином и 72% базальноклеточных были обнаружены в области головы и шеи [1].
По некоторым данным, число выявленных случаев рака кожи увеличивается с продолжительностью иммуносупрессии и составляет 20,7% через 5 лет, 37,35% через 10 и 53,08% через 15 лет после трансплантации [6].
Большинство публикаций содержит информацию, согласно которой частота случаев плоскоклеточного рака преобладает над базально-клеточным [7–9]. Плоскоклеточный рак кожи – опухоль, происходящая из плоского эпителия, имеет более высокую по сравнению с другими кожными опухолями степень злокачественности и может нередко трансформироваться из некоторых предраковых заболеваний. В описанном нами случае тоже происходила постепенная трансформация как типа клеток, так и степени дифференцировки.
Представленное наблюдение можно считать достаточно типичным с точки зрения течения и факторов риска. Заболевание возникло спустя 10 лет после начала иммуносупрессивной терапии, когда риски существенно возрастают. Также характерна и локализация базальноклеточного и плоскоклеточного рака в области головы и шеи. Можно говорить о достаточно стремительном прогрессировании рака на фоне отказа пациента от прекращения иммуносупрессивной терапии. Определенную роль могла сыграть и конверсия основного иммуносупрессанта с циклоспорина на такролимус из-за развития нефропатии трансплантата.
Заключение
Длительная иммуносупрессивная терапия, сопровождающая пересадку почки, существенно повышает вероятность развития злокачественных новообразований кожи. При этом риск значимо увеличивается с течением времени. Поэтому в протокол ведения реципиентов ренальных трансплантатов необходимо включать осмотры дерматолога с целью более раннего выявления заболевания, уделяя особое внимание пациентам с более чем десятилетней продолжительностью иммуносупрессии. В случае подтверждения плоскоклеточного рака кожи продолжение иммуносупрессивной терапии сопровождается высоким риском прогрессирования и фатального исхода заболевания.



