Введение
Иммуноглобулин A-нефропатия (ИГАН), впервые описанная более полувека назад J. Berge (1968), является наиболее распространенным вариантом первичного гломерулонефрита в мире [1]. Несмотря на очевидный прогресс в изучении патогенеза ИГАН, механизмы ее развития все еще далеки от полного понимания, и кроме того, имеются индивидуальные и межрасовые клинические и патофизиологические особенности ИГАН, что значительно затрудняет лечение данного варианта гломерулонефрита [2, 3]. В текущих международных и отечественных клинических рекомендациях патогенетическая терапия пациентов с активным течением ИГАН представлена, главным образом, традиционной блокадой иммуновоспалителных процессов в клубочках и тубулоинтерстиции, причем с позиции доказательной медицины подтверждена эффективность только глюкокортикостероидов (ГКС) [4, 5]. В реальной клинической практике пока отсутствуют схемы лечения, которые могли бы существенно повлиять на формирование иммунных комплексов, содержащих галактозодефицитный иммуноглобулин А1, или предотвратить их отложение в мезангии (основные звенья патогенеза ИГАН). В то же время в последнем десятилетии наблюдется рост числа оригинальных исследований и обзоров публикаций, посвященных новым перспективным направлениям фармакологического воздействия на различные звенья патогенеза ИГАН (модуляция Ви Т-клеточного ответа, активация MALT-системы, комплемента, аутофагия и др.) [3, 6, 7], и отдельные направления уже продемонстрировали свою эффективность в доклинических или клинических исследованиях.
В отличие от других гломерулопатий, протекающих с эпизодами нефротического и/или остронефритического синдромов, острого повреждения почек, ИГАН в большинстве случаев представляет собой медленно прогрессирующее заболевание. В связи с этим контроль артериальной гипертензии (АГ) и минимизация протеинурии (ПУ) в настоящее время рассматриваются как важные составляющие стратегии ведения пациентов с ИГАН в дополнение к попыткам патогенетической терапии с помощью иммунодепрессантов [3–5].
Настоящий обзор cфокусирован на современной поддерживающей терапии ИГА-нефропатии, в нем освещены как традиционные, так и новые ее направления, представлен критический анализ их эффективности.
Блокада ренин-ангиотензинальдостероновой системы
В ряде исследований показано, что артериальное давление (АД) у пациентов с ИГАН повышается уже на очень ранних стадиях заболевания вследствие активации ренин-ангиотензинальдостероновой системы (РААС) в почках, проявляющейся повышением экспрессии ангиотензиногена в ткани почек и увеличением его экскреции с мочой [8]. Даже нормотензивные пациенты с ИГАН и незначительной ПУ демонстрировали более высокое, чем у здоровых, АД, и в отсутствие других факторов риска у них уже выявлялись признаки вовлечения сердца в виде небольшого утолщения стенки левого желудочка [9]. Эти наблюдения послужили аргументом в пользу ранней коррекции АГ у пациентов с гломерулонефритом преимущественно путем блокады активированной РААС. Подтверждением этого служит исследование А. Nishiyama и соавт., которые продемонстрировали, что применение блокаторов РААС у пациентов с ИГАН приводит к снижению экспрессии гена ангиотензиногена в ткани почек и уровней ангиотензиногена в моче и позволяет сохранить функцию почек [8]. Ретроспективный анализ данных регистров ИГАН показал, что у пациентов, получавших антигипертензивную терапию с использованием ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов рецепторов ангиотензина II (БРА), скорость потери функции почек была ниже, чем у сопоставимых пациентов, не получавших такие препараты [10]. Рандомизированное контролируемое исследование (РКИ) с участием пациентов с ИГАН (n=44) продемонстрировало преимущество антигипертензивной терапии ингибиторами АПФ в виде более высокой выживаемости и большем снижении ПУ по сравнению с альтернативными антигипертензивными средствами (нифедипин, амлодипин, атенолол, диуретики и доксазозин) при эквивалентном контроле АД [11]. В РКИ, включавшем пациентов азиатского происхождения с ИГАН (n=109), при приеме БРА (валсартан) наблюдался больший антипротеинурический эффект и более выраженное замедление темпов снижения скорости клубочковой фильтрации (СКФ) по сравнению с плацебо [12]. Эти и другие данные послужили обоснованием рекомендации уровня 1B (KDIGO 2021), согласно которой ингибиторы АПФ или БРА следует назначать пациентам с ИГАН в качестве нефропротективных средств первой линии при наличии АГ, а также при ПУ выше 0,5 г/сут независимо от того, страдают они АГ или нет [4]. Даже если у пациента с ПУ АД хорошо контролируется (т.е. систолическое АД<120 мм рт.ст.), следует подобрать максимально переносимую дозу блокаторов РААС с целью дальнейшего уменьшения ПУ.
Эпидемиологические исследования в больших когортах пациентов с ИГАН подтвердили значение неконтролируемой АГ и ПУ как независимых факторов риска прогрессирования ИГАН, а, следовательно, важных мишеней терапевтических интервенций [10, 13, 14]. Так, в исследовании W. Le и соавт., включавшем 1155 пациентов с ИГАН, 10и 20-летняя выживаемость без диализа у пациентов с ПУ 0,5–1 г/сут была статистически значимо выше по сравнению с этими же показателями у пациентов с ИГАН и ПУ>1 г/сут [13]. В исследовании Y. Kanno и соавт. у пациентов с ИГАН достигнутое с помощью блокады РААС АД, равное 129/70 мм рт.ст., ассоциировалось со стабильным уровнем СКФ за 3-летний период наблюдения, тогда как у пациентов с более высоким уровнем АД (136/76 мм рт.ст.) за такой же период наблюдения СКФ снизилась в среднем на 13 мл/мин [14]. Несмотря на большое число доказательств, подтверждающих эффективность блокады РААС в качестве нефропротекции у подавляющего большинства пациентов с ИГАН, остается ряд вопросов, требующих уточнения. Например, пока неизвестно, будет ли эффективна блокада РААС у нормотензивных пациентов с ИГАН и низкой ПУ (<0,5 г/cут). Нет и однозначного отчета на вопрос, окажет ли двойная блокада РААС с использованием комбинации ингибитора АПФ и БРА положительное действие у пациентов с ИГАН. В проведенных около 20 лет назад небольших клинических исследованиях с участием больных ИГАН при одновременном применении лозартана и ингибитора АПФ наблюдалось дополнительное снижение ПУ [15, 16]. Однако результаты современного рандомизированного исследования STOP-IgAN продемонстрировали другие эффекты двойной блокады РААС: в конце 3-летнего периода наблюдения у пациентов c ИГАН (n=112), получавших комбинированное лечение ингибитором АПФ и БРА (n=30), ПУ неожиданно оказалась выше по сравнению с таковой у пациентов, получавших монотерапию ингибитором АПФ или БРА (n=82), в то время как общие почечные исходы были сопоставимы во всех группах лечения [17]. В исследовании у пациентов с ИГАН и ПУ>1 г/сут, сохраняющейся, несмотря на оптимальную дозу БРА, добавление к терапии другого блокирующего РААС средства – прямого ингибитора ренина алискирена привело к снижению ПУ на 26%, а также уровней провоспалительного интерлейкина-6 и профиброгенного трансформирующего фактора роста β в сыворотке крови через 6 месяцев лечения [18]. Антипротеинурический эффект алискирена был продемонстрирован еще в одном небольшом рандомизированном перекрестном исследовании [19]. Тем не менее дальнейшее изучение применения алискирена при ИГАН не проводилось из-за высокой частоты гиперкалиемии и артериальной гипотензии, ранее выявленных при лечении пациентов с другими нозологиями, в т.ч. сахарным диабетом 2 типа (СД2) и хронической болезнью почек (ХБП).
Ингибиторы натрий-глюкозного котранспортера 2-го типа
Новым эффективным направлением поддерживающей терапии пациентов с ИГАН высокого риска является применение наряду с препаратом, блокирующим РААС, ингибитора натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2), который уменьшает реабсорбцию глюкозы в проксимальном извитом канальце почки, усиливая таким образом выведение глюкозы с мочой. Изначально иНГЛТ-2 были разработаны для лечения СД2, поскольку за счет глюкозурии улучшают гликемический контроль. В крупных исследованиях (CREDENCE, EMPA-REG OUTCOME, DAPA-CKD, SCORED и др.) различные представители класса иНГЛТ-2 продемонстрировали кардиои ренопротективные эффекты у пациентов, страдающих СД2 – способность снижать сердечнососудистую и почечную смертность, замедлять темпы падения рСКФ и уменьшать альбуминурию. Клинические исследования у пациентов с СД2 выявили раннее и обратимое снижение рСКФ в начале терапии иНГЛТ-2, отражающее снижение гемодинамического давления в клубочке, которое в долгосрочной перспективе в свою очередь позволит уменьшить повреждающее действие внутриклубочковой гипертензии и сохранить функцию почек [20, 21]. Примечательно, что этот эффект иНГЛТ-2 не зависел от уровня гликемии, он наблюдался и у пациентов с хорошим контролем гликемии, что послужило обоснованием применения иНГЛТ-2 у пациентов с ХБП недиабетической этиологии.
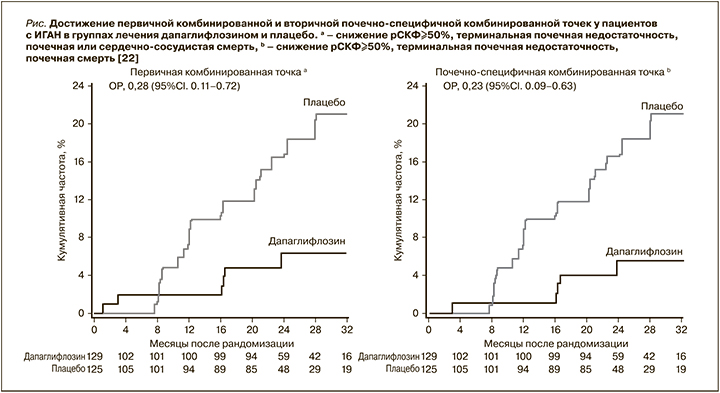
Субанализ результатов рандомизированного двойного слепого плацебо-контролируемого исследования DAPA-CKD, в котором приняли участие 270 пациентов с диагнозом ИГАН, предоставил доказательства того, что дапаглифлозин может быть безопасным и эффективным дополнением к стандартной блокаде РААС при ИГАН [22, 23]. Средний возраст пациентов составил 51,2 года, средняя рСКФ 43,8 мл/мин/1,73 м2; среднее отношение альбумин/креатинин в моче (ОАКМ) 900 мг/г. Пациенты с ИГАН были рандомизированы на терапию дапаглифлозином в дозе 10 мг (n=137) или плацебо (n=133). Первичной составной конечной точкой было устойчивое снижение рСКФ на 50% и более, развитие терминальной стадии ХБП или смерть от связанной с заболеванием почек или сердечно-сосудистой причины. Первичного исхода достигли 6 (4%) участников, получавших дапаглифлозин, и 20 (15%) пациентов из группы плацебо (отношение рисков – ОР=0,29, 95% доверительный интервал – ДИ 0,12–0,73; р=0,005, рис.). Аналогичные результаты наблюдались для вторичного почечно-специфического исхода (ОР=0,24, 95% ДИ 0,09–0,65; р=0,002, см. рисунок). У 5 (4%) участников в группе дапаглифлозина и у 16 (12%) в группе плацебо в период исследования развилась терминальная стадия ХБП (ОР=0,30, 95% ДИ 0,11–0.83; р=0,014). Средние показатели снижения рСКФ при применении дапаглифлозина и плацебо составили 3,5 и 4,7 мл/мин/1,73 м2 в год соответственно. В группе дапаглифлозина ОАКМ снизилось на 26% по сравнению с плацебо. Побочные эффекты, приведшие к отмене исследуемого препарата, были аналогичны в группе дапаглифлозина и плацебо. При применении дапаглифлозина было зарегистрировано меньше серьезных побочных эффектов, чем в группе плацебо. Ни у кого из пациентов с ИГАН не развилась серьезная гипогликемия. Таким образом, у пациентов с ИГАН дапаглифлозин снижал риск прогрессирования ХБП при благоприятном профиле безопасности. Ограничениями этого исследования были его пострегистрационный характер и относительно небольшое число пациентов, достигших «почечных» конечных точек. Более глубокое понимание роли иНГЛТ-2 в лечении ИГАН будет представлено после получения результатов субанализа исследования EMPA-Kidney, в котором группа без СД2 включала довольно большое число пациентов с ИГАН [24].
Рыбий жир
Роль рыбьего жира (эйкозапентаеновая и докозагексаеновая омега-3 жирные кислоты) остается неопределенной. Обсуждаются его противовоспалительные свойства, такие как снижение выработки эйкозаноидов и цитокинов, влияние на реологические свойства крови и пластичность клеточных мембран [25]. Рыбий жир широко назначают при ИГАН, его прием безопасен, хотя переносимость является серьезной проблемой из-за «рыбного» запаха изо рта и пота, а также побочных эффектов со стороны желудочно-кишечного тракта (отрыжка, метеоризм). По данным одного РКИ, включавшего пациентов с ИГАН (средняя СКФ 80 мл/мин, ПУ от 2,5 до 3 г/сут), лечение рыбьим жиром в течение 6 лет наблюдения обеспечивало долгосрочную защиту функции почек [26, 27]. Однако в другом РКИ, в котором пациенты были распределены поочередно на прием омега-3 жирных кислот и преднизолона или плацебо, в группе применения рыбьего жира положительный эффект после 2 лет наблюдения отсутствовал [28]. В ряде более мелких РКИ также не получено доказательств пользы от лечения пациентов с ИГАН рыбьим жиром. Не подтвердил эффективность рыбьего жира и мета-анализ имеющихся данных [29]. Необходимы дальнейшие исследования в этой области, прежде чем можно будет сделать какие-либо твердые выводы.
Дипиридамол
Дипиридамол снижает агрегацию тромбоцитов посредством ингибирования фосфодиэстеразы, обладает антиоксидантным действием, усиливает эффекты оксида азота – потенциального вазодилататора и ингибитора активации тромбоцитов. Благодаря таким полезным свойствам этот препарат довольно широко использовали в прошлом тысячелетии, в т.ч. в России, для поддерживающей терапии ИГАН. Действительно, в ряде наблюдательных исследований и мета-анализов наблюдательных исследований продемонстрированы нефропротективные эффекты дипиридамола у взрослых пациентов с ИГАН, проявлявшиеся в снижении ПУ и улучшением функции почек [30, 31]. Однако многие из этих исследований не отличались высоким качеством и в них использовались суррогатные исходы, заменяющие клинически значимый результат лечения. Работы, посвященные изучению монотерапии дипиридамолом или его сочетания с блокаторами РААС у пациентов с ИГАН, в которых использовали «жесткие» конечные точки, такие как терминальная хроническая почечная недостаточность и/или смертность, единичны [32]. Для оценки реального клинического эффекта данной терапии при ИГАН необходимо проведение РКИ. Современные рекомендации КDIGO в отсутствие достаточной доказательной базы не рассматривают дипиридамол в качестве поддерживающей терапии, влияющей на прогноз пациентов с ИГАН.
Тонзилэктомия
На основании современных представлений о патогенезе ИГАН и роли в ней нарушений местного иммунитета слизистых оболочек можно полагать, что уменьшение с помощью тонзилэктомии (ТЭ) пула активированных В-клеток (продуцентов галактозодефицитного иммуноглобулина А1) позволит снизить частоту острых эпизодов макрогематурии, провоцирующим фактором которых являются обострения тонзиллита, а также оказать положительное влияние на течение ИГАН [33].
Однако имеющиеся к настоящему времени наблюдательные исследования демонстрируют противоречивые данные относительно возможности улучшения долгосрочной почечной выживаемости в результате ТЭ. Так, исследования, проведенные в Японии, включая мета-анализ исследований большой когорты больных ИГАН, большинство из которых тоже были японцами, показали пользу ТЭ [34–37], тогда как данные европейских исследований не столь однозначны. В отдельных работах в небольших европейских когортах пациентов с ИГАН не выявлено статистически значимого влияния ТЭ на вероятность дожития без прогрессирования или достижения ремиссии в общей группе и подгруппе больных без иммуносупрессии по сравнению с пациентами, получавшими препараты, блокирующие РААС [38, 39]. В то же время имеются работы, четко демонстрирующие увеличение почечной выживаемости при ИГАН после ТЭ [40], что согласуется с данными недавно проведенных мета-анализов азиатских исследований [37, 41]. Опубликовано небольшое число исследований, главным образом, обсервационные наблюдения и их единичные мета-анализы преимущественно в японской популяции, посвященных анализу влияния на течение ИГАН комплексной терапии, включающей терапию ГКС и проведение ТЭ [42–45]. В нерандомизированном исследовании с участием 55 пациентов с ИГАН со средней СКФ 95 мл/мин и ПУ 1–1,5 г/сут уменьшение ПУ и эпизодов макрогематурии через 24 месяца наблюдалось у большего числа пациентов, леченных ГКС и ТЭ [42]. При повторной биопсии почки через 24 месяца степень отложения иммуноглобулина А и мезангиальная пролиферация в ткани почки были менее выражены в группе терапии ГКС в сочетании с ТЭ. В отечественном одноцентровом исследовании по оценке эффективности терапии ИГАН в ретроспективной когорте пациентов с ПУ>2 г/ сут (n=376), наблюдавшихся в среднем 26 месяцев, установлено, что проведение ТЭ в комплексе с иммуносупрессивной терапией ассоциировано с дополнительным снижением риска прогрессирования ИГАН [44]. Авторы мета-анализа эффективности ТЭ при ИГАН сделали вывод, что сама по себе ТЭ не улучшает исход заболевания, но в сочетании терапией ГКС, оказывает четкое нефропротективное действие [43]. К настоящему времени проведено всего одно многоцентровое РКИ (и снова в когорте японских пациентов), которое показало, что ТЭ в сочетании с «пульсами» ГКС по сравнению с монотерапией ГКС не оказывает положительного влияния в виде дополнительного уменьшения выраженности гематурии и увеличения частоты достижения клинической ремиссии [46]. Хотя антипротеинурический эффект был незначительно, но статистически значимо выше в группе пациентов, леченных с ГКС в сочетании с ТЭ, влияние такой комбинированной терапии на отдаленную почечную выживаемость еще предстоит выяснить.
Таким образом, по результатам имеющихся на сегодняшний день исследований, ТЭ (самостоятельно или в сочетании с ГКС) не рекомендуется всем пациентам ИГАН в качестве рутинного метода лечения с целью уменьшения выраженности протеинурии, гематурии, улучшения почечной выживаемости, поскольку отсутствует доказательная база эффективности такой терапии у представителей европеоидной расы [4]. Однако в некоторых национальных руководствах ТЭ рекомендуется для лечения рецидивирующего тонзиллита у пациентов с ИГАН.
Модуляция микробиоты кишечника
В многочисленных исследованиях подтверждено участие микробного иммунитета слизистых оболочек в патогенезе ИГАН, получены свидетельства вовлечения кишечной микробиоты в патофизиологию ИГАН [47, 48]. Показано, что разнообразие кишечного микробиома при данной болезни ниже, чем у здоровых индивидуумов; у пациентов с ИГАН существенно снижено число полезных бактерий, таких как клостридии, энтерококки и лактобациллы, и значимо повышена численность Ruminococcus, Lachnospiraceae и Streptococcaeae. В экспериментальных исследованиях установлено, что микробиота пациентов с прогрессирующим течением ИГАН у лабораторных животных индуцирует повышение сывороточных уровней BAFF и образование галактозодефицитного иммуноглобулина A1, снижение экспрессии CD89 на поверхности клеток CD11b+ клеток крови и отложение CD89 и иммуноглобулина A1 в мезангии почечных клубочков почек. Более высокие уровни BAFF в сыворотке крови были обнаружены у мышей, подвергнутых трансплантации фекальной микробиоты от пациентов с прогрессирующим течением ИГАН [49]. Модуляция кишечной микробиоты открывает новые возможности в терапии данного заболевания. Сегодня уже проводятся клинические исследования трансплантации фекальных бактерий для лечения ИГАН. В частности, опубликованы результаты такой трансплантации двум китайским пациентам с ИГАН [50]. Модуляция микробиоты кишечника привела через 6 месяцев к развитию частичной клинической ремиссии ИГАН, о чем свидетельствовало снижение суточной ПУ на 50% от исходного уровня наряду с повышением концентрации сывороточного альбумина и стабильной функцией почек.
Заключение
В новом тысячелетии мы ожидаем дальнейших достижений в изучении механизмов развития ИГАН в надежде, что они послужат стимулом для создания эффективной специфической терапии, которая позволит предупредить образование иммунных комплексов, содержащих галактозодефицитный иммуноглобулин А1, и их отложение в ткани почки. В ожидании новых направлений патогенетического лечения ИГАН крайне важно использовать все возможности современной поддерживающей терапии, включая ее новые направления, например применение иНГЛТ-2, поскольку сегодня уже стало очевидным, что только традиционной блокады РААС недостаточно для полного контроля факторов риска прогрессирования ИГАН.



