Введение
Во всем мире имеется тенденция к ежегодному росту числа трансплантаций почки, достигая 95,4 тыс. в год, с увеличением однолетней выживаемости до 98% [1]. Число трансплантаций почки в РФ также продолжает увеличиваться (в 2019 г. – 1473 трансплантации, +8,2%). На долю центров трансплантации почки Москвы и Московской области приходится половина (736 [50,0%]) от всех трансплантаций почки, выполняемых в стране (в 2018 г. 685/50,3%) [2]. Cнижение смертности в раннем и позднем периодах после трансплантации за последние 40 лет отмечено разными исследователями на основании международных регистров [3]. Однако реципиенты почечного трансплантата (РПТ) считаются имеющими наибольший риск развития сердечнососудистых заболеваний (ССЗ). Годовой показатель частоты ССЗ со смертельным исходом или без него у реципиентов составляет 3,5–5,0%, т.е. в 50 раз выше, чем среди населения в целом [4]. Через 36 месяцев после трансплантации,почти у 40% пациентов развиваются ССЗ [5].
Целью нашей работы было изучение смертности и ее причин среди РПТ в позднем периоде после трансплантации почки, наблюдавшихся в ГКБ 52 ДЗМ, и сравнение ее с международными данными.
Материал и методы. Этот систематический обзор был проведен в соответствии с предпочтительными элементами отчетности для систематических обзоров и мета-анализа (PRISMA) [6]. В электронных базах данных MEDLINE, Scopus и Кокрановского центрального регистра контролируемых исследований проведен поиск подходящих исследований, опубликованных до 2020 г., в которых оценивались смертность среди РПТ и ее причины. Списки литературы в квалифицированных статьях также были проверены, и исследования были добавлены вручную, если это было сочтено целесообразным. Стратегия поиска включала следующие термины: «смертность реципиентов почечного трансплантата», «смерть в результате отказа почечного трансплантата» или «смерть с функционирующим трансплантатом, «показатели смертности за 5-летние интервалы», «факторы риска смертности реципиентов почечного трансплантата».
Этот систематический обзор и мета-анализ были сосредоточены на изучении смертности РПТ. В него были включены исследования, в которых участвовали взрослые реципиенты после первичной трансплантации почки, сообщались данные об их смертности и/или ее причинах, числе выживших и невыживших, а также демографические и/или клинические характеристики по группам выживших. Исходные демографические характеристики, лабораторные исследования и лечение, связанное с трансплантацией, были извлечены отдельно для выживших и невыживших. Поскольку отдельные отчеты о случаях и небольшие серии случаев могут быть подмножеством более крупных клинических регистров, мы выбрали для нашего обзора только исследования ≥50 пациентов с трансплантированной почкой [7]. Исследования исключались, если в них были педиатрические реципиенты, реципиенты комбинированных трансплантатов почки/поджелудочной железы и реципиенты, которые умерли с первично нефункционирующим трансплантатом, реципиенты с отсутствующими данными. Если в двух крупных исследованиях была представлена потенциально дублирующаяся популяция, в качестве основного источника данных выбиралось исследование, в котором сообщалось больше информации о выживших и не выживших.
В обзор были включены работы, которые соответствовали отчетности о наблюдательных исследованиях в эпидемиологии (STROBE) [8]. Два автора (Н. и М.) независимо друг от друга проверили электронные заголовки, аннотации, и полные тексты статей. Разногласия были разрешены путем консенсуса с третьим автором (З.).
Из каждого исследования была извлечена следующая информация: имена авторов, название журнала, место исследования, страна происхождения, продолжительность исследования, общее число включенных РПТ, а также число выживших и умерших. Исходные характеристики пациентов получены отдельно для каждого исследования и сгруппированы по группам выживания.
Мета-анализ пропорций проводился по методу Мантела– Ханзела с использованием преобразования Фримана–Туки для вычисления взвешенной суммарной доли по модели фиксированных и случайных эффектов. Гетерогенность модели оценивали с использованием p-значения Q-теста Кокрейна [9] и индекса I2. Индекс I2 выше 75% указывает на неоднородность от средней до высокой [10]. Для проверки систематической ошибки публикации мы применяли метод линейной регрессии Эггера и метод ранговой корреляции Бегга с использованием тау Кендалла в качестве меры ассоциации [11]. Потенциальная систематическая ошибка публикации представлена в виде воронкообразного графика
Этического одобрения не требовалось, поскольку наше исследование носило наблюдательный неинтервенционный характер и было мета-анализом.
Результаты
Характеристики включенных исследований
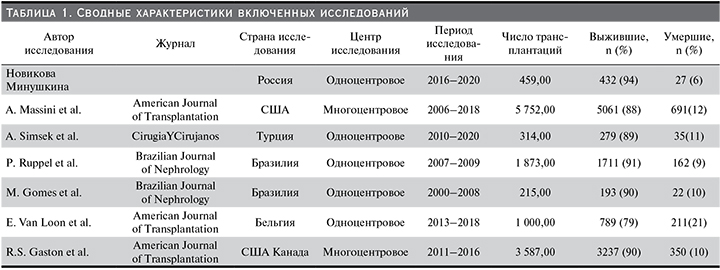
На рис. 1 показана блок-схема выбора исследования. В общей сложности 187 исследований получены с использованием наших критериев поиска. После исключения дублирующихся ссылок и нерелевантных исследований 44 статьи прошли полнотекстовый обзор и 6 из них были включены в окончательный мета-анализ [12–17], в котором изучали причины и факторы риска, связанные со смертью в течение первых 5 лет после трансплантации почки. Подробная информация о каждом исследовании представлена в табл. 1. Два из 6 исследований были многоцентровыми. Всего в мета-анализ вошли 13 200 пациентов (от 215 до 5752), а уровень смертности варьировался от 6 до 21%.
Мета-анализ выживаемости
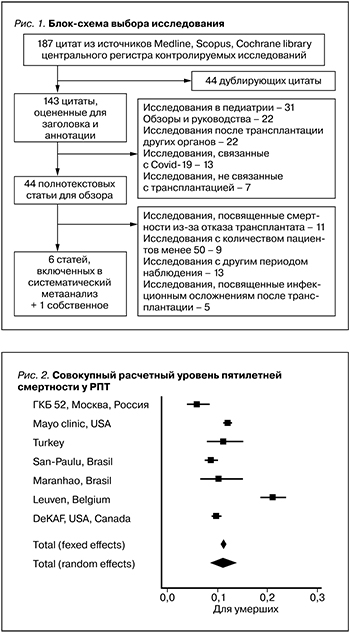
Совокупный расчетный уровень 5-летней смертности у РПТ составил 11,2% (95% ДИ: 10,672–11,756%) в фиксированной модели и 11,07% (95% ДИ: 8,535–13,889%) в случайной. Уровень смертности пациентов, наблюдавшихся в Московском нефрологическом центре ГКБ 52 ДЗМ, был ниже 5,88% (95% ДИ: 3,912–8,443%, табл. 2, рис. 2). Однако данные мета-анализа не были гетерогенными: I2=74,83%, 95% ДИ: 51,58–96,82%, Q-тест, р-значение=0,0016).
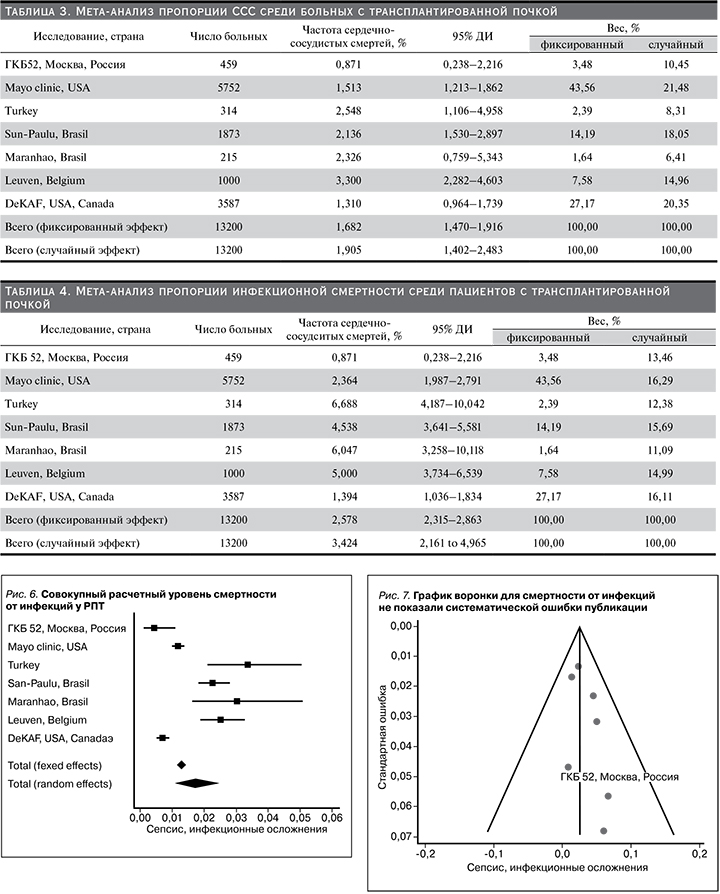
Был проведен тест Эггера и Бегга на асимметрию регрессии, который показал отсутствие систематической ошибки публикации (рис. 3).
Мета-анализ сердечно-сосудистой смертности (ССС)
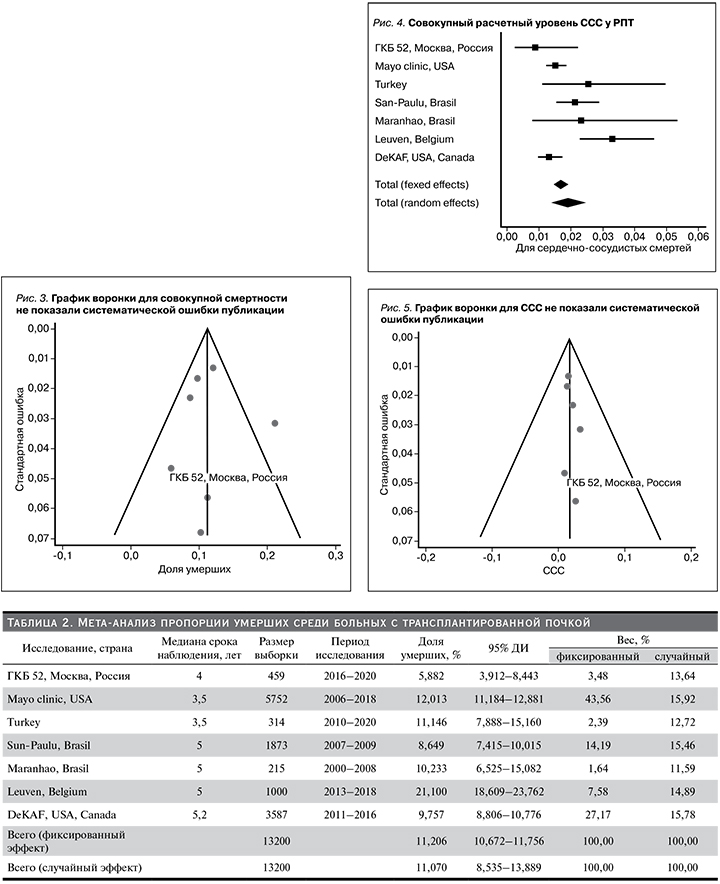
Доля сердечно-сосудистых смертей в анализируемых исследованиях была близкой (0,87–3,3%). Совокупный расчетный уровень ССС у РПТ составил 1,68% (95% ДИ: 1,470–1,916%) в фиксированной модели и 1,91% (95% ДИ: 1,402–2,483%) в случайной. Уровень ССС пациентов, наблюдавшихся в Московском нефрологическом центре ГКБи52 ДЗМ был ниже 0,87% (95% ДИ: 0,238–2,216%) (табл. 3, рис. 4). Данные мета-анализа были слабогетерогенными: I2=72,84% (95% ДИ: 41,52–87,39%, Q-тест, р-значение= 0,0012).
Мы построили графики воронки, чтобы оценить предвзятость публикации. Графики воронки для ССС не показали систематической ошибки публикации (рис. 5).
Мета-анализ смертности от инфекций и инфекционных осложнений
Больший разброс был зарегистрирован для анализа частоты смерти от сепсиса или других инфекционных осложнений (0,8–6,0%). Совокупный расчетный уровень инфекционной смертности среди РПТ составил 2,58% (95% ДИ: 2,315–2,863%) в фиксированной модели и 3,42% (95% ДИ: 2,161–4,965%) в случайной. Уровень инфекционной смертности пациентов, наблюдавшихся в Московском нефрологическом центре ГКБ 52 ДЗМ был ниже 0,87% (95% ДИ: 0,238–2,216%) (табл. 4, рис. 6).
Данные мета-анализа были гетерогенными: I2 – 3,58%, 95% ДИ: 69,20–96,18%, Q-тест, р-значение <0,001), однако ни в одном из случаев не было выявлено систематической ошибки отбора данных (рис. 7).
Обсуждение
Проведенный мета-анализ 7 исследований, включивший 13 200 РПТ, выявил, что среди пациентов, наблюдавшихся в ГКБ 52 ДЗМ с 2016 до 2020 г., доля умерших от ССС, инфекций и сепсиса была ниже, а 5-летняя выживаемость лучше по сравнению со средними значениями этих показателей в фиксированной и случайной моделях (табл. 2–4, рис. 2, 4, 6).Ни в одном из случаев не было выявлено систематической ошибки отбора данных (рис. 3, 5, 7).
По данным ГКБ 52 ДЗМ, за 4 года наблюдения выживаемость РПТ составила 94% (табл. 1). Похожий результат с выживаемостью за 3 года (95,6%) получен бразильскими исследователями [15]. Улучшение выживаемости после трансплантации почки отмечено в крупных международных регистрах, и это совпадает с нашими данными. Так, по данным Сингапурского почечного регистра, 5-летняя выживаемость трансплантата почки от живого донора составляет 95,3%, по данным Сети закупок и трансплантации органов США – 80,2% [1]. Показатели долгосрочной выживаемости, зарегистрированные в США, ниже, чем те, о которых сообщают неамериканские регистры. Например, 5-летняя выживаемость трансплантатов в США для первичной трансплантации почек от умерших и живых доноров составила 72 и 85% соответственно по сравнению с 81 и 90% в Австралии и Новой Зеландии, 79 и 87% в Европе и 81 и 91% в Канаде [18]. Сравнение выживаемости в 2005–2008 гг. между пациентами из США, получившими трансплантаты от умерших доноров, с выживаемостью трансплантатов среди европейских реципиентов выявило более высокие 510-летние показатели у европейцев (77 и 56% соответственно), чем у американцев (белые – 71 и 46%, латиноамериканцы – 73 и 48%, черные – 62 и 34%) [19]. Анализ 379 257 реципиентов после первичной почечной трансплантации в 1988–2014 гг., проведенный на трех континентах, выявил более высокую степень отторжения трансплантата среди реципиентов в США, чем среди жителей Великобритании, Австралии и Новой Зеландии [20]. В США снижение выживаемости реципиентов почки отмечено спустя 3 года после трансплантации [19] и совпадает с прекращением действия медицинской страховки для пожизненной иммуносупрессивной терапии [21]. В целом долгосрочные результаты трансплантации почки в США примерно на 25% хуже, чем в других странах с хорошо развитыми системами трансплантации почки [20], в которых риск смерти после аллотрансплантации почки заметно снизился за последнее время. Так, реципиенты через ≥10 лет после трансплантации почки в 2015–2018 гг. на 20% имеют меньше шансов умереть по сравнению с 2005–2009 гг. (скорректированное отношение рисков=0,80, 95% ДИ: 0,69–0,90) [3].
ССЗ остаются ведущей причиной смерти пациентов после трансплантации почки [22]. ССЗ были главной причиной смертности среди пациентов, наблюдавшихся в ГКБ 52 ДЗМ. Близкими к нашим данным были результаты исследований из Канады [17] и США [12] (табл. 3, рис. 4). Уровень ССС, по данным разных источников, колеблется от 18 до 25%. По данным регистра Австралии и Новой Зеландии, в 1988–2013 гг. наблюдались 16 329 РПТ, умерли 5089 (158 325 человеко-лет), из них 918 (18%) от ССЗ [23]. В Андалусии в листе ожидания на повторную трансплантацию после отказа предыдущего трансплантата почки с 1984 по 2012 г. наблюдали 3851 кандидата. В данной когорте пациентов ССЗ были основной причиной смерти (25,3%), за ними следовали инфекции (19,3%) [24].
При сравнении показателей смертности между реципиентами почки (n=207) и реципиентами печени (n=370) с медианой наблюдения 36,5 месяцев инфекция была наиболее частой причиной смерти в обеих когортах, за ней следовали ССЗ. Годовая кумулятивная сердечно-сосудистая смертность была одинаковой (1,6% после трансплантации печени и 1,5% после трансплантации почки) [25]. Стоит отметить, что сокращение смертности от ССЗ в отдаленном периоде после трансплантации может увеличивать распространенность поздних смертей от рака и инфекции. Это отмечено на примере исследований из Бельгии [16] и США [12], в которых первое место среди причин смертности занимали злокачественные новообразования, затем инфекции и ССЗ.
Таким образом, основная причина смерти после трансплантации может различаться в разных популяциях [26]. Инфекции лидировали среди причин смертности в исследованиях из Турции (58,6%) [13] и Бразилии (53%) [14]. По мнению некоторых авторов, инфекции, по-видимому, являются доминирующей причиной смертности реципиентов почечного трансплантата в развивающихся странах [27, 15]. В нашем исследовании уровень смертности от инфекций и их осложнений был самым минимальным, похожими были результаты исследования из Канады и США [17] (табл. 4, рис. 6).
Заключение
Данные Московского регистра ГКБ 52 ДЗМ по выживаемости, инфекционной и ССС оказались лучше, чем такие же показатели в зарубежных медицинских центрах, при этом системной ошибки в мета-анализе не было. Однако с учетом ограничений, связанных со временем наблюдения и числом работ, включенных в мета-анализ, требуются дальнейшие исследования по изучению смертности среди РПТ.



