ВВЕДЕНИЕ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) и рак предстательной железы (РПЖ) являются двумя наиболее распространенными урологическими заболеваниями, влияющими на мужское здоровье в течение жизни. За последние десятилетия в большинстве стран мира отмечается выраженная тенденция к распространению ДГПЖ, что обусловлено старением населения и, соответственно, увеличением доли мужского населения старших возрастных групп [1]. По официальным данным, заболеваемость ДГПЖ с начала века выросла в России в 1,5 раза, составив к 2009 г. 2221,5 на 100 тыс. взрослого мужского населения [2]. РПЖ в настоящий момент занимает второе место по распространенности злокачественных новообразований и является второй по распространенности причиной смерти мужчин в США и многих западных индустриальных странах. В 2012 г. в США 241,740 мужчины был установлен диагноз рака простаты и 28,170 – погибли от него [3]. РПЖ широко распространен в России, характеризуется высокими темпами роста заболеваемости и смертности. Последняя обусловлена поздней диагностикой и множеством наблюдаемых пациентов с местнораспространенными и диссеминированными формами РПЖ [4]. Поэтому разработка и внедрение в клиническую практику программ ранней диагностики РПЖ служат не только важной медицинской, но и большой социальной и экономической задачей государственного значения. Существующие методы диагностики и стадирования РПЖ, такие как пальцевое ректальное исследование (ПРИ), трансректальное ультразвуковое исследование (ТРУЗИ), магнитно-резонансная томография (МРТ) и биопсия предстательной железы, не всегда могут дать четкий ответ о наличии и характере течения РПЖ. До недавнего времени считалось, что проблему точной диагностики РПЖ решает определение простатспецифического антигена (ПСА), однако в настоящее время найдены убедительные данные о недостаточной диагностической значимости этого маркера [5]. В связи с этим существует необходимость в разработке новых методов ранней диагностики и прогнозирования течения РПЖ. Ki-67 является маркером пролиферативной активности клеток, экспрессию этого ядерного белка многие исследователи считают прогностическим фактором для большинства опухолей, включая и рак предстательной железы [6]. Коллаген IV – основной компонент базальной мембраны эпителиальных клеток, он также встречается в стенке артериальных сосудов и собственном веществе соединительной ткани. Инвазивные свойства опухолевых клеток связаны с разрушением этого важного компонента соединительной ткани.
 В настоящем исследовании изучалось распределение коллагена IV и белка Ki-67 в базальной мембране и строме различных опухолевых образований – от доброкачественной гиперплазии предстательной железы до аденокарциномы 5-й градации по шкале Глисона.
В настоящем исследовании изучалось распределение коллагена IV и белка Ki-67 в базальной мембране и строме различных опухолевых образований – от доброкачественной гиперплазии предстательной железы до аденокарциномы 5-й градации по шкале Глисона.
МАТЕРИАЛ И МЕТОДЫ
В работе был использован операционный материал 53 пациентов c диагнозом «аденокарцинома предстательной железы», средний возраст больных составил 67 с интервалом от 52 до 83 лет. В качестве контроля использован биопсийный материал 10 пациентов той же возрастной группы с диагнозом «доброкачественная гиперплазия предстательной железы».
Гистологическая оценка новообразований выполнена с использованием баллов шкалы Глисона, которое соответствовало наиболее выраженным анапластическим изменениям клеток опухолевых желез, выявленных при биопсии у данного пациента.
Иммуногистохимическое исследование проведено в соответствии со стандартным протоколом. Ткани фиксировали в 10 %-ном забуференном формалине (рН – 7,4) и заливали в парафин. Использован парафин с температурой плавления +54°С.
Нарезали серийные срезы толщиной 5 мкм и наклеивали на поли-L-лизиновые стекла. Депарафинизация выполнена в термостате при температуре +60°С в течение часа. После погружения в ксилол срезы регидрировались проводкой по спиртам в убывающей концентрации в течение 15 минут.
Восстановление антигенной активности осуществлено методом теплового демаскирования в 0,01 М-цитратном буфере в мини-автоклаве DAKO либо в 6,6 %-ном растворе Proteinas K (Novocastra) при исследовании коллагена IV.
Блокирование эндогенной пероксидазной активности выполнено с помощью 3 %-ной перекиси водорода в течение 10 минут.
В работе использованы следующие антитела к антигенам человека:
- моноклональные мышиные антитела к белку Ki-67 (MM1, Diagnostic Biosystems, 1 : 200);
- моноклональные мышиные антитела к коллагену IV (PHM-12, Thermoscientific, 1 : 100).
Для проведения иммуногистохимической реакции на срезы наносили 50 мкл разведенной первичной сыворотки. Срезы инкубировались при 37°С в течение 30 минут. Выявление иммунных комплексов проведено при помощи безбиотиновой системы детекции на основе пероксидазы хрена (N-Histofine, Япония).
После каждой инкубации срезы отмывали в фосфатно-солевом буфере, подсушивали вокруг, затем для визуализации реакции на них наносили ДАБ (3,3-диаминобензидин), что позволяло получать специфическую коричневую окраску. Интенсивность иммуногистохимической реакции в каждом препарате контролировалась под микроскопом: после достижения необходимой интенсивности окрашивания срезы отмывали в дистиллированной воде, а затем в течение 3 минут докрашивали гематоксилином Майера.
В качестве индикатора пролиферативной активности использован индекс пролиферации Ki-67 (ИП Ki-67), который определялся долей интенсивно окрашенных ядер при учете 300 клеток, выраженной в %.
Распределение коллагена IV в базальной мембране желез простаты оценивали полуколичественным методом по следующим показателям: 0 – отсутствие коллагена вдоль базальной мембраны, 1– наличие тонкой полоски коллагена, 2 – толстая полоска коллагена вдоль базальной мембраны, сравнимая по толщине и интенсивности окрашивания стенки сосудов.

Фотографирование объектов проведено с помощью бинокулярного микроскопа Axiostar plus (Carl Zeiss, Германия) и цифровой видеокамеры для микроскопии AxioCam MRc 5 (D) (Carl Zeiss, Германия). Полученные с помощью камеры изображения имели разрешение 2584 х 1936 точек (5 млн точек). Формат сохранения изображения *.jpg при увеличении х 200 или х 400.
Статистическую обработку полученных данных проводили с помощью программы STATISTICA 10.0. В таблицах приведены средние значения М + s, где s – среднее квадратичное отклонение. С учетом ненормального распределения полученных статистических показателей сравнение двух независимых групп осуществлено непараметрическим методом при помощи U-критерия Манна–Уитни. Достоверным считали различия средних при уровне статистической значимости p < 0,05. Корреляционные взаимоотношения между числом Глисона опухоли, ПСА, индексом пролиферации клеток и выраженностью экспрессии MMП-9 оценивали с помощью коэффициента корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
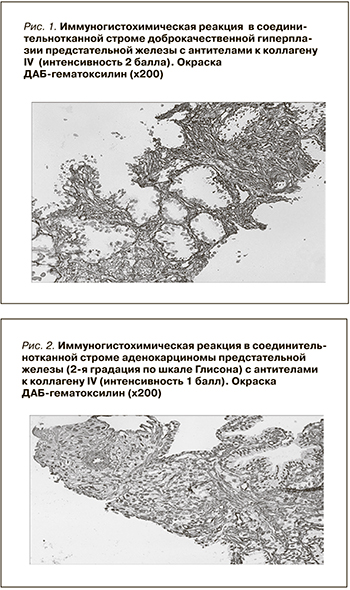
При иммуногистохимическом исследовании коллаген IV выявлен вдоль базальной мембраны железистых клеток в виде тонкой коричневой полоски различной интенсивности. Коллаген IV мелких артериол соединительнотканной стромы, как правило, окрашивает стенку сосудов в интенсивный коричневый цвет.
На рис. 1 представлена иммуногистохимическая реакция в соединительнотканной строме доброкачественной гиперплазии предстательной железы с антителами к коллагену IV (интенсивность – 2 балла), при этом видны толстые коричневые полоски коллагена IV, распределяющиеся вдоль базальной мембраны желез. Масса коллагена выявляется также в соединительнотканной строме простаты.
При исследовании распределения коллагена IV в препаратах с аденокарциномой предстательной железы интенсивность иммуногистохимического окрашивания зависела от градации опухоли по шкале Глисона. На рис. 2 представлена ИГХ-реакция в соединительнотканной строме аденокарциномы предстательной железы с 2-й градации по шкале Глисона, при этом интенсивность окраски менее выражена по сравнению с ДГПЖ и соответствует 1 баллу, однако тонкие волокна коллагена окружают отдельные клеточные элементы.
С увеличением числа Глисона более 3-й градации коллагеновые волокна полностью исчезают вокруг опухолевых клеток.

Для оценки пролиферативной активности был использован индекс пролиферации Ki-67, определенный отношением количества клеток с интенсивной ядерной реакцией на Ki-67 к общему числу клеток.
В контрольном материале, представленном доброкачественной гиперплазией предстательной железы, отдельные пролиферирующие клетки располагались только в базальном клеточном слое, пролиферативная активность клеток секреторного клеточного слоя не отмечена (рис. 3).
В аденокарциномах различных градаций в настоящем исследовании выявлен широкий спектр пролиферативной активности секреторных железистых клеток. При исследовании группы пациентов с опухолями 2-й градации по шкале Глисона пролиферативная активность секреторных опухолевых клеток (ИП Ki-67) составила 5,3 + 1,1 % (рис. 4, табл. 1).
Опухоли 3-й градации по шкале Глисона также характеризовались умеренной пролиферацией (7,2 ± 1,4 %).

В высокоинвазивных аденокарциномах 4-й и 5-й градаций нами отмечено увеличение пролиферативной активности атипических клеток (см. табл. 1, и рис. 4). В опухолях 4-й градации уровень пролиферации соответствовал 10,0 ± 3,9 %, а 5-й – 17,2 ± 9,4 %. Достоверные различия выявлены между всеми исследованными градациями опухолей за исключением низкодифференцированных аденокарцином, пролиферативная активность опухолей 4-й и 5-й градаций достоверно не различались (табл. 2).
В аденокарциномах различных градаций в настоящем исследовании выявлен широкий спектр пролиферативной активности секреторных железистых клеток. Достоверные различия выявлены между всеми исследованными градациями опухолей за исключением низкодифференцированных аденокарцином, пролиферативная активность опухолей 4-й и 5-й градаций достоверно не различалась. Проведенные исследования показали, что при доброкачественной гиперплазии предстательной железы высокая экспрессия коллагена IV, а в аденокарциноме предстательной железы коллаген IV разрушается за счет действия протеолитических ферментов.
Установлена умеренная положительная корреляционная связь между градацией по шкале Глисона и индексом пролиферации клеток по показателю Ki-67 (rs = 0,674). Нами установлено, что пролиферативная активность анапластических клеток аденокарциномы различных градаций по шкале Глисона, определяемая с помощью моноклональных антител Ki-67, является чувствительным тестом для дифференциальной диагностики этих новообразований, а при необходимости – высоконадежным методом дифференциальной диагностики между ДГПЖ и РПЖ.

